超声波辅助提取川楝子多糖的工艺
2014-10-20马彦军
马彦军
浙江大学创新技术研究院有限公司,浙江杭州 310000
0 引言
川楝子为楝科楝属川楝的果实,别名金铃子,广泛分布于四川、湖北、贵州、河南等地.川楝子具有很大的药用价值,具有舒肝、行气止痛、驱虫等作用.用于胸胁、脘腹胀痛、疝痛、虫积腹痛.主要治疗胃病、胁痛、淋证、急性乳腺炎、带状疱疹、皮肤病和前列腺炎等.另外,川楝子与其它药物配伍可以治疗肠粘连,达到行气开郁、散结止痛之效.这些药理活性是否与其多糖成分有关还有待研究[1].
糖苷键结合多个单糖分子的天然大分子多糖,广泛存在于动植物和微生物组织中,不但有合成高分子所没有的特殊生物活性、生命有机体的非常重要组成部分,而且还有众多生物学功能.多糖在中药材中分布非常普遍.近来研究发现,中药多糖不仅具有降血糖作用,还可以延缓糖尿病并发症的进展;中药多糖在心、脑血管病中的广泛应用,与其抗凝血、降血脂、抗动脉粥样硬化的作用密切相关;中药多糖在保肝、保护神经元、增强性功能方面也具有一定作用.因此,开发多糖资源、寻求优异的提取工艺是一项十分有意义的工作[2].
超声提取其实是个物理破碎过程,在超声波频率大于20kHz时,产生特殊的机械振动和空化作用,以及强大的能量,加速媒质进入振动状态,接着使其结构发生变化,有效成分进入溶剂中.空化泡瞬间涨大花前并且破裂,形成一种高温高压环境,在强大的冲击波和微声波作用下使细胞壁结构被破坏[3].
微射线辐射溶剂可以透过细胞壁到达细胞内部,频率介于300MHz和300GHz之间的电磁波称之为微波,微波和超声波辅助提取能提高有效成分的提取得率,缩短提取时间,但有时会造成提取物的组分更加复杂,分离困难[3].
先前有很多学者从不同植物中进行多糖的提取,每种植物的多糖的含量也是区别很大的,而且在同样的条件下不同植物的多糖提取率也不相同,甚至有些相差很大.下面列举一些中药植物提取多糖的研究成果的例子.
叶下珠系大戟科叶下珠属植物,又名珍珠草、关门草等,叶下珠主要含有黄酮类、木脂素类、生物碱类、多糖、有机酸等多种成分.周宇等[4]对其多糖的含量以及提取工艺进行了研究,最终优选工艺条件是在80℃温度条件下,按料液比为1∶15,共提取3次,按提取时间90min,在这种条件下多糖得率是6.1%[9].
上述的几种中药植物在医药上有着极为重要的作用,研究其多糖提取的方法也是极为重要的.通过借鉴这些研究成果,本实验考察了川楝子多糖的提取工艺.即采用超声波辅助法从川楝子中提取多糖,通过单因素实验和正交实验法优选川楝子多糖的最佳工艺参数,以其找出合理可行的提取工艺条件,为充分开发川楝子多糖资源提供基础数据.
其次,学生学习产生困惑时。学生个体在学习的过程中,由于知识体系不完善、学习体验缺失或者学习方法缺失,有时会产生学习困惑。在学生学习困惑超越学生个体能力时,开展合作学习则能够帮助学生解决学习过程中的困惑。
1 实验部分
1.1 仪器
KQ-500DE型数控超声波提取器,昆山市超声仪器有限公司生产;RE-52A型旋转蒸发仪,上海亚荣生化仪器厂生产;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司生产;FA2004型分析天平,上海恒平科学仪器有限公司生产.
1.2 材料和试剂
川楝子,产于河北省;无水乙醇,天津市红岩化学试剂厂生产;石油醚,天津市北方天医化学试剂厂生产.
1.3 实验材料的预处理
将川楝子用粉碎机粉碎,过孔径0.90 mm筛,然后用电子分析天平准确称20 g,备用.超声波辅助提取之前,需要对原料进行脱脂脱色处理,即用无水乙醇和石油醚按体积比为2∶1的比例浸泡川楝子粉末,每隔1 h换一次浸泡液,每次浸泡2 h,共浸泡两次.然后将原料抽干,进行超声波辅助提取.
1.4 超声波辅助提取的单因素实验
根据文献[1-12],影响川楝子超声提取的主要因素有提取温度、提取时间、超声功率、料液比、超声发生器的工作间歇时间比等.本实验主要考察提取温度(A)、料液比(B)、提取时间(C)、超声功率等因素.在各单因素实验中,超声波提取的其它条件为:水为提取溶剂,无水乙醇用于沉淀多糖,石油醚和无水乙醇用于脱脂脱色.
1.4.1 料液比对多糖得率的影响 20 g川楝子粉末脱脂脱色后,在超声温度55℃、超声功率300 W、超声时间1 h的条件下,在料液比分别为1∶5、1∶10、1∶15下提取川楝子中多糖,经抽滤,滤液经旋转蒸发浓缩至一定体积,然后用3倍无水乙醇醇沉两次,每次醇沉1 h,多糖沉淀抽滤后,用少量蒸馏水溶解,加入3倍量无水乙醇再次进行第二次醇沉,再进行抽滤,然后将抽滤后的多糖粗品烘干,称量多糖粗品,计算得率.
1.4.2 提取温度对多糖得率的影响 称取20 g预处理好的川楝子,在料液比为1∶10、超声功率为300 W、提取时间为60 min条件下,分别在25、45、65℃的温度下提取川楝子多糖,经抽滤,滤液进行旋转蒸发浓缩到一定体积,然后用3倍无水乙醇醇沉两次,每次醇沉1 h,第1次多糖沉淀抽滤后,用少量蒸馏水溶解,加入3倍量无水乙醇进行第2次醇沉,再进行抽滤,然后将抽滤后的多糖粗品烘干,称量烘多糖粗品,计算得率.
1.4.3 提取时间对多糖得率的影响 称取20 g预处理好的川楝子,在料液比为1∶5、提取功率为300 W、提取温度为25℃条件下,分别在30、60、90 min提取川楝子多糖,抽滤,然后把滤液旋转蒸发浓缩,用3倍无水乙醇醇沉2次,每次醇沉1 h,第1次多糖沉淀抽滤后,用少量蒸馏水溶解后,在加入3倍量无水乙醇进行第2次醇沉,再进行抽滤,然后将抽滤后的多糖粗品烘干,称量多糖粗品,计算得率.
1.5 超声波辅助提取的正交实验
在单因素实验的基础上选择适当的因素和水平进行正交实验,通过极差分析,以确定最佳的提取条件.
2 结果与分析
2.1 超声波辅助提取的单因素实验
2.1.1 料液比对多糖得率的影响 在提取温度为55℃,提取时间为60 min,提取功率为300 W的相同条件下,料液比分别为1∶5、1∶10和1∶15时多糖的得率见下表1.
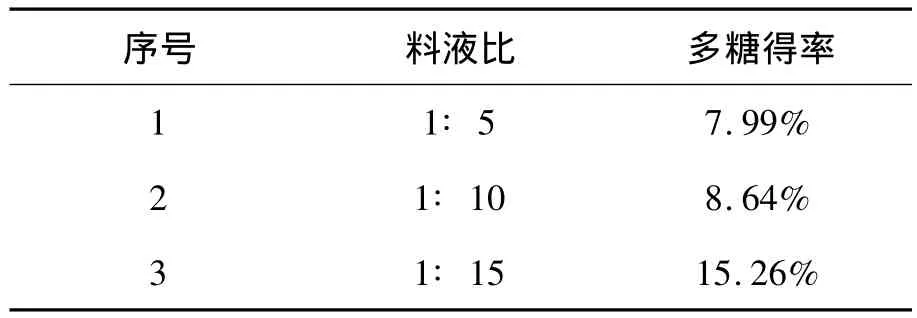
表1 料液比对多糖得率的影响Table 1 Effect of solid-liquid ratio on the yield of polysaccharides
由表1,多糖收率随着料液比的增加而升高,当料液比为1∶15,多糖得率相对较高.根据文献[1]采用水提取法从川楝子中提取多糖的料液比选择1∶15,并且溶剂量太小,多糖就不能完全溶出;溶剂量太大,超声波辐射会被溶剂大量吸收,不能完全作用于物料,影响多糖得率.综合考虑,溶剂比例不易过多,本实验选择1∶15进行正交实验.
2.1.2 提取温度对多糖得率的影响 在料液比为1∶10、提取时间为1 h、提取功率为300 W的相同条件下,提取温度为25、45℃和65℃,多糖的得率见表2.

表2 提取温度对多糖得率的影响Table 2 Effect of temperature on the extraction yield of polysaccharides
由表2,多糖得率随着温度的升高而降低,当温度在25℃时多糖得率相对较高.根据文献[12]可能是因为温度升高,加快川楝子多糖降解,导致多糖得率降低;如果温度太低,提取又不完全.故选择25℃进行正交实验.
2.1.3 提取时间对多糖得率的影响 在提取温度为25℃、提取功率为300 W、料液比为1∶5的相同条件下,提取时间分别为30、60 min和90 min时多糖的得率见下表3.
由表3知,时间对提取率影响较小,随着提取时间的增加提取率变化不大,30 min时多糖得率相对较高.超声时间短,溶出物较少,多糖含量较低;超声时间长,能耗多,同时提取物中的茶多糖会发生部分降解,使多糖得率降低.所以正交实验未考虑时间的影响,提取时间均为30 min.

表3 提取时间对多糖得率的影响Table 3 Extraction time on the yield of polysaccharides
结合单因素实验,按料液比、提取温度和超声波频率为影响因素,设计正交实验分析其对川楝子多糖提取率的影响,设计L9(34)正交实验,多糖得率为指标选择最佳的提取工艺.为了提高统计分析的可靠性,每组实验重复3次,测定结果以平均值统计分析.因素水平表见表4.
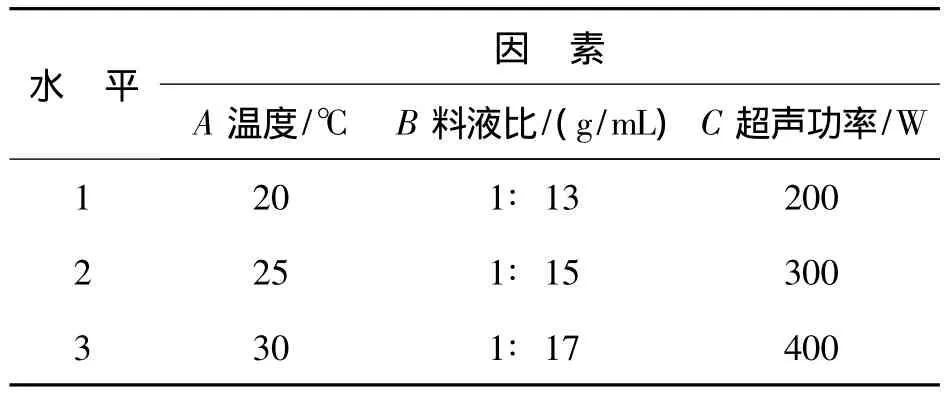
表4 因素水平表Table 4 The form of factors level
2.2 超声波辅助提取的正交实验
利用超声波提取法从川楝子中提取多糖的正交实验结果见表5、6.
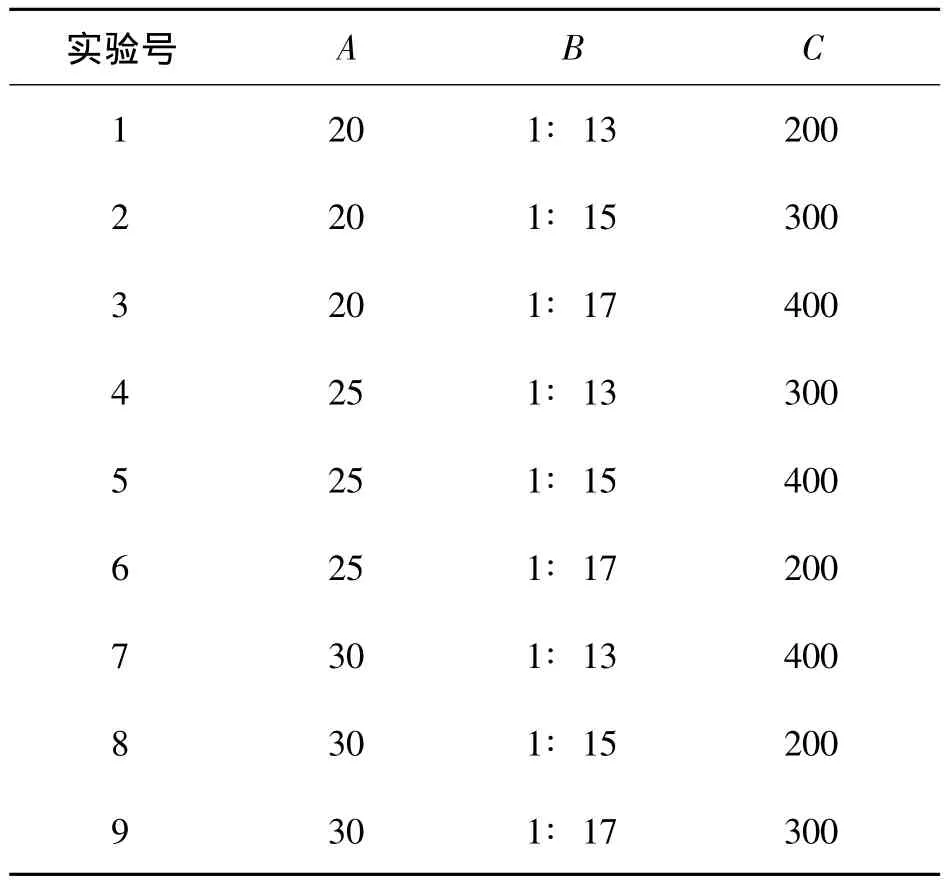
表5 正交实验设计表Table 5 Orthogonal experimental design table
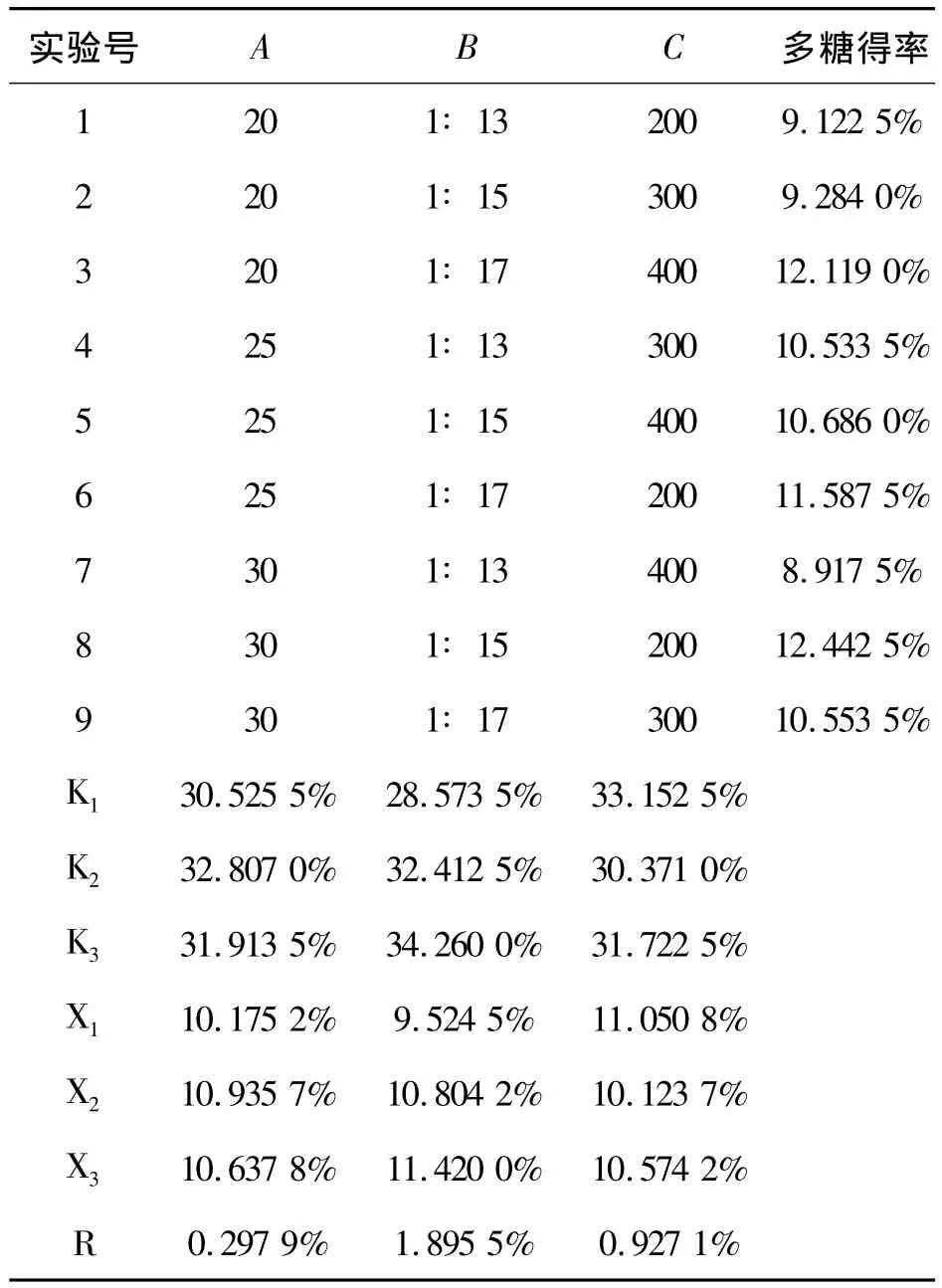
表6 正交实验及结果Table 6 Orthogonal experimental and Result
表6结果表明,极差R的大小顺序为B>C>A,即影响川楝子多糖提取率主次关系依次是料液比>超声功率>提取温度.川楝子多糖的最佳提取工艺条件为A3B2C1,即温度为30℃,料液比为1∶15,超声功率为200 W.其中,8号实验,即温度为30℃,料液比为1∶15,超声功率为200 W,提取时间为30 min,川楝子多糖提取得率最高,为 12.442 5%.
在温度为30℃,料液比为1∶15,超声功率为200 W,提取时间为30 min的优化条件下,采用超声波辅助提取法提取川楝子多糖,从而得到优化条件下的提取率.结果见表7.
根据表7,在最佳工艺条件下超声波辅助提取川楝子多糖的提取率达13.878%.与传统水提川楝子多糖文献[1]相比,超声波辅助提取法其多糖得率高,而且提取时间短、节约原料.

表7 最佳工艺条件下多糖提取率Table 7 Polysaccharides extraction rate under optimum conditions
3 讨论
a.根据文献粒度对多糖提取影响不大,所以实验过程中没有考察粒度对提取率的影响.为减小实验误差,实验前将川楝子粉碎后过孔径0.85 mm筛,以保证粒度基本一致.
b.超声波提取实验中,仪器内水面高度要超过川楝子所在的液面,以保证物料超声充分;由于超声仪器内水面的散热,使实际水温与显示温度有差异,因此在锥形瓶内放入温度计,时刻观察温度的变化,进而调节超声仪器内水温的变化,提取温度以温度计的温度为准;另外,超声温度升至设定温度时,开始计量提取时间.
c.在多糖提取过程中,由于提取液的多次转移使器壁上有残留液以及醇沉后多糖沉淀附着在器壁等诸多因素,均会导致多糖产品收集不完全,从而产生误差,使实验结果偏低.
d.在进行旋转蒸发时,应将提取液尽量浓缩至小体积,这样醇沉时可以节省无水乙醇的用量;在浓缩结束后,瓶壁上会附有少量的提取液,实验中用少许水润洗瓶壁,以达到尽量降低实验误差的目的.
e.因为KQ-500DE型数控超声仪器的功率上线是500 W,使用范围比较小,所以单因素实验过程中没有考察超声功率对提取率的影响.
f.根据单因素实验结果,提取时间对于川楝子多糖得率的影响很小,所以正交实验时未将提取时间作为研究对象.从节省时间和能源的角度考虑,正交实验中提取时间均选定30 min.
4 结语
采用超声波辅助提取法从川楝子中提取多糖,水为溶剂,提取30 min,通过L9(34)正交实验,提取率为评价指标进行优化.结果表明,最优提取温度30℃、超声功率200 W、料液比1∶15,在该组合条件下最高提取率为13.878%,各因素对多糖提取率影响的先后顺序为:料液比、提取功率、提取温度和提取时间.超声波辅助提取法与传统水提取法比较的结果是多糖提取率高、时间短、能耗少等优点,采用超声波辅助提取多糖是一种切实可行的好方法.
[1]贺亮,宋先亮,殷宁,等.川楝子总黄酮和多糖提取及其抗氧化活性研究[J].林产化学与工业,2007,27(5):78-82.HE Liang,SONG Xian-liang,YIN Ning,et al.Sichuan fruit flavonoids and polysaccharide extraction and their antioxidant activity[J].Forest Chemistry and Industry,2007,27(5):78-82.(in Chinese)
[2]潘九英,陈慧瑾,许颖.中药多糖药理作用研究的新进展[J].中华实用中西医杂志,2007,20(19):56-58.PAN Jiu-ying,CHEN Hui-jin,XU Ying.Traditional Chinese medicine polysaccharide research progress of pharmacological effects[J].The?Practical Journal of Chinese and Western Medicine,2007,20(19):56-58.(in Chinese)
[3]许燕燕.植物多糖的提取方法和工艺[J].福建水产,2006,8(3):32-36.XU Yan-yan.Method for extracting plant polysaccharides and process[J].Fujian aquatic products,2006,8(3):32-36.(in Chinese)
[4]周宇,杨郭.正交实验优选叶下珠中多糖的提取工艺[J].化工时刊,2009,23(8):32-33.ZHOU Yu,YANG Guo.Orthogonal experiment optimizing the extraction process of polysaccharide in the bead[J].Chemical Industry Issue,2009,23(8):32-33.(in Chinese)
[5]苗明三,杨林莎.百合多糖免疫兴奋作用[J].中药药理与临床,2003,19(1):15-16.MIAO Ming-san,YANG Lin-sha.The role of immune lily polysaccharide excited[J].Clinical Pharmacology of Traditional Chinese Medicine,2003,19(1):15-16.(in Chinese)
[6]赵国华,李志孝,陈宗道.百合多糖的化学结构及抗肿瘤活性[J].食品与生物技术,2002,21(1):62-66.ZHAO Guo-hua,LI Zhi-xiao,Chen Zong-dao.Chemical structure and antitumor activity of polysaccharides in Lilium[J].The Food and Biotechnology,2002,21(1):62-66.(in Chinese)
[7]禹文峰,任凤莲,吴晓斌.百合多糖的超声波提取工艺研究[J].广州化学,2007,32(2):36-40.YU Wei-feng,REN Feng-lian,WU Xiao-bin.Study on ultrasonic extraction of polysaccharides in Lilium[J].Guang-zhou Chemistry,2007,32(2):36-40.(in Chinese)
[8]孙建,周洪雷.中药川楝子临床应用研究[J].辽宁中医药大学学报,2008,10(1):27-28.SUN Jian,ZHOU Hong-lei.Traditional Chinese medicine(TCM)sichuan fruit clinical application research[J].Journal of Liaoning University of Traditional Chinese medicine,2008,10(1):27-28.(in Chinese)
[9]汪东风,谢晓凤,严峻,等.茶多糖等有效成分综合提取研究[J].中草药,1998,29(11):739-740.WANG Dong-feng,XIE Xiao-feng,YAN Jun,et al.Tea polysaccharide from active ingredients such as comprehensive research[J].Chinese Herbal Medicine,1998,29(11):739-740.(in Chinese)
[10]李小平.红枣多糖提取工艺研究及其生物功能初探[D].西安:陕西师范大学,2004:19-20.LI Xiao-ping.Red jujube polysaccharide extraction technology was studied and its biological functions[D].Xi’an:Shanxi Normal University Graduate Dissertation,2004:19-20.(in Chinese)
[11]ZHOU Sheng-hong.Thirty cases of chronic cholecystitis treated by acupuncture and oral adiministration of Da Chai Hu Tang[J].Journal of Traditional Chinese Medicine,2008,28(3):173-174.
[12]CHEN Xiao-qiang,ZHANG Ying.Ultrasonic-associated extraction of water soluble polysaccharides from defatted Korean pine kernel[J].Journal of Forestry Research,2007,18(2):133-135.
