衰老过程中的运动干预对大鼠学习记忆能力及海马神经粘附分子表达的影响
2014-10-18袁琼嘉张金梅邓文骞王富鸿
袁琼嘉,张金梅,邓文骞,王富鸿,李 雪,王 璐
衰老是生物体不可避免的过程,伴随着衰老的进行各种器官的功能也会下降,其中,脑衰老就表现为学习记忆能力的衰退,这已成为影响众多老年人生活质量的主要原因之一。如何延缓衰老、提高老年人的学习记忆能力成为众多科学研究的热点。自由基理论是目前衰老研究的一个热点,该学说认为机体内存在一套完整的产生和清除自由基的动态平衡体系,老年人的防御功能减弱,脑自由基的清除能力降低,会导致过多的自由基聚集导致细胞膜、细胞器受损,诱导神经元凋亡,使其功能严重破坏,从而使学习记忆能力下降[18]。因此,减少自由基产生,增强机体抗氧化能力成为延缓衰老的一个重要手段。超氧化物歧化酶(Superoxide Dismutase,SOD)和谷胱甘肽过氧化酶(Glutathione peroxidase,GSH-PX)是机体内两种重要的抗氧化酶,丙二醛(Malondialdehyde,MDA)是脂质过氧化物的代谢产物,可间接反映自由基对机体的损伤程度,是目前常用来反映机体抗氧化能力的指标[19]。适宜的体育锻炼则能够加快自由基的清除,增强机体抗氧化能力[24,26]。研究已经证明海马是空间学习记忆形成的重要区域,学习记忆形成的神经基础是突触的可塑性(包括结构可塑性和功能可塑性)。而在突触可塑性中,神经细胞粘附分子(Neural cell adhesion molecule,NCAM)起了非常重要的调节作用[14],NCAM的正常表达不仅是海马形态保持和功能发育的必要条件,而且参与了海马学习记忆的形成过程[13]。有研究发现长期的中等负荷运动能够上调成年大鼠NCAM基因的表达[10]。然而,运动对大鼠衰老过程中脑功能的影响,以及这种影响是否与NCAM基因的表达的变化相关,尚不得而知。
本研究旨在通过对大鼠在衰老过程中进行有氧运动干预,观察有氧运动对大鼠脑衰老、学习记忆能力和海马NCAM表达情况的影响。为揭示有氧运动干预脑衰老、提高学习记忆能力及其机制提供神经生物学的实验数据。
1 材料与方法
1.1 动物分组及实验方案
4月龄雄性(SPF)级SD大鼠48只,体重409±32g。购于成都达硕生物科技有限公司,动物生产许可证CSXK(川)2008-24。动物分笼饲养,自由饮食,自然光照,动物房内温度26±3℃,相对湿度为40%~60%,国家标准啮类动物饲料喂养。大鼠购进后,适应性喂养1周,先随机分为生理盐水对照组(C组)、D-半乳糖衰老模型组(D组)、D-半乳糖致衰老+有氧运动干预组(DS组)3个大组。为期6周的衰老造模结束以后,每组再随机分为2个小组:一组自然喂养7天,为“N”组,另一组进行7天的Morris水迷宫实验,为“M”组,分别记录为:CN、DN、DSN、CM、DM、DSM组。
D-半乳糖(sigma公司)注射采用腹腔注射法,根据大鼠的体重,D组采用100mg/kg/d(用生理盐水将D-半乳糖稀释成5%浓度,即注射量为2ml/kg/d)的注射剂量,每天1次,持续6周,同时,C组进行同剂量的生理盐水注射,DS组上午进行D-半乳糖注射,晚上进行有氧运动,60 min/天,6天/周,共6周。游泳训练在玻璃游泳缸(150cm×60cm×100cm)内进行,水深80cm,水温32±2℃[4]。
1.2 Morris水迷宫行为学训练和测试
1.2.1 定位航行实验
每次训练将大鼠面向池壁依次从4个象限的固定入水点放入水中,电脑追踪记录大鼠从入水到登上站台所需要的时间(潜伏期);如果大鼠在2min内没有找到站台,将其引导至站台,停留10s,潜伏期为120s。连续训练6天,记录每只大鼠每天每个象限的潜伏期。
1.2.2 空间探索实验
第7天将迷宫内站台拆除,依次从第1~4象限的入水点将大鼠放入池中,记录每个象限1min内大鼠穿越原站台的次数。
1.3 动物取材及样本处理
各组大鼠按照造模设计时间分别处死,断头取脑,在冰冷的生理盐水中漂洗,除去血液,滤纸拭干,于冰上切割,剥离海马。将海马、大脑皮质分装入冻存管中,迅速放入液氮中保存。
1.4 自由基指标检测
大脑皮质蛋白含量、SOD酶活性、GSH-PX酶活性、MDA含量测定分别采用考马斯亮蓝蛋白测定试剂盒、SOD WST-1法测定试剂盒、微量还原型谷胱甘肽测定试剂盒、MDA测定试剂盒进行测定。以上试剂盒均由南京建成科技有限公司提供,实验操作方法严格按照说明书进行。
1.5 Real-time PCR检测海马NCAM基因的mRNA表达
采用Trizol法提取总的RNA:取适量海马组织,按50~100mg/ml Trizol加入Trizol;使用分光光度计(Thermo Scientific NanoDrop 2000)检测mRNA含量,估算其纯度和浓度,用2%的琼脂糖凝胶检测总RNA的完整性;采用iScriptTM DNA Synthesis Kit试剂盒(BIO-RAD)将RNA反转录为cDNA;采用SsoAdvancedTM SYBR○RGreen Supermix试剂盒(BIO-RAD)进行Real-time PCR反应。引物序列(TaKaRa宝生物工程有限公司):NCAM(扩增长度171 bp)上游:5′-Agg AgA AAT CAg CgT Tgg AgA-3′,下游:5′-TTg Tag ATg gTg Agg gTA gAg gA-3;β-actin(扩增长度99bp)上游:5′-CgT AAA gAC CTC TAT gCC AAC A-3′,下游:5′-Tag gAg CCA ggg CAg TAA TC-3′。反应结束后,数据处理采用2-△△CT(Livak)方法,在进行数据分析以前,先验证目标基因NCAM和参照基因β-actin扩增效率都接近100%,之后就可以运用2-△△CT法进行不同样本中目标基因表达水平的相对差异,数据由Bio-Rad CFX Manager system自动分析得出,图像由软件自动生成。
1.6 Western blotting检测海马NCAM基因的蛋白表达
海马称重,1mg加入20μl RIPA裂解液(1ml RIPA裂解液+10μl PMSF溶液)提取蛋白,测定蛋白浓度,然后用裂解液进行总蛋白定量,用蛋白将上样缓冲液稀释成1×,于100℃水浴锅中变性10min,-20℃保存备用;进行SDS-PAGE凝胶电泳,然后转移至硝酸纤维素薄膜(PVDF),将PVDF膜置于5%脱脂奶粉中室温封闭1h,用同样浓度的脱脂奶粉稀释一抗(ab9018)(1∶1000),4℃封闭过夜;用山羊抗小鼠lgG/辣根过氧化物酶标记的二抗检测目标蛋白。应用Quantity One分析软件,用条带轨迹定量分析法(TraceTracking)对图片上的条带进行灰度值分析,将上述目的基因扫描值与各自的β-actin表达产物扫描值相比,以其比值作为目的蛋白的表达量。
1.7 统计学分析
采用SPSS 17.0进行统计。实验结果均以“均数±标准差”表示。组间差异采用重复测量方差分析,处理前先对测量数据进行球形检验,如检验结果P>0.05,用单因素方差分析进行处理;如检验结果P<0.05,对重复测量方差分析检验结果中时间点F值的自由度调整后进行处理。取P<0.05时差异具有统计学意义。
2 结果
2.1 一般情况观察
与C组相比,D组大鼠精神不振、行动迟缓、嗜睡、皮毛卷曲枯黄、无光泽,毛发脱落严重。
2.2 自由基检测结果
由表1可见,DN组SOD、GSH-PX活性显著性低于DSN、CN组(P<0.01),而 MDA含量非常显著性高于DSN、CN组(P<0.01),其他各组之间相比均无显著性差异(P>0.05)。
表1 本研究大鼠大脑皮质自由基的表达一览表Table 1 Expression of Free Radicals of Rat Cerebral Cortex(U/mg,,n=5)
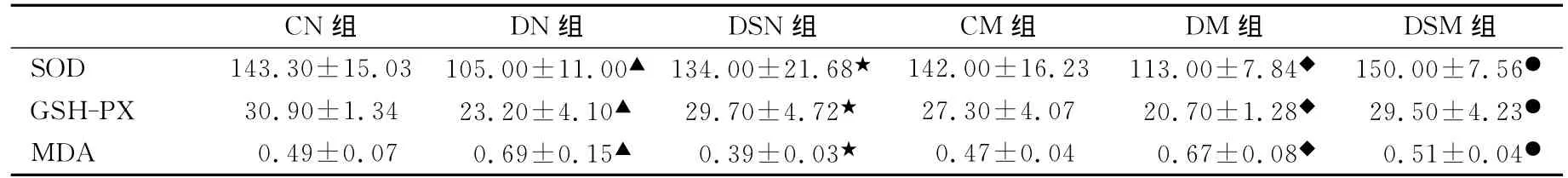
表1 本研究大鼠大脑皮质自由基的表达一览表Table 1 Expression of Free Radicals of Rat Cerebral Cortex(U/mg,,n=5)
注:▲表示与CN组相比P<0.01,★表示与DN组相比P<0.01,◆表示与CM组相比P<0.01,●表示与DN组相比P<0.01。
CN组 DN组 DSN组 CM组 DM组 DSM组SOD 143.30±15.03105.00±11.00▲ 134.00±21.68★ 142.00±16.23113.00±7.84◆ 150.00±7.56●GSH-PX 30.90±1.34 23.20±4.10▲ 29.70±4.72★ 27.30±4.07 20.70±1.28◆ 29.50±4.23●MDA 0.49±0.07 0.69±0.15▲ 0.39±0.03★ 0.47±0.04 0.67±0.08◆ 0.51±0.04●
2.3 Morris水迷宫行为学检测结果
2.3.1 Morris水迷宫定位航行平均潜伏期结果
由图1可见,各组大鼠的潜伏期随着训练次数增加逐渐缩短。Morris水迷宫训练期间,各组大鼠第2~6天潜伏期均显著短于第1天(P<0.05),第3~6天也显著短于第2天(P<0.05),第3~6天CM、DSM 组间无显著差异(P>0.05)。
2.3.2 Morris水迷宫空间探索实验结果
由表2可以看出,CM组大鼠穿越站台次数非常显著性多于DM(P<0.01),DSM组大鼠穿越站台次数显著性多于 DM(P<0.05)。
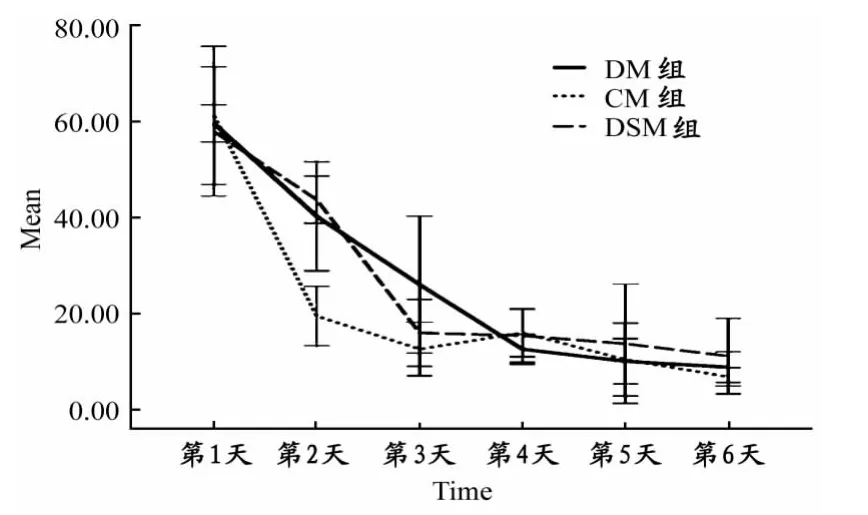
图1 本研究各组大鼠水迷宫定位航行平均潜伏期变化趋势示意图Figure 1.The Average Incubation Trends of Rats Water Maze Place Navigation
表2 本研究大鼠穿越站台次数一览表Table 2 The Through Number of Space Exploration of Rats()

表2 本研究大鼠穿越站台次数一览表Table 2 The Through Number of Space Exploration of Rats()
注:★表示与CM组相比P<0.01,▲表示与DM组相比P<0.05。
站台穿越次数CM组4.27±1.10 DM组 2.62±1.45★DSM组 3.91±1.76▲
2.4 大鼠海马NCAM mRNA及蛋白表达检测结果
2.4.1 海马NCAM mRNA实验结果
表3显示,CN、DSN组NCAM mRNA表达非常显著性上调于DN组(P<0.01);CM、DSM组也非常显著性上调于DM 组(P<0.01)。
2.4.2 海马NCAM蛋白表达实验结果
表4显示,CN、DSN组表达非常显著性上调于DN组(P<0.01);CM、DSM 非常显著性上调于DM组(P<0.01),且 DSM 组显著性上调于CM 组(P<0.05)。图3为各组大鼠NCAM蛋白及内参蛋白β-actin的western blot条带。
表3 本研究各组大鼠海马NCAM基因mRNA表达量一览表Table 3 The Express Quantity of NCAM mRNA of Rat Hippocampal()

表3 本研究各组大鼠海马NCAM基因mRNA表达量一览表Table 3 The Express Quantity of NCAM mRNA of Rat Hippocampal()
注:▲表示与CN组相比P<0.01,★表示与DN组相比P<0.01,◆表示与CM组相比P<0.01,●表示与DM组相比P<0.01。
CN组 DN组 DSN组 CM组 DM组 DSM组NCAM 1.39±0.08 0.31±0.04▲ 1.16±0.08★ 1.34±0.03 0.37±0.05◆ 1.37±0.09●
表4 本研究大鼠海马NCAM基因蛋白表达量一览表Table 4 The Express Quantity of NCAM Protein of Rat Hippocampal()

表4 本研究大鼠海马NCAM基因蛋白表达量一览表Table 4 The Express Quantity of NCAM Protein of Rat Hippocampal()
注:▲表示与CN组相比P<0.01,★表示与DN组相比P<0.01,◆表示与CM组相比P<0.05,●表示与DM组相比P<0.01。
CN组 DN组 DSN组 CM组 DM组 DSM组NCAM 0.78±0.03 0.26±0.06▲ 0.80±0.04★ 0.87±0.04 0.36±0.04◆ 0.96±0.07●

图3 本研究各组大鼠海马NCAM蛋白的表达示意图Figure 3.The Express Quantity of NCAM Protein of Rat Hippocampal in Every Group
3 分析与讨论
自由基衰老学说由1956年英国学者哈曼(Harman D)提出,该学说认为细胞代谢过程中不断产生自由基是引起人类衰老的主要原因[18]。自由基是生物体新陈代谢过程中产生的一类具有氧化活性的带负电的离子,自由基的过度堆积,会破坏细胞的结构,引起脂质过氧化,干扰人体正常的生理活动,最终导致疾病和衰老[25]。人体有一套清除体内自由基的防御系统,其中,SOD以及GSH-PX是体内清除自由基的主要酶类。SOD广泛存在于生物体的各种组织中,能催化体内自由基O-2(超氧阴离子自由基)歧化,而O-2可使脂质过氧化,损伤细胞膜,促使机体衰老。SOD和GSH-PX等协同可以将体内大部分的O-2反应掉。GSH-PX是机体内催化分解H2O2的酶,可以分解体内较多的过氧化物,减轻机体组织细胞内过氧化损伤,起到保护细胞膜结构和功能的作用[21],但是随着年龄的增大,SOD、GSH-PX等酶的活性降低,导致自由基清除能力减弱,过量的过氧化物堆积会造成机体生物膜的损伤,促使更多脂质过氧化的反应,使体内脂质过氧化产物MDA水平升高,MDA本身会对生物膜造成损伤,因此MDA含量的高低是机体氧自由基损伤程度的重要标志[17]。
在衰老相关研究中,衰老模型的建立较为关键,常用有自然衰老模型和药物致衰老模型,而腹腔注射D-半乳糖致衰老模型是国内外常用的药物衰老动物模型,其原理是机体半乳糖浓度升高会导致代谢紊乱,破坏并消耗机体抗氧化防御系统,使体内自由基脂质过氧化反应加剧,引起过氧化效应,产生大量氧自由基,导致机体的衰老[5-7]。本研究通6周的衰老模型之后,从一般情况观察,D组与C组相比,大鼠精神不振、行动迟缓、嗜睡、皮毛卷曲枯黄、无光泽,毛发脱落严重表现出明显衰老症状。通过自由基检测,D组大鼠大脑皮质SOD活性、GSH-PX活性显著性低于C组,MDA含量显著性高于C组,本研究结果可以证明本次D-半乳糖脑衰老造模成功。
运动对机体自由基代谢的影响主要包括两个方面:一方面是机体对自由基清除能力的影响,一方面是对自由基生成量的影响[9]。有实验证明:有氧运动对脑自由基代谢有着积极的影响,如,6周的跑台运动增高了大脑皮层和海马的SOD、GSH-PX的活性,降低了 MDA、LPO的含量[2];适度的有氧运动提高大脑的抗氧化能力,抑制脂质过 氧 化 反 应[1,4,8]。MDA 作 为 脂 质 过 氧 化 的 代 表 产 物 ,是衡量机体自由基反应强度的敏感指标。它的含量反映了机体脂质过氧化的速率和强度,间接反映体内自由基的水平[16,22]。本研究发现,与 DN组相比,进行了有氧运动干预的DSN组大鼠SOD、GSH-PX的活性显著的升高,同时,脂质过氧化产物MDA的含量降低了,表明6周的有氧运动能够显著提升机体的抗氧化能力,从而对D-半乳糖诱导的衰老过程起到积极的干预作用。
然而这种运动干预能否对衰老过程中伴随的脑功能的下降起到积极的影响?研究者采用Morris水迷宫实验进行了验证。Morris水迷宫是英国著名的心理学家Morris设计并应用于研究脑学习记忆机制的一种实验手段,已经被广泛应用于学习记忆、老年痴呆、海马/外海马研究、智力与衰老等多个学科的科学研究,在世界上已经得到广泛地认可,平均潜伏期是检测大鼠空间学习记忆能力的重要指标[11]。本研究结果发现,各组大鼠的潜伏期随着训练次数的增加逐渐缩短,说明大鼠在学习过程中能够产生短时记忆,并改善再次学习过程;各组大鼠第2天平均潜伏期与第1天相比均有显著性差异,表明3个组的大鼠空间学习记忆的初步形成都是在第1天训练之后;这可能是短时记忆的形成阶段;在第2天和第3天之间波动较大,此时可能是记忆进入泛化阶段,空间记忆不稳定,而C组大鼠的学习效果明显优于采用了D-半乳糖致衰老的D组,提示大鼠衰老过后对新鲜事物的学习速度有所下降。第4天以后变化趋势开始趋于平稳,可能是由于学习已经进入自动化阶段;第6天时各组大鼠的潜伏期间无明显差异,表明经过6天的重复练习,大鼠基本都能够产生学习效果。第7天的空间探索实验是为了探讨各组大鼠的记忆能力是否有差别,结果发现,DM组大鼠穿越站台次数显著性少于CM组,表明衰老减弱了大鼠的空间记忆能力,而DSM组大鼠的平台穿越次数显著性高于DM组,提示在衰老过程中进行有氧运动锻炼可以提高空间学习记忆能力,对这种衰老引起的脑功能下降起到一定的延缓作用。结合对各组大鼠脑抗氧化能力的检测结果,提示运动这种改善脑功能的机制可能是通过提高神经细胞的抗氧化能力,从而减少脑衰老过程中海马神经元的凋亡,达到延缓脑的衰老。然而,学习和记忆是一个信息长期储存的复杂过程,其具体机制尚未明了,目前普遍接受的是突触连接的加强对信息的储存有利,那么运动是否也是通过改善突触联系来影响大鼠学习记忆能力,研究者进行了进一步的研究。
NCAM属于细胞粘附分子免疫球蛋白超家族成员之一,是神经发育的关键因子,在轴突和树突的生长以及突触可塑性中起着关键的作用。海马是学习记忆产生的关键部位,NCAM的正常表达不但能够维持海马的形态正常 ,对 其 功 能 的 保 持 更 是 意 义 重 大[15,23]。 如 果 将 小 鼠NCAM-180基因敲除,其神经细胞的迁移干扰和损害了海马精细细胞结构,致使苔藓纤维不能正常成束、神经纤维末端分布错乱等,进而影响了学习记忆的形成[20],而通过转基因手段提高细胞外域NCAM的表达水平能够提高皮质可塑性,改善记忆能力[12],国内也有研究者报道通过观察脑损伤后海马ChAT和NCAM的含量的变化,发现脑损伤后认知障碍变化趋势与海马ChAT和NCAM的含量变化趋势相似[3]。这些报道均表明,NCAM的表达水平,尤其是在大脑海马区域的表达,对于个体的学习记忆能力有着显著的影响。而运动能否改变NCAM的表达水平?在前期研究中,研究者发现7周的中等负荷运动能够明显改善正常大鼠NCAM蛋白的表达[10]。本研究试图探讨运动与衰老所致的学习记忆下降及NCAM表达的关系。结果发现伴随着脑的衰老,学习记忆能力的下降,海马的NCAM的表达水平也下降。6周的有氧运动干预可以明显改善NCAM的表达,减少其下降水平,这与行为学测试结果相一致,提示衰老过程中的有氧运动干预可能是通过维持海马NCAM基因的正常持续表达,从而改善衰老大鼠的学习记忆能力,然而,鉴于学习记忆过程的复杂性,以及运动对于机体影响的广泛性,这可能仅仅是其中的原因之一,更为具体的机制仍有待进一步研究。
4 结论
衰老过程中的有氧运动干预可以提高大鼠脑SOD、GSH-PX的活性,抑制MDA的生成,并且改善大鼠的空间学习记忆能力;运动可能是通过上调NCAM的基因的表达影响衰老大鼠的学习记忆能力。
[1]何敬和,刘冠男,常震,等.适量有氧运动延缓脑衰老的作用及机制研究[J].中国健康教育杂志,2011,27(12):926-929.
[2]焦伟伟.不同负荷运动对大鼠脑衰老及学习记忆能力的影响[D].石家庄:河北师范大学硕士学位论文,2010.
[3]康德智,赵卫良,王灯亮.大鼠脑损伤后ChAT、NCAM表达及其与认知障碍变化的关系[J].福建医科大学学报,2010,44(5):320-323.
[4]陆碧琼.不同负荷间歇运动对衰老小鼠自由基代谢及抗氧化酶活性影响的研究[D].开封:河南大学硕士学位论文,2012.
[5]雷鸣.D-半乳糖致脑衰老的机制研究[D].南京:南京医科大学硕士学位论文,2008.
[6]雷鸣,朱祖健.D-半乳糖致衰老的研究进展[J].解剖科学进展,2011,17(1):83-85.
[7]彭成.中医药动物实验方法[M].北京:人民卫生出版社,2008.1082-1083.
[8]仇乃民,李巧云,马思远.六周有氧训练对高温环境下运动大鼠自由基水平的影响[J].吉林体育学院学报,2012,28(6):10-13.
[9]张丽芬,郭玉萍,周军,等.运动对人体自由基代谢的影响[J].现代生物医学进展,2012,17(12):3388-3393.
[10]袁琼嘉,李垂坤,李雪,等.长期中等负荷运动对大鼠空间学习记忆及海马神经黏附分子的影响[J].中国运动医学杂志,2012,31(12):1075-1080,1106.
[11]ANDERSON E M,MOENK M D,BARBARO L,et al.Effects of pretraining and water temperature on female rats’performance in the Morris water maze[J].Phys Behav,2013,122:216-221.
[12]BRENNAMAN L H,KOCHLAMAZASHVILI G,STOENICA L,et al.Transgenic mice overexpressing the extracellular domain of NCAM are impaired in working memory and cortical plasticity[J].Neur Dis,2011,43(2):372-378.
[13]DALLÉRAC G,RAMPON C,DOYÈRE V.NCAM function in the adult brain:lessons from mimetic peptides and therapeutic potential[J].Neur Res,2013,38(6):1163-1173.
[14]DEANNA L B,LYNN M S,LAWERNCE S,et al.Making memories stick:cell-adhesion molecules in synaptic plasticity[J].Trends Cell Biol,2000,10(4):473-482.
[15]ENEVOLDSEN M N,KOCHOYAN A,JURGENSON M,et al.Neuroprotective and memory enhancing properties of a dual agonist of the FGF receptor and NCAM[J].Neur Dis,2012,48(3):533-545.
[16]FARAMARZI A,SEIFI B,SADEGHIPOUR H R,et al.Prooxidant-antioxidant balance and malondialdehyde over time in adult rats after tubal sterilization and vasectomy[J].Clin Exp Reprod Med,2012,39(2):81-86.
[17]GIERA M,LINGEMAN H,NIESSEN W M.Recent advancements in the LC-and GC-Based analysis of malondialdehyde(MDA):a brief overview[J].Chromatographia,2012,75(9-10):120-133.
[18]HARMAN D.Origin and evolution of the free radical theory of aging:a brief personal history,1954—2009[J].Bio,2009,10(6):773-781.
[19]IVANOVA D G,YANKOVA T M.The free radical theory of aging in search of a strategy for increasing life span[J].Folia Med(Plovdiv),2013,55(1):33-41.
[20]MILEUSNIC R,LANCASHIRE C,ROSE S.Sequence-specific impairment of memory formation by NCAM antisense oligonucle-otides[J].Learn Memory,1999,6:120-127.
[21]PAUL A,BELTON A,NAG S,et al.Reduced mitochondrial SOD displays mortality characteristics reminiscent of natural aging[J].Mech Ageing Dev,2007,128(11-12):706-716.
[22]RAGHAVAN S,SUBRAMANIYAM G,SHANMUGAM N.Proinflammatory effects of malondialdehyde in lymphocytes[J].J Leukoc Biol,2012,92(5):1055-1067.
[23]RENDEIRO C,FOLEY A,LAU V C,et al.A role for hippocampal PSA-NCAM and NMDA-NR2Breceptor function in flavonoid-induced spatial memory improvements in young rats[J].Neuropharmacology,2013,79C:335-344.
[24]RINALDI B,CORBI G,BOCCUTI S,et al.Exercise training affects age-induced changes in SOD and heat shock protein expression in rat heart[J].Exp Gerontol,2006,41(8):764-770.
[25]VIÑA J,BORRAS C,ABDELAZIZ K M,et al.The free radical theory of aging revisited:the cell signaling disruption theory of aging[J].Antioxid Redox Signal,2013,19(8):779-787.
[26]ZHAO H,LIU J,PAN S,et al.SOD mRNA and MDA expression in rectus femoris muscle of rats with different eccentric exercise programs and time points[J].PLoS One,2013,8(9):e73634.
