纳米四氧化三铁模拟酶催化光度法测定食品中痕量双氧水*
2014-10-17刘细祥欧阳辉祥谢宇奇凌绍明兰翠玲
刘细祥,欧阳辉祥,谢宇奇,凌绍明,兰翠玲
(百色学院化学与生命科学系,广西百色 533000)
双氧水(H2O2)是一种强氧化剂,具有良好的氧化、漂白、防腐和消毒等功能,在食品工业中,H2O2被广泛用于加工助剂和奶制品、食品纤维和食品包装材料的消毒杀菌。毒理学研究表明,当H2O2的浓度达到0.5 mmol/L时,可自然产生羟基自由基,氧化生物体细胞,导致疾病和加速衰老,对生物体有害。中国国家标准GB 2760—1996《食品添加剂使用卫生标准》中规定:H2O2只允许在生鲜牛奶和袋装豆腐干的生产过程中使用,且其成品中不得残留。因此,对食品中痕量H2O2的检测十分必要。
目前,检测H2O2主要基于酶(模拟酶)催化,检测的方法有电化学法[1]、流动注射分析法、色谱法、分光光度法、荧光法[2]和化学发光法[3]等。 天然酶试剂昂贵、不易储存、实验操作繁琐且受温度等多种因素影响,难以普及应用。近几年,纳米粒子催化性能的研究及分析应用十分广泛,研究证明小粒径的纳米金具有很好的催化性能[4],以纳米金为催化剂建立起来的催化增强技术,大大提高了检测方法的灵敏度[5]。 2007 年,阎锡蕴研究小组[6]发现磁性纳米Fe3O4颗粒具有类过氧化物酶的催化功能,这一发现拓展了磁性纳米Fe3O4颗粒的应用范畴,使得纳米Fe3O4在过氧化物催化领域的应用成为一个热点[7-9],但有关纳米Fe3O4催化氧化甲基橙分光光度法检测H2O2尚未见报道。笔者以甲基橙(MO)为底物,纳米Fe3O4模拟酶对过氧化氢氧化甲基橙褪色反应具有催化作用,据此建立了纳米Fe3O4催化氧化甲基橙测定痕量H2O2的新方法,该法兼有光度法的简便性、催化法灵敏度高和成本低等优点,应用前景广阔。
1 实验部分
1.1 仪器与试剂
仪器:UV 2700型双光束紫外-可见分光光度计、Quanta 200 FEG场发射扫描电子显微镜、SYZ-550型石英亚沸蒸馏水器、DK-8B型电热恒温水槽。
试剂:H2O2储备液8.8 mol/L(用高锰酸钾法标定),使用时用水稀释至所需浓度;FeCl3·6H2O;FeSO4·7H2O;1.00 mg/mL 甲基橙水溶液;pH 为 1.42的0.2 mol/L(以NaAc计)HCl-NaAc缓冲溶液。试剂均为分析纯,实验用水均为二次蒸馏水。
1.2 纳米Fe3O4的制备
采用超声辅助反向共沉淀法制备Fe3O4:准确量取15 mL二次水于锥形瓶内,水浴加热至80℃,在强磁力搅拌下加入用5 mL二次水溶解过的2.025 g FeCl3·6H2O 和 1.475 g FeSO4·7H2O 混合溶液, 逐滴加入5 mL浓氨水,继续恒温搅拌1.5 h;冷却后强磁铁吸附分离,用二次水多次洗涤至中性,加水定容到100 mL,避光密封保存,Fe3O4的质量浓度为8.68 g/L。图1为纳米Fe3O4扫描电镜照片。结果表明,该纳米微粒平均粒径为20 nm。主要化学反应式:
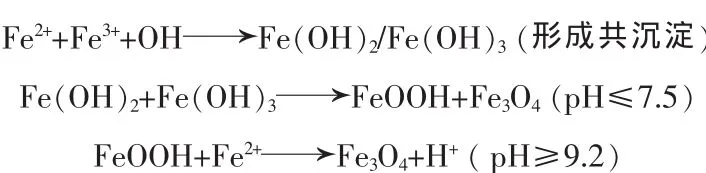

图1 纳米Fe3O4扫描电镜照片
1.3 实验方法
在5 mL具塞比色管中,依次加入0.2 mL经超声波处理的0.868 g/L纳米Fe3O4溶胶、0.2 mL且pH为1.42的HCl-NaAc缓冲溶液和0.2 mL质量浓度为0.01 mg/mL甲基橙水溶液,加入一定量H2O2,用二次蒸馏水定容至1.5 mL,摇匀后放到60℃水浴锅中。15 min后取出,冰水冷却2 min后,强磁铁吸附分离,静置2 min,取上清液以水为参比,在506 nm处测定吸光强度(A),同时测定不加H2O2的空白溶液吸光度(A0),计算吸光度的差:ΔA=A0-A。
2 结果与讨论
2.1 方法原理
纳米Fe3O4具有过氧化物酶性质,在pH=1.42的HCl-NaAc缓冲溶液、60℃条件下催化分解H2O2产生羟基自由基,羟基自由基氧化底物MO得到无色混合产物(图 2)[10],体系颜色由红色逐渐变浅,最终颜色完全褪去,导致体系在506 nm处吸光度减小,随着H2O2浓度的增加,生成的产物增多,吸光度差ΔA线性降低。据此可以建立一种简便灵敏检测H2O2的新方法。
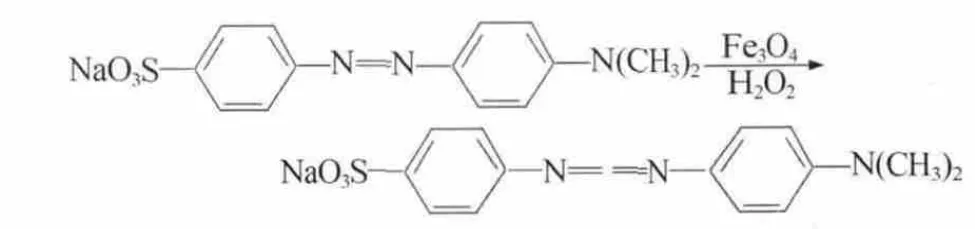
图2 纳米Fe3O4催化氧化甲基橙褪色
2.2 紫外-可见吸收光谱
图3为纳米Fe3O4催化体系紫外吸收光谱图。在pH=1.42的介质中,MO水溶液在506 nm处有强吸收,加入纳米Fe3O4催化H2O2产生羟基自由基后,底物MO逐渐被羟基自由基氧化生成无色的产物,从而使体系在506 nm处的吸收信号不断降低。由图3可见,随着H2O2浓度的增大,各体系在506nm处的吸光度逐渐降低,说明MO被纳米Fe3O4模拟酶催化过氧化氢氧化褪色。综合考虑,实验选择506 nm处为测定波长。
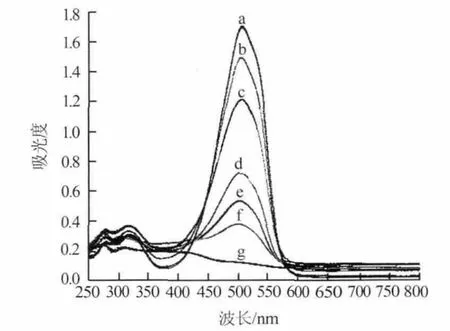
图3 纳米Fe3O4催化体系紫外吸收光谱图
2.3 测定条件优化
2.3.1 HCl-NaAc缓冲溶液的影响
实验首先考察了缓冲溶液pH及用量对体系ΔA的影响。结果如图4、图5所示。由图4、5可以看出,当pH和HCl-NaAc用量分别为1.42和0.2 mL时,ΔA可达到最大值。因此,实验选用pH=1.42的HCl-NaAc缓冲溶液0.2 mL。
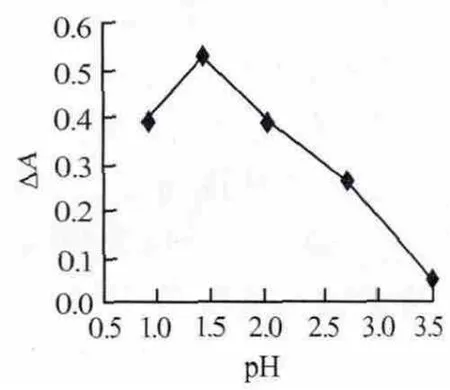
图4 pH对吸光度差的影响

图5 HCl-NaAc缓冲溶液用量对吸光度差的影响
2.3.2 纳米Fe3O4催化剂用量的影响
按照1.3节的实验方法,考察了纳米Fe3O4催化剂用量对体系ΔA的影响,结果见图6。由图6可见,最初随着催化剂用量增大,体系ΔA也增大,当催化剂用量达到0.2 mL时,ΔA达到最大;当用量超过0.2 mL时,体系ΔA反而下降,这可能是由于纳米Fe3O4的吸附作用致使体系A0减小,从而造成ΔA减小。因此,实验选择适宜的纳米Fe3O4用量为0.2 mL。
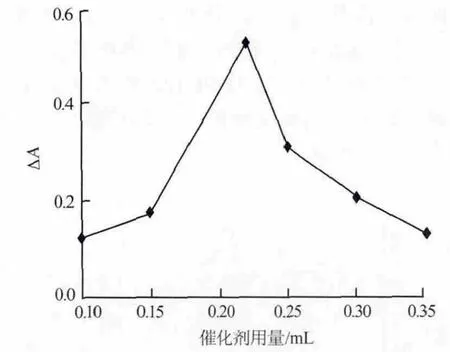
图6 纳米Fe3O4催化剂用量对吸光度差的影响
2.3.3 反应温度的影响
按照1.3节的实验方法,考察了不同反应温度对体系ΔA的影响,结果见图7。由图7可以看出,在30~60℃时,ΔA随着温度的升高而增大,说明温度升高,催化体系的反应程度加剧;当温度为60℃时,ΔA达到最大;温度大于60℃时,由于温度过高,H2O2自行分解加剧,从而造成体系ΔA降低。因此,实验选择最佳反应温度为60℃。
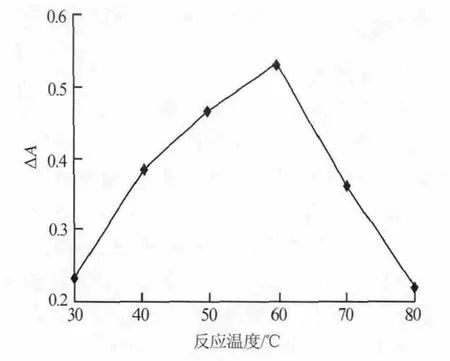
图7 催化反应温度对吸光度差的影响
2.3.4 反应时间的影响
按照1.3节的实验方法,考察了不同反应时间对体系ΔA的影响,结果见图8。由图8可知,当反应时间为15 min时,ΔA即达到最大值,继续增加反应时间,ΔA呈下降趋势。因此,实验选择最佳反应时间为15 min。
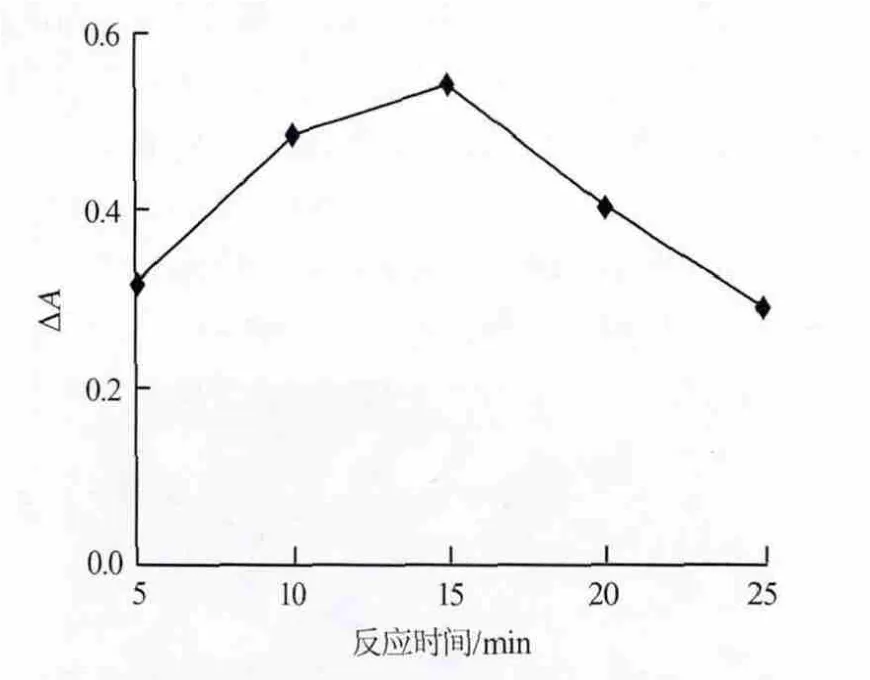
图8 催化反应时间对吸光度差的影响
2.4 共存物质的影响
按照1.3节的实验方法,在H2O2浓度为1.76 μmol/L的条件下,考察了共存物质对体系的影响。结果表明,相对误差不超过5%时,各干扰物质的共存量(倍):F-、CO32-、K+、Cl-、Na+、NO32-、Al3+、Fe2+(1000),PO43-、Mg2+、Ca2+、Cu2+、Zn2+(50), 柠檬酸(500),抗坏血酸、乳酸(200), EDTA、甲醛(25)。
2.5 线性关系
在最佳实验条件下,测定不同浓度的H2O2对应的ΔA,以浓度c对ΔA绘制标准曲线,实验结果表明,双氧水浓度在1.17~35.2 μmol/L范围内与ΔA存在良好的线性关系。回归方程为ΔA=0.0149c+0.0917,相关系数为r=0.9955,检出限为0.6μmol/L。
2.6 样品的分析
称取牛百叶50 g,浸于50 mL二次水中24 h,过滤取清液,于冰箱中冷藏保存,腐竹预处理方法与处理牛百叶方法相同,按实验方法测定样品中的H2O2,并对样品进行加标回收率实验,同时做空白加标实验(见表1)。由表1结果可知,在5次平行样品测定中,样品加标回收率为95.5%~98.3%,空白加标回收率为102.8%,结果令人满意。
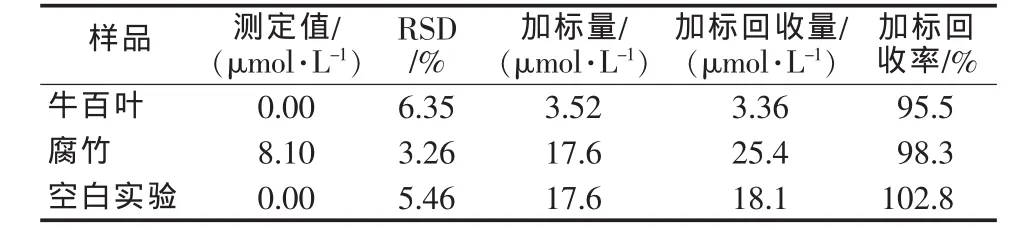
表1 样品测定结果及回收率实验(n=5)
[1]Wang Gang,Xu Jingjuan,Chen Hongyuan,et al.Amperometric hydrogen peroxide biosensor with sol-gel/chitosan network-like film as immobilization matrix [J].Biosensors and Bioelectronics,2003,18(4):335-343.
[2]ChenHongqi,YuHupeng,ZhouYunyou,etal.Fluorescentquenching methodfordeterminationoftracehydrogenperoxideinrainwater[J].Spectrochin mica Acta PartA:Molecularand Biomolecular Spectroscopy,2007,67(3/4):683-686.
[3]Marle L,Greenway G M.Determination of hydrogen peroxide in rainwater in a miniaturised analytical system [J].Anal.Chim.Acta,2005,548(1/2):20-25.
[4]温桂清,梁爱惠,廖献就.检测痕量纳米金的纳米催化光度法[J].分析测试技术与仪器,2008,14 (4):195-198.
[5]Jiang Zhiliang,Liao Xianjiu,Deng Anping,et al.Catalytic effect of nanogold on Cu(Ⅱ)-N2H4reaction and its application to resonance scattering immunoassay[J].Anal.Chem.,2008,80(22):8681-8687.
[6]Gao Lizeng,Zhuang Jie,Nie Leng,et al.Intrinsic peroxidase-like activity of ferromagnetic nanoparticles and application in an immunoassay[J].Nature Nanotechnology,2007,2(9):577-583.
[7]Ouyang Huixiang,Wang Lisheng,Tian Jianniao,et al.A simple and sensitive nanocatalytic fluorescence method for the determination of folic acid in foods using Fe3O4nanoparticle-K2S2O8system [J].Food Analytical Methods,2013,6(1):76-81.
[8]Ouyang Huixiang,Liang Aihui,Tian Jianniao,et al.Catalytic spectrophotometric determination of trace H2O2using Fe3O4nanoparticlesasperoxidasemimetics [J].AppliedMechanicsandMaterials,2013,319:39-42.
[9]Zhang Zhanxia,Wang Zhongjun,Wang Xiaolei,et al.Magnetic nanoparticle-linked colorimetric aptasensor for the detection of thrombin [J].Sensors and Actuators B:Chemical,2010,147 (2):428-433.
[10]朱燕,郁志勇,孙震,等.过氧化氢存在下甲基橙光化学反应产物的鉴定[J].甘肃科学学报, 2004,16(2):44-46.
