缺氧诱导因子-1α和基质蛋白酶-9在鼻息肉嗜酸性粒细胞浸润过程中的作用
2014-10-11佘腊枝鲁海涛湖北省荆州市中心医院耳鼻喉科434020
佘腊枝,鲁海涛,谢 琼(湖北省荆州市中心医院耳鼻喉科 434020)
鼻息肉的发生与局部微环境控制下的中鼻道和鼻窦黏膜反复、长期慢性炎症有关[1]。嗜酸性粒细胞(EOS)局部浸润及其所导致的继发性炎症是目前公认的与鼻息肉发生、发展密切相关的致病因素。因此,以EOS为代表的炎性细胞的聚集和活化成为鼻息肉发病机制研究的重要内容。缺氧诱导因子-1α(HIF-1α)作为一种重要的转录调节因子,在机体适应低氧环境的过程中具有重要作用,而且与鼻息肉的发生也密切相关[2]。基质金属蛋白酶-9(MMP-9)能降解基膜中的Ⅳ型胶原,可能通过降解血管基膜细胞参与鼻息肉组织中的EOS浸润过程[3]。本研究分析了鼻息肉组织中HIF-1α和 MMP-9的表达及与EOS浸润的关系,旨在探讨鼻息肉的发病机制。
1 资料与方法
1.1 一般资料 2010年10月至2012年12月于本院耳鼻咽喉科住院的行鼻内窥镜手术治疗的鼻息肉患者31例(观察组),男18例、女13例,年龄36~60岁,平均(43.7±6.5)岁;根据中华医学会耳鼻咽喉科学分会制订的慢性鼻窦炎鼻息肉临床分型、分期标准,31例患者中,2型Ⅰ期患者4例、2型Ⅱ期患者16例、2型Ⅲ期患者8例、3型患者3例[4]。同期于本院因下鼻甲肥大而需手术部分切除下鼻甲黏膜组织的慢性肥厚性鼻炎患者11例(对照组),男7例、女4例,年龄33~59岁,平均(42.5±6.2)岁。所有患者术前1个月内均未使用糖皮质激素、类固醇药物以及抗组胺类药物。
1.2 实验方法
1.2.1 组织标本采集 鼻息肉患者及慢性肥厚性鼻炎患者均于术中采集鼻息肉组织标本或下鼻甲黏膜组织。组织标本于4%甲醛溶液中固定,常规脱水,制成石蜡块后保存。
1.2.2 反转录-聚合酶链反应(RT-PCR)测定HIF-1α和MMP-9的表达 通过引物设计、总RNA提取、反转录及PCR扩增获得PCR产物,将其置入凝胶成像分析仪中,在254nm紫外线下照相,分析电泳条带光密度值及光密度比值,以半定量的方式分析HIF-1α和 MMP-9mRNA的表达。
1.2.3 免疫组织化学染色 取石蜡块连续切片,参照试剂盒(北京博奥森生物技术有限公司)说明书进行HIF-1α和MMP-9免疫组织化学染色。采用盲法阅片,由2位病理科医生在不知晓患者临床及病理资料的情况下进行阅片和结果判断。细胞质内出现紫红色颗粒或鲜红色颗粒时判为阳性。在高倍光镜下(×400)随机选择5个视野,分别计数 HIF-1α和 MMP-9阳性细胞的数量;在中倍光镜下(×200)随机选择5个视野,分别计数存在HIF-1α和MMP-9阳性细胞血管的数量。
1.2.4 苏木素-伊红染色法测定EOS 取石蜡块连续切片,进行苏木素-伊红常规染色。细胞质中存在大量鲜红色颗粒的细胞判为EOS。在高倍光镜下(×400)随机选择5个视野,计数EOS的数量。
1.3 统计学处理 采用SPSS17.0软件进行数据处理和统计学分析。计量资料以表示,组间比较采用t检验,相关性分析采用Pearson分析。P<0.05为比较差异或统计参数有统计学意义。
2 结 果
2.1 HIF-1α和 MMP-9mRNA表达水平比较两组患者HIF-1α和MMP-9mRNA表达水平见表1。与对照组相比,观察组 HIF-1α和 MMP-9mRNA水平明显升高(P<0.05)。
表1 HIF-1α和 MMP-9mRNA表达水平比较()
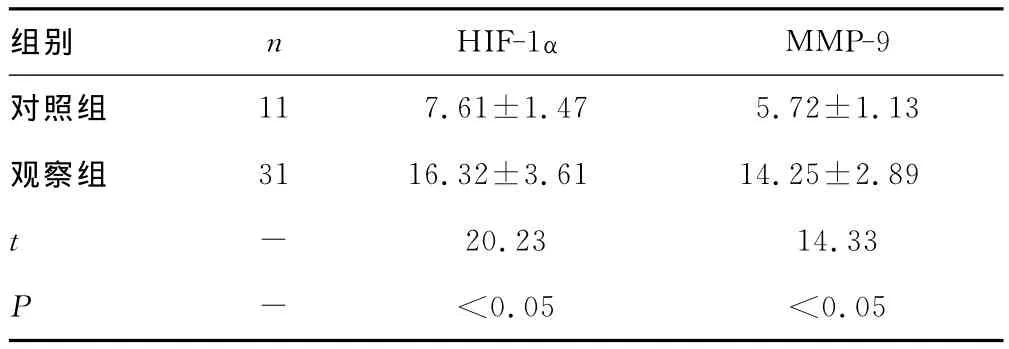
表1 HIF-1α和 MMP-9mRNA表达水平比较()
注:-表示无数据。
组别 n HIF-1α 11 7.61±1.47 5.72±1.13观察组 31 16.32±3.61 14.25±2.89 t-20.23 14.33 P-<0.05 <MMP-9对照组0.05
2.2 免疫组织化学染色结果分析 鼻息肉组织镜下可见HIF-1α多分布于上皮细胞、血管内皮细胞、腺体细胞和多种炎性细胞中;MMP-9主要分布于上皮细胞、腺体细胞及多种炎性细胞中。下鼻甲黏膜组织中仅可见极少量棕色细胞。观察组HIF-1α和MMP-9阳性细胞数、阳性血管数及EOS浸润数均高于对照组(P<0.05),见表2。
表2 细胞及血管计数结果比较(,个/高倍镜)

表2 细胞及血管计数结果比较(,个/高倍镜)
注:-表示无数据。
组别 n阳性细胞数HIF-1α EOS 浸润数MMP-9阳性血管数HIF-1αMMP-9.12±0.78观察组 31 10.67±3.18 29.47±8.62 3.89±1.28 2.46±0.75 8.75±2.11 t-15.25 13.88 10.77 6.84 15.44 P-<0.05 <0.05 <0.05 <0.05 <对照组 11 1.61±0.63 6.61±2.17 1.22±0.36 1.33±0.37 2 0 .05
2.3 Pearson相关性分析结果 Pearson相关性分析结果显示,观察组HIF-1α和MMP-9阳性细胞数与EOS浸润数呈正相关,相关系数分别为0.56、0.88(P<0.05)。
3 讨 论
鼻息肉是多种因素作用下形成的鼻黏膜炎性病变,是耳鼻咽喉头颈外科常见病,病因尚未完全阐明。近年来,鼻腔内鼻道血流供应不足所引起的鼻息肉缺血、缺氧状态,以及该状态促进血管生成在鼻息肉发病过程中的作用逐渐引起了学者们的关注[5]。
HIF-1α是缺氧状态下广泛存在于人体内的一种异源二聚体逆转录因子,是调控细胞供氧平衡和诱导缺氧基因表达的重要蛋白之一[6]。缺氧条件下,细胞上调 HIF-1α的表达,进而促进下游靶向基因的转录以适应微环境的改变,减少细胞凋亡。有研究表明,下调 HIF-1α基因的表达,可抑制巨噬细胞和嗜中性粒细胞在低氧环境下参与炎症的能力,从而防止炎症的发生。康健等[7]采用免疫组织化学染色法和原位杂交等方法,检测了人鼻黏膜上皮细胞HIF-1α表达情况,发现在鼻息肉组织中存在着大量的HIF-1α阳性细胞。本研究结果显示,与慢性肥厚性鼻炎患者下鼻甲黏膜组织相比,鼻息肉组织HIF-1αmRNA水平明显升高,HIF-1α阳性细胞数、阳性血管数和EOS浸润数也更高(P<0.05),表明 HIF-1α在鼻息肉组织中的表达水平明显增高,与上述文献报道相符。
MMP-9是目前已知的活性最强的MMP家族成员,能有效降解基膜和明胶中的Ⅱ、Ⅲ、Ⅳ型胶原,过表达可导致细胞外基质和血管基膜加速降解[8]。MMP-9参与了细胞浸润、肾小球硬化、间质纤维化等多种病理、生理过程,可能在多种炎症性疾病和恶性肿瘤发病过程中起到重要作用。Wang等[9]研究发现,与正常组大鼠比较,变应性鼻炎大鼠模型鼻黏膜组织MMP-9及1型组织基质金属蛋白酶抑制剂(TIMP-1)表达水平明显增高,黏膜下腺体增生明显(P<0.05)。Lalaker等[10]研究发现,鼻息肉组织MMP-9表达水平和活化程度与正常鼻黏膜组织的比较差异有统计学意义(P<0.05),表明 MMP-9在鼻息肉组织生长过程中起到重要作用。本研究结果显示,鼻息肉组织MMP-9mRNA水平明显高于下鼻甲黏膜组织,且鼻息肉组织MMP-9阳性细胞数与EOS浸润数呈正相关(P<0.05),与上述研究报道一致,说明 MMP-9在鼻息肉发病机制中起着重要作用。
综上所述,HIF-1α和 MMP-9均在鼻息肉发病机制中具有非常关键的作用,但二者的具体作用部位及机制尚需进一步研究以证实。可以预见,以HIF-1α和MMP-9作为治疗靶点,通过抑制HIF-1α和 MMP-9的表达以减缓鼻息肉细胞的生长,可能成为鼻息肉治疗和预防的重要手段。
[1]林海,林董,陈贤明,等.缺氧诱导因子-1α与碳酸酐酶Ⅸ在鼻息肉组织中的表达及相关性分析[J].临床耳鼻咽喉头颈外科杂志,2010,24(17):776-778.
[2]汪际云,渡邊荘,松倉聡,等.双链RNA对人鼻息肉上皮细胞中基质金属蛋白酶mRNA表达的影响[J].中华耳鼻咽喉头颈外科杂志,2010,45(3):229-232.
[3]崔珂,康健,柴丽,等.HIF-1α及IL-5在鼻息肉组织中的表达及意义[J].山东医药,2010,50(36):58-59.
[4]郭斌.鼻息肉中 MMP-2、MMP-9的表达及意义[D].西宁:青海大学,2012.
[5]王佳.HIF-1α、STAT3及Survivin在鼻息肉中的表达及意义[D].河南:郑州大学,2012.
[6]贾晓琳,康健,陈冬,等.基质蛋白酶-9和白细胞介素-8在鼻息肉中的表达及其意义[J].广东医学,2011,32(12):1579-1581.
[7]康健,曲亚荣,陈冬,等.缺氧诱导因子-1α及嗜酸粒细胞趋化因子在鼻息肉组织中的表达及意义[J].中国全科医学,2010,13(9):3043-3045.
[8]王丽燕,张冬梅.鼻腔鳞状细胞癌组织中 MMP-2、MMP-9、TIMP-1、TIMP-2的表达变化及意义[J].山东医药,2013,53(3):74-75.
[9]Wang H,Zhang R,Wu J,et al.Knockdown of neurokinin-1receptor expression by small interfering RNA prevents the development of allergic rhinitis in rats[J].InflammRes,2013,62(10):903-910.
[10]Lalaker A,Nkrumah L,Lee WK,et al.Chitin stimulates expression of acidic mammalian chitinase and eotaxin-3by human sinonasal epithelial cells in vitro[J].Am J Rhinol Allergy,2009,23(1):8-14.
