高渗应激环境下伤寒沙门菌t4606基因功能研究*
2014-10-11缪敏慧孟红委倪红元戴如顺苏州大学附属第二医院检验科江苏苏州215004
缪敏慧,孟红委,倪红元,戴如顺,王 敏,杜 鸿(苏州大学附属第二医院检验科,江苏苏州 215004)
伤寒沙门菌是沙门菌属中经消化道感染人类的致病菌之一,可导致感染患者发生全身系统性感染,并能引发肠穿孔等严重的并发症,进而危及感染患者的生命[1-2]。伤寒沙门菌作为食源性致病菌,必须克服人体肠道内的高渗应激环境才能最终致病。笔者在前期的研究工作中发现,在高渗应激环境下,伤寒沙门菌t4606基因的表达受到两个重要的sigma因子,即RpoE和RpoS的双重调控[3],提示t4606基因对伤寒沙门菌克服高渗应激环境极为重要。本研究利用原核生物基因敲除技术制备了伤寒沙门菌t4606基因缺陷株,并分析了其在高渗应激环境下的生物学特性,旨在通过分析t4606基因的功能,及其在沙门菌致病机制中的作用,为临床治疗和预防伤寒沙门菌感染提供可能的靶向基因。
1 材料与方法
1.1 菌株和质粒 本试验所采用的伤寒沙门菌、自杀质粒及大肠埃希菌(E.coli)DH5α菌株由本实验室保存。
1.2 试剂 核酸限制性内切酶BglⅡ、BamHⅠ及用于聚合酶链反应(PCR)的EXTaq酶购自宝生物工程(大连)有限公司;质粒提取试剂、胶回收试剂及T4DNA连接酶购自美国Promega公司。
1.3 方法
1.3.1 t4606基因缺陷株的制备 利用原核生物基因同源重组技术制备t4606缺陷变异株,筛选连续3次传代均获得稳定重组的菌株作为t4606基因缺陷变异株,并采用序列分析进行验证。具体方法参考文献[4]。相关引物见表1。
1.3.2 t4606基因缺陷株回补株的制备 设计特异性引物扩增t4606基因全长,上、下游引物的5′端分别加入NcoⅠ、SalⅠ酶切位点(见表1),扩增获得的全长片段经酶切后与表达载体pBAD/gⅢ(阿拉伯糖操纵元)连接,克隆至E.coli DH5α感受态细胞,利用质粒的氨苄西林抗性初步筛选阳性重组质粒,筛选获得的阳性重组质粒采用PCR及序列分析进行验证(由上海生工生物技术公司完成)。培养经验证确定的阳性重组菌株,提取重组质粒pBADt4606,电击导入t4606变异株,经酶切及PCR验证后命名为回补菌Δt4606(pBADt4606)。采用质量体积比(W/V)为0.2%的阿拉伯糖诱导质粒表达,具体方法参考文献[5]。

表1 PCR引物及序列
1.3.3 生长曲线分析 基因缺陷株、缺陷回补株和野生株分别在37℃条件下,于LB培养液中振摇培养过夜;过夜培养后以1∶100的比例转入新鲜、预热的LB培养液,每隔1h检测培养液在600nm处的吸光度值(A600值),以A600值为纵坐标,培养时间为横坐标绘制生长曲线。用相同方法比较t4606缺陷株和野生株在高渗应激(300mmol/L NaCl)环境下的生存能力。每组实验重复3次。于对数生长早期(培养4h)和对数生长晚期(12h)比较不同菌株培养液的A600值。
1.4 统计学处理 采用SPSS13.0软件进行数据处理和统计学分析。计量资料组间比较采用t检验;P<0.05为比较差异有统计学意义。
2 结 果
2.1 成功制备t4606基因缺陷株 首先利用自杀质粒所具有的氨苄西林抗性,在含有氨苄西林的LB平板上筛选具有抗性的菌落,再进一步筛选耐蔗糖的菌落。以筛选获得的阳性菌落DNA为模板,用t4606基因上、下游引物P1A和P2B进行PCR扩增,分析伤寒沙门菌t4606基因的重组变异情况。PCR扩增检测相应菌落,直至筛选获得连续传代超过3次均仅有缺损片段的菌株。所获得的菌株即为稳定的t4606基因缺陷株。缺陷株及野生株PCR产物电泳结果见图1。经DNA序列分析,进一步证实702bp处被BglⅡ核酸限制性内切酶的6个碱基酶切位点所替代。
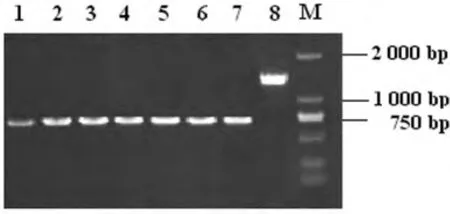
图1 t4606缺陷株及野生株PCR产物电泳图
2.2 成功构建回补菌株Δt4606(pBADt4606) 为进一步证实t4606基因的功能,利用表达载体pBAD/gⅢ将t4606基因回补引入t4606基因缺陷株,构建回补菌株Δt4606(pBADt4606)。利用质粒的氨苄西林抗性,初步筛选携带回补t4606基因质粒的细菌后,提取质粒,进行酶切及PCR验证,酶切产物电泳结果见图2。DNA序列分析证实碱基序列与实验设计一致。
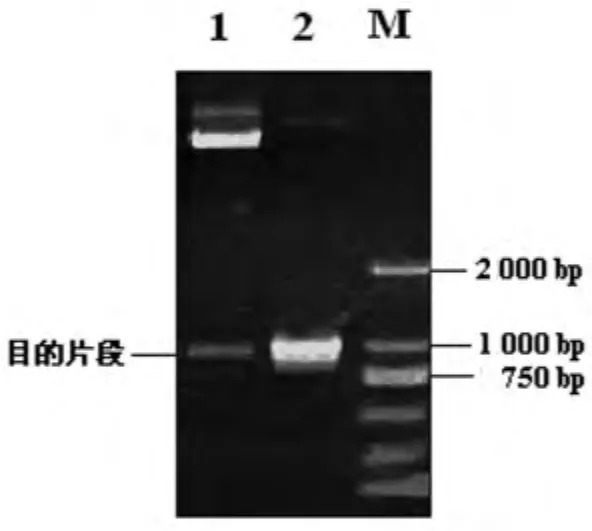
图2 回补t4606基因的鉴定
2.3 生长曲线分析 于对数生长早期(培养4h)和对数生长晚期(12h)检测并比较不同菌株培养液的A600值,结果显示,高渗应激环境下t4606缺陷株(Δt4606)的生存能力明显弱于野生株(4h:t=22.725,P<0.05;12h:t=5.008,P<0.05),回补t4606基因至t4606缺陷株后,细菌生存能力恢复至野生株水平(4h:t=3.559,P>0.05;12h:t=0.404,P>0.05),说明t4606基因在细菌适应高渗应激环境时发挥了重要作用。生长曲线如图3所示。
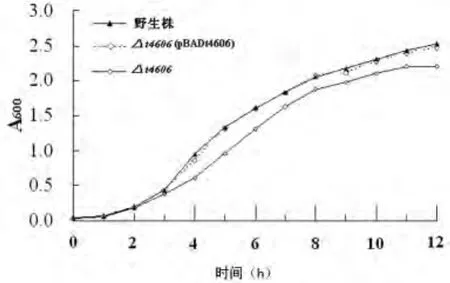
图3 不同菌株在高渗应激环境下的生存曲线
3 讨 论
伤寒沙门菌作为食源性致病菌,常通过污染食物而经消化道入人体内,进而造成全身性感染,严重时可危及感染患者的生命。全球每年约有2 100 万人感染伤寒沙门菌,其中死亡人数超过21万,即使在发达国家,伤寒沙门菌的暴发流行也时有发生[6]。伤寒沙门菌在致病过程中,必须克服人体肠道内的高渗应激环境才能最终致病[7-8]。在应激环境下,细菌需要及时有效地调节某些基因的表达和蛋白的活性,从而适应新的环境。尽管伤寒沙门菌已成为重要的原核生物研究模式菌,其全基因组结构也已阐明,然而仍然有近三分之一基因的功能尚不明确,而这些基因在细菌生存过程中可能具有极为重要的生物学作用。随着一些未知基因功能的逐步明确,对伤寒沙门菌致病机制的认识也将进一步深入。然而,如何选择在伤寒沙门菌适应应激环境时发挥重要作用的未知功能基因,是后续研究工作中的难点。
笔者前期利用伤寒沙门菌全基因组芯片,研究了高渗应激环境下的两个重要调节因子(RpoE和RpoS)的双重调控作用,结果发现,在伤寒沙门菌处于高渗应激环境时,t4606基因的表达同时受到RpoE和RpoS的双重调控,说明t4606基因在伤寒沙门菌适应高渗应激环境方面具有重要的意义[3]。进一步利用生物信息学软件对t4606基因序列进行分析后发现,t4606基因具有70%的Patatin样磷脂酶基序,可能编码一种Patatin样磷脂酶。Patatin样磷脂酶和细菌的侵袭性和毒力密切相关。Banerji和Flieger[9]的研究表明,具有致病性的细菌内,含有Patatin样编码区域的蛋白比非致病性细菌更为常见。也有研究表明,铜绿假单胞菌肺炎患者体内出现急性肺损伤,有可能是由铜绿假单胞菌Ⅲ型分泌系统分泌的ExoU毒素进入真核细胞的细胞质所致[10]。ExoU毒素由exoU基因编码,而exoU基因类似于伤寒沙门菌t4606基因,其所编码蛋白质的氨基酸序列中具有Patatin样磷脂酶片段,且该片段与哺乳动物体内的非钙离子依赖性磷脂酶A2具有同源性,并且ExoU毒素的溶血磷酸酶A活性和细胞毒作用与该片段有关[10]。伤寒沙门菌中是否存在Patatin样磷脂酶尚无文献报道,值得进一步深入研究。
本研究采用分子生物学技术,结合t4606基因的特性,通过优化相关实验条件,成功制备了伤寒沙门菌t4606基因缺陷株及其回补株,并观察了不同菌株在模拟人体肠道高渗应激环境下的生存能力。通常情况下,肠道致病菌在进入人体肠道后,必须适应环境渗透压的巨大改变,即从食物中的低渗环境到肠道内的高渗环境。致病菌只有适应了新的渗透压环境,才能侵袭肠上皮细胞。因此,了解伤寒沙门菌适应人体肠道内高渗应激环境的机制,对进一步分析伤寒沙门菌的整体致病机制具有重要的意义。本研究中的生长曲线分析证实,高渗应激环境下,t4606缺陷株的生长能力明显弱于野生株,但在回补t4606基因至t4606缺陷株后,其生长能力恢复至野生株水平。由此可见,t4606基因在伤寒沙门菌适应高渗应激环境方面发挥着重要的作用。
本文对高渗应激环境下伤寒沙门菌t4606基因的生物学功能进行了初步研究,为进一步深入了解t4606基因在伤寒沙门菌中发挥作用的机制奠定了基础,也说明t4606有可能作为临床预防和治疗伤寒沙门菌感染的靶向基因,为伤寒沙门菌感染的临床分子靶向治疗提供了新的研究方向。
[1]Ukwenya AY,Ahmed A,Garba ES.Progress in management of typhoid perforation[J].Ann Afr Med,2011,10(4):259-265.
[2]Parry CM,Hien TT,Dougan G,et al.Medical progress:typhoid fever[J].NEJM,2002,347(22):1770-1782.
[3]Du H,Wang M,Luo Z,et al.Coregulation of gene expression by sigma factors RpoE and RpoS in Salmonella enterica serovar Typhi during hyperosmotic stress[J].Cur Microbiol,2011,62(5):1483-1489.
[4]茅凌翔,朱超望,黄新祥,等.伤寒沙门菌phoP基因缺陷变异株的制备[J].江苏大学学报:医学版,2007,17(2):145-149.
[5]Du H,Sheng XM,Zhang HF,et al.RpoE may promote flagellar gene expression in Salmonella enterica serovar Typhi under hyperosmotic stress[J].Curr Microbiol,2011,62(2):492-500.
[6]Bhutta ZA,Threlfau J.Addressing the global disease burden of typhoid fever[J].JAMA,2009,302(8):898-899.
[7]Winter SE,Winter MG,Godinez I,et al.A rapid change in virulence gene expression during the transition from the intestinal lumen into tissue promotes systemic dissemination of Salmonella[J/OL].PLoS Pathogens,2010-08-19[2013-01-07].http://www.ncbi.nlm.nih.gov/pubmed/20808848 .
[8]Zhao L,Ezak T,Li ZY,et al.Vi-Suppressed wild strain Salmonella typhi cultured in high osmolarity is hyperinvasive toward epithelial cells and destructive of Peyer′s patches[J].Microbiol Immunol,2001,45(2):149-158.
[9]Banerji S,Flieger A.Patatin-like proteins:a new family of lipolytic enzymes present in bacteria[J].Microbiol,2004,150(3):522-525.
[10]Pankhaniya RR,Tamura M,Allmond LR,et al.Pseudomonas aeruginosa causes acute lung injury via the catalyticactivity of the patatin-like phospholipase domain of ExoU[J].Crit Care Med,2004,32(11):2293-2299.
