原发性肝癌自发性破裂出血的相关危险因素分析*
2014-10-11李泽朝罗诗樵重庆医科大学附属第一医院肝胆外科重庆400016
戴 珏,刘 钊,高 翔,李泽朝,周 勇,罗诗樵(重庆医科大学附属第一医院肝胆外科,重庆 400016)
原发性肝癌破裂出血是肝癌的严重并发症,占肝癌患者死因的10%[1]。因肿瘤和出血双重因素的影响,临床处理较为困难,且其腹腔种植转移率高,患者预后差,故临床医生都特别重视减少或避免肝癌破裂出血的发生。本研究通过收集本院2006年1月至2012年12月收治的自发性破裂出血肝癌患者56例及未发生破裂出血的56例肝癌患者的临床资料,并进行回顾性分析,探讨肝癌破裂出血的相关危险因素。
1 资料与方法
1.1 一般资料 选择2006年1月至2012年12月本院收治的自发性破裂出血肝癌患者56例为研究组,男47例、女9例;平均(51.7±15.2)岁;巴塞罗那临床肝癌(BCLC)分期 A、B、C、D期各1、5、45、5例。另选择同期本院收治的未发生破裂出血肝癌患者56例为对照组,男46例、女10例;平均(54.54±12.3)岁;包括BCLC分期 A、B、C、D期各3、6、46、1例。患者性别、年龄及BCLC分期等一般资料组间比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 对两组患者入院时以下项目的首次检查结果进行比较。(1)一般情况:有无高血压、糖尿病、肝硬化等基础疾病,肝功能Child-Pugh分级,BCLC分期,体力状况(PS)评分。(2)实验室检查结果:血小板(PLT)、凝血酶原时间(PT)、凝血酶原时间比值(PTR)、国际标准化比值(INR)、血小板活动度、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB)、甲胎蛋白(AFP)、乙肝五项检查等;(3)影像学检查:肿瘤位置,肿瘤最大直径,肿瘤突出肝脏表面高度,是否有门静脉癌栓、门静脉高压及腹水。
1.3 统计学处理 采用SPSS20.0软件对数据进行处理和统计学分析。计量资料以表示,组间比较采用t检验。计数资料以例数表示,组间比较采用卡方检验。对单因素分析中具有统计学意义的因素进行Logistic多因素回归分析。P<0.05为比较差异或分析参数有统计学意义。
2 结 果
2.1 肝癌破裂出血相关计数资料单因素分析结果 两组患者在有无肝硬化、高血压、糖尿病等基础性疾病,肿瘤最大直径是否大于7cm,肿瘤位置,Child-Pugh分级,PS评分,BCLC分期,有无门脉高压、腹水等方面比较差异无统计学意义(P>0.05);两组患者在肿瘤突出肝脏表面是否大于1cm、有无门静脉癌栓、AFP水平是否大于400ng/mL等方面比较差异有统计学意义(P<0.05)。见表1。

表1 肝癌破裂出血相关计数资料组间比较(n)
2.2 肝癌破裂出血计量资料单因素分析结果 两组患者PLT、PTR、INR、血小板活动度、APTT、TT、乙肝病毒表面抗原(HBsAg)、乙肝病毒表面抗体(HBsAb)、乙肝病毒e抗体(HBeAb)、乙肝病毒核心抗原(HBcAg)等指标水平比较差异无统计学意义(P>0.05);PT、FIB、乙肝病毒e抗原(HBeAg)水平比较差异有统计学意义(P<0.05)。见表2。
表2 肝癌破裂出血相关计量资料组间比较()

表2 肝癌破裂出血相关计量资料组间比较()
137.91±79.79 143.70±63.19 -0.425 0 .671 PT(s) 15.52±4.14 13.97±1.72 2.586 0 .011 PTR 1.17±0.17 1.14±0.08 1.468 0 .145 INR 1.20±0.19 1.15±0.90 1.686 0 .095血小板活动度 73.05±17.00 76.37±10.85 -1.236 0 .219 APTT(s) 34.67±8.65 36.00±5.07 -0.981 0 .329 TT(s) 17.79±3.31 17.17±1.43 1.291 0 .199 FIB(g/L) 2.82±1.12 3.43±1.36 -2.590 0 .011 HBsAg(IU/mL) 1 644 .92±4 718 .22 1 348.93±2 220 .38 0 .425 0 .672 HBsAb(mIU/mL) 2.63±7.99 22.63±85.43 -1.745 0 .084 HBeAg(S/CO) 3.31±6.15 1.01±1.89 2.671 0 .009 HBeAb(S/CO) 2.35±7.25 1.20±5.19 0.964 0 .337 HBcAg(S/CO)t P PLT(×109/L)因素 研究组 对照组9.01±4.83 8.33±3.18 0.877 0 .383
2.3 肝癌破裂出血相关因素Logistic回归分析 对单因素分析中比较差异有统计学意义的6个因素进行Logistic多因素回归分析,结果显示肿瘤突出肝脏表面大于1cm,以及FIB、HBeAg水平进入了回归模型(P<0.05)。见表3。
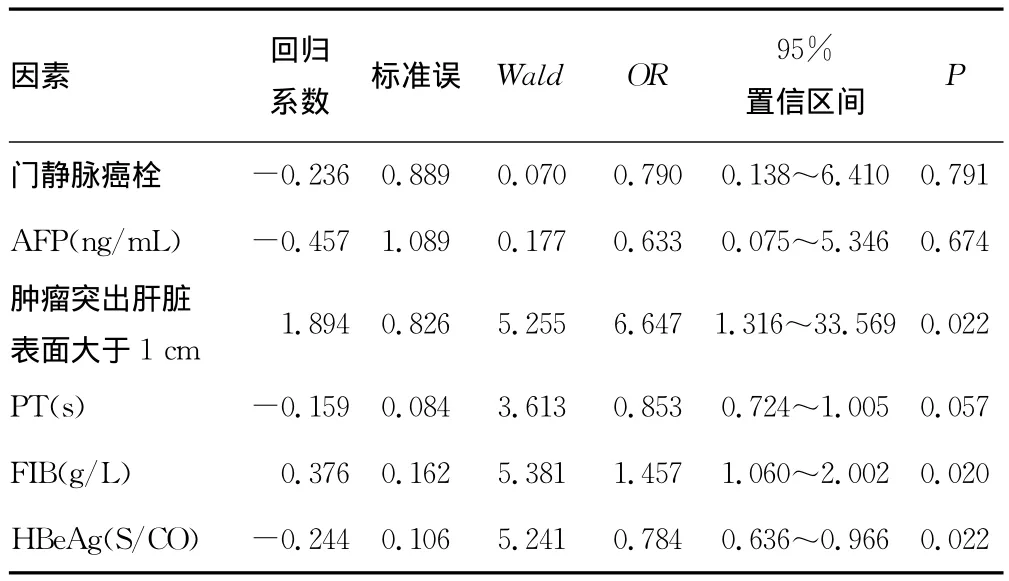
表3 Logistic多因素回归分析结果
3 讨 论
肝癌破裂出血与肿瘤生长部位、生长过速、瘤内压增高、凝血功能障碍、肿瘤血管壁受损等多种因素相关。杨威等[2]研究提示,APTT、HBeAg及肿瘤突出肝脏表面的最大高度为肝癌破裂出血的独立危险因素。徐威等[3]报道,肝癌破裂出血如以急腹症为主要表现,且伴血流动力学不稳定,则肝硬化程度加重、白细胞数大于10×109/L和丙氨酸氨基转移酶升高是其危险因素;而AFP升高及合并门静脉癌栓是隐匿型肝癌破裂出血患者的危险因素。Zhu等[4]研究发现,门脉高压、肝硬化、肿瘤直径大于5cm、门静脉癌栓及肝外转移为肝癌破裂出血的独立危险因素,其中门脉高压对肝癌破裂出血的影响最大,其OR值为7.75。而本研究显示研究组和对照组门脉高压的比较差异无统计学意义(P>0.05),笔者分析这可能与对照组的选择标准不同有关,本研究在选择对照组时纳入了BCLC分期,对照组与研究组在BCLC分期上比较差异无统计学意义(P>0.05)。
本研究显示,肝癌破裂出血与患者的肿瘤最大直径,肿瘤位置,Child-Pugh分级,BCLC分期,有无肝硬化、高血压、糖尿病等基础疾病无直接相关性,而肿瘤突出肝脏表面大于1cm,以及FIB、HBeAg水平是肝癌破裂出血的独立危险因素。其中肿瘤突出肝脏表面大于1cm的OR值为6.647,为影响最大的危险因素。肿瘤局限在肝脏内可受到正常组织的保护,若其位置表浅、局部突出肝脏表面,其表面覆盖的正常肝组织较少,当外伤及腹压突然增大时易导致肿瘤破裂,特别是同时伴有以下情况导致瘤内压升高时:(1)肿瘤可因生长过速,血供相对不足,使肿瘤中心液化、坏死甚至并发感染,最终导致瘤内压力增高[5]。(2)肿瘤可因侵犯、压迫其流出道或肿瘤中的动静脉瘘导致局部静脉压力增高使瘤内淤血,压力增高[6-7]。(3)肿瘤内部存在由肿瘤细胞形成的非内皮细胞衬覆的血管通道,因无内皮细胞的屏障作用,液体以渗透方式进入肿瘤,可造成局部压力增高[8-9]。因此肿瘤局部突出越高,其破裂的可能性越大。
本组研究显示,HBeAg是肝癌破裂出血的独立危险因素,其OR值为0.784。有研究发现,体内乙型肝炎病毒e1抗原可与免疫球蛋白和补体C1q形成的抗原抗体复合物沉积于癌组织血管壁,通过激活中性粒细胞系统,释放炎性因子及弹力蛋白酶,造成血管壁的弹力膜及胶原纤维断裂降解,最终导致血管壁脆性增加,受外力冲击时易破裂出血[10-11]。同时,肝癌破裂出血患者体内巨噬细胞与抗原抗体复合物的结合导致吞噬细胞的吞噬功能受损,加重了上述病理改变。
单因素分析结果显示,研究组FIB水平与对照组比较差异有统计学意义(P<0.05),回归分析显示FIB为肝癌破裂出血的独立危险因素,其OR值为1.457。FIB由肝脏合成,是血浆中含量较高的凝血因子之一,在体内经凝血酶原作用转化为纤维蛋白,从而发挥凝血及止血功能。国内有研究显示人肝癌细胞株能高表达编码人FIB基因,提示肝癌细胞也可合成FIB[12]。肝癌患者FIB水平增高,血液处于高凝状态,易形成血栓,可堵塞破裂的微血管,一定程度上延缓甚至避免肝癌破裂出血。然而,究竟是肝功能受损还是破裂出血时机体纤溶亢进导致了肝癌破裂出血患者FIB水平降低,还有待进一步研究。
另外医源性因素也可能是肝癌破裂出血的重要诱因之一,通过进一步深入分析患者病历资料发现,在本研究中有3例患者为行γ刀治疗后发生肝癌破裂出血。且有相关文献报道,患者行肝动脉栓塞化疗后发生肝癌破裂出血[13-14],究其原因可能与治疗后肿瘤液化、坏死甚至并发感染,化疗药物对血管的损伤等因素有关。故对肿瘤突出肝脏表面超过1cm、HBeAg水平高及FIB水平低的患者行γ刀、肝动脉栓塞化疗等治疗后,应严密监测,警惕肝癌破裂出血。
综上所述,当肝癌患者检查结果提示肿瘤突出肝脏表面超过1cm、HBeAg水平高、FIB血液浓度低时,需高度警惕肝癌破裂出血。对有手术指征的患者应尽早行肝部分切除术。对于一般情况及肝功能较好,且肿瘤局限可切除的患者建议行Ⅰ期肝部分切除术,对于不能手术的患者可行肝动脉栓塞急诊止血,待一般情况好转后再行Ⅱ期手术治疗[15-16]。
[1]Battula N,Madanur M,Priest O,et al.Spontaneous rup-ture of hepatocellular carcinoma:a Western experience[J].AMJ Surg,2009,197(2):164-167.
[2]杨威,胡虞乾,唐勇,等.原发性肝癌自发性破裂的危险因素多因素分析[J].中国普通外科杂志,2009,18(7):685-687.
[3]徐威,李敬东,石刚,等.原发性肝细胞癌自发破裂的风险因素分析[J].中华普通外科杂志,2011,26(2):149-153.
[4]Zhu Q,Li J,Yan JJ,et al.Predictors and clinical outcomes for spontaneous rupture of hepatocellular carcinoma[J].World J Gastroenterol,2012,18(48):7302-7304.
[5]Kim JS,Yoon SK,Kim JA,et al.Long-term survival in a patient with ruptured hepatocellular carcinoma[J].Korean J of Intern Med,2009,24(1):63-67.
[6]Lai ECH,Lau WY.Spontaneous rupture of hepatocellular carcinoma:a systematic review[J].Arch Surg,2006,141(2):191-193.
[7]Hung MC,Wu HS,Lee YT,et al.Intraperitoneal metastasis of hepatocellular carcinoma after spontaneous rupture:a case report[J].World J Gastroenterol,2008,14(24):3927-3928.
[8]Folberg R,Maniotis AJ.Vasculogenic mimicry[J].Apmis,2004,112(7-8):508-525.
[9]Seftor REB,Hess AR,Seftor EA,et al.Tumor cell vasculogenic mimicry:from controversy to therapeutic promise[J].Am J Path,2012,181(4):1115-1125.
[10]朱立新,耿小平,范上达.肝癌自发性破裂病因探讨[J].中华外科杂志,2004,42(17):1036-1039.
[11]吕成超,朱立新,耿小平.巨噬细胞吞噬功能受损对肝癌自发性破裂的影响[J].中华实验外科杂志,2006,23(3):271-273.
[12]范秉琳,朱武凌,邹国林,等.人肝癌细胞差异表达基因纤维蛋白原γ-多肽的克隆与鉴定[J].癌症,2004,23(3):249-253.
[13]Battula N,Srinivasan P,Madanur M,et al.Ruptured hepatocellular carcinoma following chemoembolization:a Western experience[J].Hepatobiliary Pancreat Dis Int,2007,6(1):49-51.
[14]Bruls S,Joskin J,Chauveau R,et al.Ruptured hepatocellular carcinoma following transcatheter arterial chemoembolization[J].JBR-BRT,2011,94(2):68-70.
[15]Bassi N,Caratozzolo E,Bonariol L,et al.Management of ruptured hepatocellular carcinoma:Implications for therapy[J].World J Gastroenterol,2010,16(10):1221-1224.
[16]Jin Y J,Lee JW,Park SW,et al.Survival outcome of patients with spontaneously ruptured hepatocellular carcinoma treated surgically or by transarterial embolization[J].World J Gastroenterol,2013,19(28):4537-4539.
