苦参碱对人成纤维样滑膜细胞生长的影响*
2014-10-11雷佳红郭晓兰杨明辉川北医学院附属医院风湿免疫研究所检验科四川南充67000川北医学院检验系四川南充67007
蒋 红,雷佳红,,何 城,郭晓兰,2,,杨明辉,蔡 燕,2,△(川北医学院附属医院:.风湿免疫研究所;2.检验科,四川南充 67000 ;.川北医学院检验系,四川南充 67007)
类风湿性关节炎(RA)是一种以关节滑膜炎为特征的慢性全身性自身免疫疾病,主要临床表现为慢性、对称性、多滑膜关节炎和关节外病变,常累及全身多个系统,严重影响患者的生存质量。RA在国内发病率约为0.3%~0.4%,女性发病率高于男性[1]。目前临床上多采用甲氨蝶呤、环磷酰胺等抗肿瘤药物,阻断淋巴细胞刺激因子的Kineret、肿瘤坏死因子阻断剂英利昔单抗等生物制剂治疗RA患者,虽然这些药物疗效明显,但都有不良反应多或价格昂贵等缺点,增加了患者的痛苦和经济负担。研究显示人成纤维样滑膜细胞的过度增生和分泌在RA的发病和发展中具有重要作用[2]。本研究拟从中医中药的角度研究苦参碱对人成纤维样滑膜细胞生长的影响,探讨苦参碱对RA的潜在治疗作用。
1 材料与方法
1.1 人成纤维样滑膜细胞 采集2013年1~8月川北医学院附属医院风湿科收治的7例RA患者关节积液标本,体外原代培养人成纤维样滑膜细胞。7例患者中男2例、女5例;年龄36~60岁,平均50.4岁。
1.2 仪器与试剂 生物安全柜(安泰公司);HF90CO2培养箱(力康公司);IX71倒置显微镜(日本OLYMPUS);酶标仪(美国Bio-RAD)。DMEM 培养基(美国 Gibco);胎牛血清(杭州四季青);四甲基偶氮唑蓝(MTT)、二甲基亚砜(美国Sigma);胰蛋白酶(美国 Amresco);苦参碱(每瓶100mg,购自南京替斯艾么中药研究所,纯度大于98.0%),配制浓度为0.4、0.8、1.2、1.6、2.0mg/mL的药物备用。
1.3 方法
1.3.1 人成纤维样滑膜细胞培养 无菌采集患者关节腔积10~30mL,1 000 r/min离心10min,弃上清后用磷酸盐缓冲液(PBS)重悬沉淀,经100目筛网过滤,将滤液以1 000 r/min离心10min,再以PBS清洗沉淀2次后,以含10%胎牛血清及青霉素和链霉素各100U的DMEM培养基重悬细胞,用计数板计数细胞,按1×107接种于25cm2培养瓶中,置37℃、5%CO2培养箱中进行培养。3d后观察细胞生长情况,视情况进行传代,一般于培养后10d可取第3~5代细胞按(1~5)×1 000 个/孔接种至2个96孔板中备用,每块板上每个药物浓度接种6个孔,设只加培养液的空白组和不加药物处理的对照组。每位患者均重复检测3次。
1.3.2 药物处理 96孔板中细胞培养24h后,以培养基稀释药物,将浓度为0.4、0.8、1.2、1.6、2.0mg/mL苦参碱分别加入相应培养孔中继续培养。分别于药物处理24、48h后用倒置显微镜观察细胞生长情况。
1.3.3 MTT法检测 培养24、48h后,每孔加入5mg/mL的MTT 20μL,继续培养4h,弃上清液,每孔加入150μL二甲基亚砜,室温振荡10min,在酶标仪上测定490nm处吸光度值(A值)。每孔减去空白对照A值均值后计算每组平均数,抑制率(%)=(1-处理组A值/对照组A值)×100%。
1.4 统计学处理 采用软件SPSS16.0进行数据处理及统计学分析,平均数以表示,组间比较采用t检验,以P<0.05表示比较差异有统计学意义。
2 结 果
2.1 细胞培养结果 7例患者的关节滑液经处理后均成功获得大量成纤维样细胞,经鉴定该细胞为CD68阴性细胞[3],即人成纤维样滑膜细胞,传代至第3~5代时90%以上细胞为该类细胞。人成纤维样滑膜细胞多为长梭形,胞质透亮、均匀,细胞轮廓清晰,见较多分裂期细胞,表明细胞状态良好,适合后续研究。
2.2 苦参碱处理后细胞形态变化 苦参碱作用于细胞后,细胞的数量减少,细胞间的连接减少乃至消失,胞体变小,细胞质内可见大量空泡样结构,并随着药物浓度的增加和处理时间的延长,空泡增加。见图1。
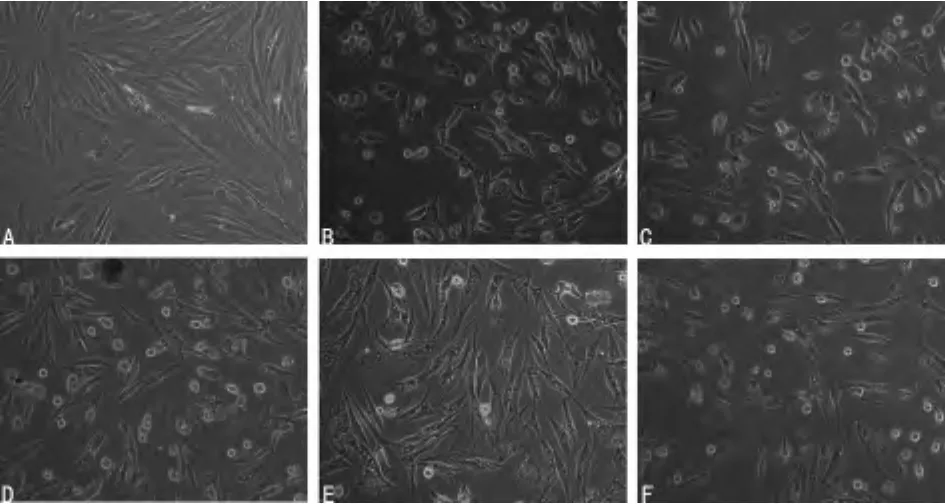
图1 不同浓度苦参碱处理后的人成纤维样滑膜细胞形态(×200)
2.3 MTT法检测结果 苦参碱处理后,处理组各浓度的A值低于对照组,其中处理24h后的1.6、2.0mg/mL浓度,处理48h后1.2、1.6、2.0mg/mL浓度的 A值明显低于对照组,比较差异有统计学意义(P<0.05)。见表1。各组细胞抑制率为2.52%~25.74%,随药物浓度增加和处理时间延长,抑制作用增强。见图2。
表1 苦参碱对人成纤维样滑膜细胞生长的影响()
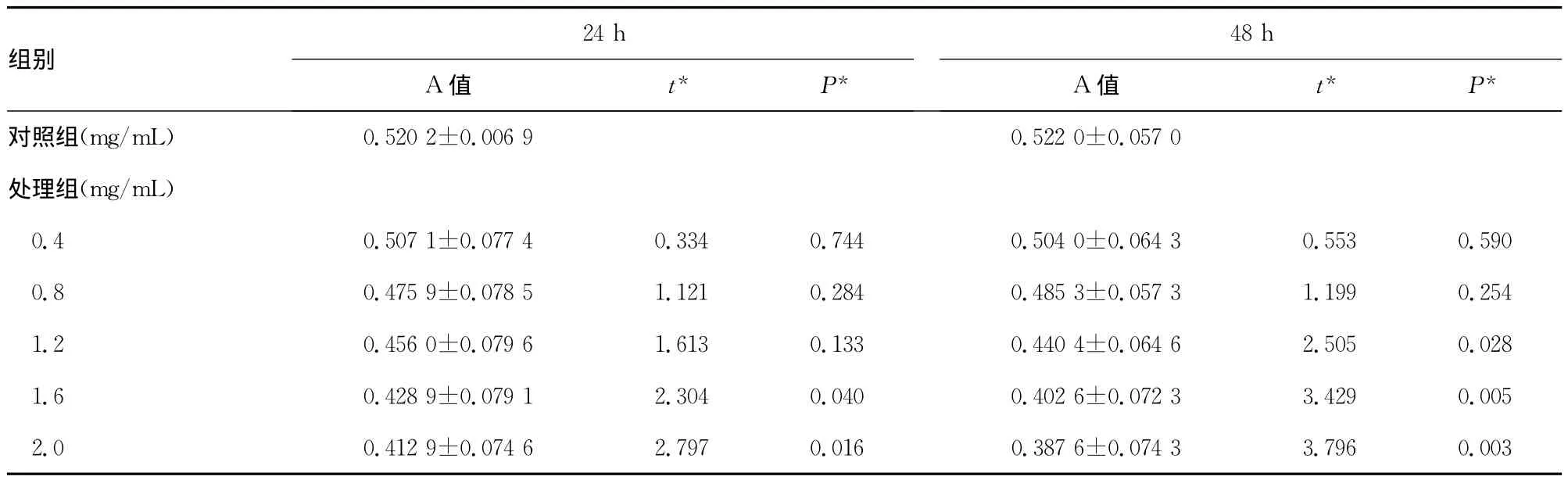
表1 苦参碱对人成纤维样滑膜细胞生长的影响()
注:*表示与对照组比较的t、P值。
组别24h A值 t* P*48h A值 t* P*对照组(mg/mL)0.522 0 ±0.057 0 处理组(mg/mL)0.4 0.507 1 ±0.077 4 0.334 0.744 0.504 0 ±0.064 3 0.553 0.590 0 .8 0.475 9 ±0.078 5 1.121 0.284 0.485 3 ±0.057 3 1.199 0.254 1 .2 0.456 0 ±0.079 6 1.613 0.133 0.440 4 ±0.064 6 2.505 0.028 1 .6 0.428 9 ±0.079 1 2.304 0.040 0.402 6 ±0.072 3 3.429 0.005 2 .0 0.412 9 ±0.074 6 2.797 0.016 0.387 6 ±0.074 3 0.520 2 ±0.006 9 3.796 0.003
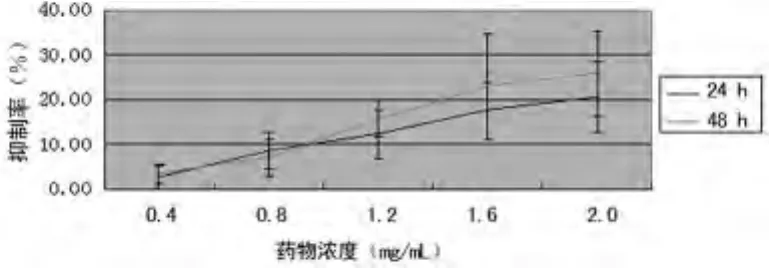
图2 不同浓度苦参碱对人成纤维样滑膜细胞增殖的影响
3 讨 论
RA是目前临床上比较常见的一种自身免疫性疾病,病因复杂。研究表明人成纤维样滑膜细胞过度增生和分泌是RA发病的重要基础,参与关节的炎性反应和关节破坏。人成纤维样滑膜细胞可表现出转化细胞的特征,呈类肿瘤细胞样异常增殖,侵入到软骨和软骨下的骨质,并产生炎性介质、促炎性细胞因子及抗炎性细胞因子、分泌基质金属蛋白酶等。因此抑制人成纤维样滑膜细胞的增殖和活化是目前研究RA的热点,可能为临床上治疗RA提供新的思路或靶点。
苦参碱是苦参根部分离的一种生物碱,具有抗肿瘤、抗病毒、抗心律失常、抗炎等作用[4]。其不良反应较少,目前主要用于抗病毒性肝炎治疗。研究发现苦参碱能抑制食管癌、胃癌SGC-7901细胞、前列腺癌 PC-3M 细胞等肿瘤细胞的增殖[5-7]。人成纤维样滑膜细胞具有肿瘤细胞样异常增殖的特性,故本研究拟探讨苦参碱是否能影响人成纤维样滑膜细胞的生长。结果表明,人成纤维样滑膜细胞经不同浓度的苦参碱处理后,细胞生长均受到不同程度的抑制,随着药物浓度的增加和作用时间的延长,抑制作用增强。其中处理24h后的1.6、2.0mg/mL浓度,处理48h后1.2 、1.6、2.0mg/mL浓度,与对照组细胞的A值比较差异有统计学意义(P<0.05)。提示苦参碱能抑制人成纤维样滑膜细胞的增殖。
滑膜增生是RA的特征性病理表现,增生的滑膜可形成血管翳依附于软骨表面,介导骨和软骨的破坏,人成纤维样滑膜细胞凋亡不足与滑膜增生有关[8]。介导人成纤维样滑膜细胞凋亡可能是治疗RA的有效途径。有研究显示,苦参碱能诱导宫颈癌Hela细胞凋亡,其作用机制可能与抑制survivin基因的表达有关[9]。李海军等[10]发现苦参碱能通过上调Fas蛋白的表达促进乳腺癌 MCF-7细胞凋亡。而范悦等[11]研究提示苦参碱能诱导肝癌HepG2发生自噬作用。自噬和凋亡均可导致细胞死亡、细胞数目减少,本研究通过光镜和MTT法检测苦参碱对人成纤维样滑膜细胞的生长具有抑制作用,但细胞数目的减少是自噬还是凋亡导致的结果有待进一步探讨。总之,苦参碱可影响人成纤维样滑膜细胞的生长,可作为治疗RA的潜在药物。
[1]田东林,潘磊,高国卫,等.类风湿关节炎治疗研究进展[J].辽宁中医药大学学报,2013,15(11):137-139.
[2]王燎原,戴生明.滑膜成纤维细胞在类风湿关节炎中的作用[J].中华风湿病学杂志,2009,13(6):412-414.
[3]蒋红,刘青松,凡瞿明,等.丹参体外抑制类风湿关节炎成纤维样滑膜细胞增殖的研究[J].中华临床医师杂志,2010,4(4):425-429.
[4]陈晓峡,向小庆,叶红.苦参碱及氧化苦参碱抗肿瘤作用的研究进展[J].中国实验方剂学杂志,2013,19(11):361-364.
[5]雷佳红,蒋红,刘素兰,等.苦参碱对EC109肿瘤细胞增殖的影响[J].检验医学与临床,2012,9(2):129-130.
[6]Song S,Zhu S,Zhang Z,et al.A study on the inhibitory effect of matrine on gastric cancer SGC-7901cells[J].Afr J Tradit Complement Altern Med,2013,10(6):435-438.
[7]金光虎,夏海波,李海峰,等.苦参碱对前列腺癌PC-3M细胞生长抑制和凋亡的影响[J].内蒙古医学杂志,2013,45(1):1-5.
[8]冯小辉,欧阳桂林.类风湿关节炎滑膜细胞凋亡机制的研究进展[J].医学综述,2013,19(9):1543-1545.
[9]陈立波.苦参碱对宫颈癌Hela细胞增殖、凋亡及Survivin基因表达的影响[J].中国实验方剂学杂志,2013,19(15):235-238.
[10]李海军,王俊明,田亚汀,等.苦参碱对 MCF-7细胞Fas、VEGF及端粒酶活性的影响[J].中国中西医结合杂志,2013,33(9):1247-1251.
[11]范悦,王世明,石青青.苦参碱对肝癌细胞增殖及其细胞自噬的影响[J].中国当代医药,2013,20(7):11-13.
