丁苯肽软胶囊对大鼠急性脑缺血再灌注损伤脑组织含水及含钙量的影响
2014-10-11潘登谭军
潘 登 谭 军
1)河南新乡市第一人民医院神经内科 新乡 453000 2)新乡医学院第三附属医院神经内科 新乡 453003
丁苯肽(n-butylpohthahide,NBP),又名芹菜甲素(apiumgraveolens linn)是我国具有独立自主产权的国产Ⅰ类化学新药,具有增加缺血区脑血流量和重构缺血区微循环、改善全脑缺血后的能量代谢、保护线粒体功能、减轻神经功能损伤程度等功能;同时,对脑损伤、惊厥、记忆障碍等疾患也有一定的保护作用[1]。我们采用大鼠急性脑缺血再灌注损伤模型观察其对脑组织含水量及含钙量的影响。
1 材料与方法
1.1实验动物选用Sprague-Dewley(SD)大鼠60只,体质量180~220g,由新乡医学院实验动物中心提供,自由饮用自来水,饲用普通颗粒型大鼠饲料(含蛋白23%、脂肪4.7%、钠盐0.24%),动物房温度控制23~27℃,光暗周期12h。
1.2实验仪器与试剂FAl204B型电子分析天平,AA370MC型原子吸收分光光度计,上海精科仪器有限公司。丁苯肽软胶囊(中国石家庄制药公司NBP有限公司)。戊巴比妥钠液(佛山市化工实验厂);纯硝酸、高氯酸(青岛精科仪器试剂有限公司)。复方丹参滴丸:27mg×150粒(天士力,药物编号:100708),给药量30g/mL,相当于大鼠灌胃给药量的10倍。
1.3动物模型的建立参照Pulsinelli4血管法造大鼠急性脑缺血再灌注模型。以2%戊巴比妥钠0.1mL/100g体质量注射麻醉后,行颈后正中部切开术,电凝双侧椎动脉,无创缝合伤口。次日行前颈正中部切开术,分离双侧颈总动脉,用血管夹夹闭10min后去除血管夹,造成缺血再灌注损伤。假手术组仅分离双侧椎动脉、颈总动脉后无创缝合伤口。术后5d进行脑组织含水量及含钙量测定,如模型对照组与假手术组比较大鼠脑组织含水量、含钙量明显降低(P<0.05或P<0.01),说明造模成功。
1.4分组及给药方法按随机数字表法选取10只大鼠作为假手术组,其余50只均分为模型对照组、丁苯肽高剂量组(0.4g/kg)、丁苯肽中剂量组(0.2g/kg)、丁苯肽低剂量组(0.1g/kg)、复方丹参滴丸组(30g/mL),各组均于术后第1天灌胃给药,1次/d,连续给药3d。假手术组、模型对照组给予与丁苯肽各剂量组等量的生理盐水。于术后第5天处死。
1.5脑组织含水量及含钙量测定处死动物后,开颅取出完整脑组织,干燥,以Elliot公式计算脑组织含水量。脑组织含水量(%)=[(湿质量-干质量)/湿质量]×100%。将干燥脑组织用混合酸(硝酸∶高氯酸=3∶1)5mL充分消化,在电热恒温板上处理至无色,冷却至室温后用去离子水定容至10mL,然后在原子吸收分光光度计上采用火焰吸收法测定Ca2+含量。
1.6统计学方法采用SPSS 16.0软件包进行统计学分析。计量资料以均数±标准差(s)表示,2组均数比较采用独立样本t检验;组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
与模型对照组比较,丁苯肽高剂量组大鼠脑组织含水量、含钙量均降低(P均<0.01);中剂量组大鼠脑组织含水量降低不明显(P>0.05),含钙量明显降低(P<0.01);剂量组大鼠脑组织含水量、含钙量变化均不明显(P>0.05)。与模型对照组比较,复方丹参注射液组大鼠脑组织含水量及含钙量均明显降低(P均<0.01)。见表1。
表1 各组大鼠急性脑缺血再灌注后脑组织含水量及含钙量比较 (s)
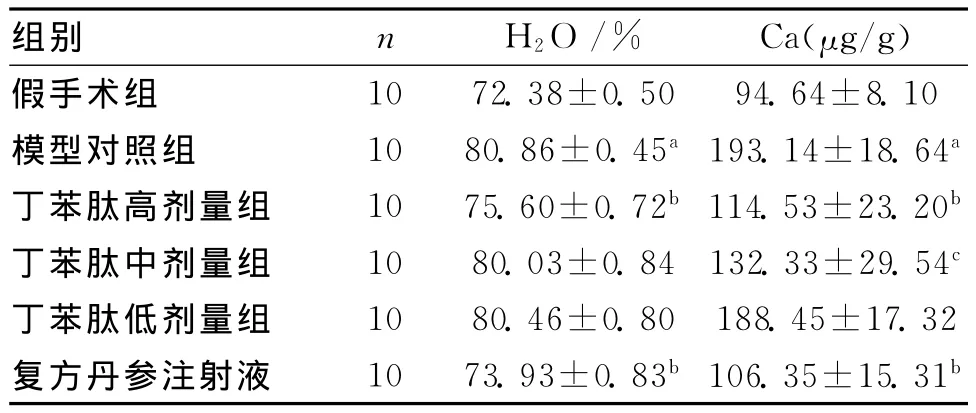
表1 各组大鼠急性脑缺血再灌注后脑组织含水量及含钙量比较 (s)
注:与假手术组比较,aP<0.01;与模型对照组比较,b P<0.01;c P<0.01
组别 n H2O/% Ca(μg/g)10 72.38±0.50 94.64±8.10模型对照组 10 80.86±0.45a193.14±18.64a丁苯肽高剂量组 10 75.60±0.72b 114.53±23.20b丁苯肽中剂量组 10 80.03±0.84 132.33±29.54c丁苯肽低剂量组 10 80.46±0.80 188.45±17.32复方丹参注射液 10 73.93±0.83b 106.35±15.31假手术组b
3 讨论
脑水肿是神经内外科及各种危重患者的常见病,是致死、致残的重要原因。脑组织含水量是反映脑水肿的经典指标。Ca2+是人体不可缺少的重要物质,Ca2+超载是导致细胞死亡的重要原因[2]。丁苯酞是一种新型抗脑缺血药物,可通过解除微血管痉挛、抑制血小板聚集、抑制TXA2的合成等多个环节阻断脑缺血引起的病理生理发展过程[3-4]。本研究发现,丁苯肽组3d渗透性增高程度均较缺血组减轻。血脑脊液屏障(blood brain barrier,BBB)由内皮细胞、基底膜、星形胶质细胞的足突和周细胞、小胶质细胞以及维持脑组织完整性的细胞外基质构成,是神经血管单元的核心结构[5-6]。在慢性低灌注状态下,BBB 3d后BBB破坏基本修复,丁苯肽组比缺血组修复更好。作为BBB的重要部分,内皮细胞在缺血缺氧损害过程中,线粒体功能受损,影响细胞能量代谢,紧密连接增宽,细胞水肿,是血管源性水肿的基础。研究表明,丁苯酞通过改善线粒体膜流动性,恢复线粒体膜电位,提高线粒体磷酸腺普酶及复合酶Ⅳ的活性,增加超氧化物歧化酶及谷光甘肽过氧化物酶的活性,从而保护线粒体[7-9]。其对内皮细胞线粒体的保护作用可能是其对BBB保护作用的基础。另外,丁苯肽通过对细胞炎性因子的抑制作用可能影响基质金属蛋白酶对细胞外基质的降解,在保护BBB中也可能发挥了重要作用。本实验采用大鼠急性脑缺血再灌注模型观察了丁苯肽软胶囊对脑组织含水量、含钙量的影响,旨在探讨丁苯肽的脑保护作用。本实验中,我们参照pulsinelli4血管法造大鼠急性脑缺血再灌注模型,造模成功后连续3d腹腔注射不同剂量丁苯肽,术后5d处死动物并测定脑组织含水量及含钙量。结果表明,丁苯肽软胶囊各剂量组可降低大鼠急性脑缺血再灌注损伤脑组织含水量及含钙量,提示其具有脑保护作用,这为丁苯肽软胶囊临床治疗脑动脉硬化、脑血栓形成(偏瘫)、冠心病、心绞痛、心肌梗死、高血脂等提供了实验依据。
[1]Kalaria RN.The role of cerebral ischemia in Alzheimer's disease[J].Neurobiol Aging,2000,21(2):321-330.
[2]史保中,刘运生,刘凡 .脑水肿的评价指标及其研究进展[J].国外医学·神经病学神经外科学分册,2002,29(3):207-209.
[3]T omimoto H,Akiguchi I,Akiyama H,et al.T Cell Infiltration and Expression of M H C Class II Antigen by M acrophage and M icro-glia in a Heterogeneous Group in Leukoen-ephalopathy[J].Am J Pathol,1993,143(2):579-586.
[4]Tomimoto H,Akiguchi I,Suenaga T,et al.Alterations of the Blood-brain Barrier and Glial Cells in White-matter Lesions in Cere-brovaseular and Alzheimers Disease Patients[J].Stroke,1996,27(11):2 069-2 074.
[5]Hawkins BT,Davis TP.Blood-brain Barrier/Neurovascular U nit in Health and Disease[J].Pharmacol Rev,2005,57(2):173-185.
[6]Ballabh P,Braun A,Nedergaard M.The Blood-brain Barrier:an Overview:Structure,Regulation and Clinical Implications[J].Neurobiol Dis,2004,16(1):1-13.
[7]黄如训,李常新,陈立云,等 .丁苯酞对实验性动脉血栓形成性脑梗死的治疗作用[J].中国新药杂志,2005,14(8):985-988.
[8]许康,张苏明 .线粒体损伤与神经元缺血死亡[J].国外医学·脑血管疾病分册,2002,10(6):461-464.
[9]黄如训,李常新,陈立云,等 .丁苯酞对实验性动脉血栓形成性脑梗死的治疗作用[J].中国新药杂志,2005,14(8):985-988.
