肉桂醛选择性加氢产物的互变异构理论研究
2014-10-09孙芳芳李来才
孙芳芳, 张 林, 马 骏, 李来才
(四川师范大学化学与材料科学学院,四川成都610066)
1 预备知识
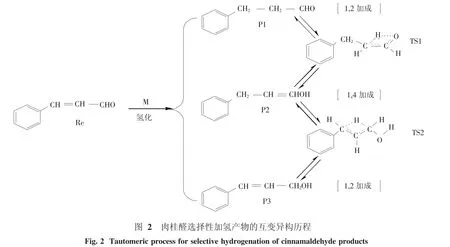
肉桂醛是典型的芳香族α,β-不饱和醛,含有均可被加氢还原的C=O双键和C=C双键,其选择性加氢在精细化工和制药工业中是一个重要的反应.该反应通常有3种反应途径,如图1.1,2-加成分别得到产物苯丙醛 (P1,C=C双键加氢)和肉桂醇(P3,C=O双键加氢),1,4-加成得到产物3-苯基丙烯醇(P2).其中,产物苯丙醛(P1)可用于治疗HIV[1];产物肉桂醇(P3)常作为定香剂、修饰剂,广泛用于调制香型香精、肥皂、香水和化妆品中[2],有温和持久而舒适的香气,肉桂醇(P3)也是一种重要的医药原料[3-4],常用于治疗心脑血管疾病的药物合成以及有效抑制病毒引起的肿瘤.C=O双键和C=C双键两者在还原加氢反应过程中存在竞争效应,从热力学的角度可知,C=O双键的键能为715 kJ/mol,比C=C键的键能大100 kJ/mol,使得C=O双键的加氢还原比C=C双键困难[5].由于α,β-不饱和醛中C=C双键和C=O双键与芳环共轭,要控制C=C双键或C=O双键加氢的选择性就更加困难.因此,提高催化加氢的选择性,无论是在理论研究还是工业应用上都有着重要的意义.Y.Li等[6]报道了过渡金属加入对肉桂醛催化加氢的影响,结果表明Cr、Mn、Ni对C=C双键加氢具有较高的选择性,Fe、Co、Cu对C=O双键加氢具有较高的选择性.B.M.Andrea等[7]通过制备PtSn/SiO2双金属催化剂促进了肉桂醛向肉桂醇转化,提高了肉桂醇的选择性.Q.H.Liu等[8]考察了非晶态合金Co—Fe—B催化剂上肉桂醛选择加氢制肉桂醇,结果显示Fe调变了非晶态合金Co—B催化剂的结构,使C=C双键加氢活性的下降,从而提高了催化剂对肉桂醇的选择性.刘迎新等[9]系统考察了La2O3含量对Au/TiO2催化剂物化性质和催化性能的影响,结果表明掺杂适量La2O3助剂(10% ~15%)可显著提高Au/TiO2催化剂的加氢活性和肉桂醇选择性.F.Delbecq等[10]采用扩展休克尔计算方法对肉桂醛等α,β-不饱和醛等在Pt和Pd金属表面的6种吸附模型进行计算,结果表明在分子吸附时,C=C双键的吸附易于发生,而C=O双键的π体系不易发生吸附,因此有利于饱和醛的生成.高雪霞等[11]以肉桂醛加氢作为探针反应研究了炭材料负载Pt催化肉桂醛选择性加氢性的活性和产物选择性,结果表明,纳米炭材料催化剂(Pt/MWCNT、Pt/CNF)表现出较高的C=O双键选择性加氢行为,而无定形碳催化剂表现为C=C双键选择性加氢.目前,对肉桂醛选择性加氢的实验研究主要集中于选择合适的催化剂、助剂和反应体系等方式来提高催化加氢反应的选择性,理论研究主要在于催化剂改性来提高催化加氢反应的活性和选择性,而对于加氢后产物之间的互变异构研究较少.本文采用密度泛函理论对肉桂醛选择性加氢产物的互变异构过程进行研究,以求了解反应的微观特征,为实验研究提供一些理论信息.
2 计算方法
采用DFT理论中的B3LYP/6-311++G**方法[12-13],对肉桂醛选择性加氢的产物和互变异构过程中的过渡态的结构进行优化.通过频率计算确认过渡态有唯一虚频,内禀反应坐标(IRC)计算进一步证实过渡态的合理性,通过振动分析得到零点能(ZPE)及其校正后的总能量.利用AIM 2000程序包[14]计算相应的成键临界点(BCP)和成环临界点(RCP)电荷密度,进一步分析成键特征.为了更真实地模拟实验条件,在相同基组水平下采用自洽反应场(SCRF)连续介质模型(PCM)方法[15]对肉桂醛选择性加氢的产物和互变异构过程中的过渡态进行全优化.所有计算均采用Gaussian 09程序完成[16].
3 结果与讨论
探讨肉桂醛选择性加氢可能生成的3种产物分别在气相条件下,以及在乙醇、甲苯、THF、酸性、碱性条件下的互变异构过程,反应历程如图1.反应过程中肉桂醛选择性加氢的产物和互变异构过程中的过渡态的优化构型和结构参数分别见图2和3,相关能量见表1和表2.计算结果表明,中间体的力常数矩阵本征值均为正,是反应势能面上的稳定点,所有过渡态都具有唯一虚频.
3.1 反应机理分析反应物肉桂醛(Re)经催化剂M催化、选择性加氢可能生成3种产物,肉桂醛进行1,2-加成得到产物苯丙醛(P1)或肉桂醇(P3),进行1,4-加成则得到产物3-苯基丙烯醇(P2),在气相条件下P1、P2、P3互变异构过程的反应历程如图2.

反应物 Re中,C(2)—C(3)、C(3)—C(4)、C(4)—O键的键长分别为 0.134 7、0.146 3和0.121 4 nm,相应的 BCP电荷密度为 0.339 7、0.2825和0.406 3 a.u..Re经1,2-加成得到产物苯丙醛(P1),P1中 C(2)—C(3)、C(3)—C(4)、C(4)—O、C(3)—H(4)键长分别为 0.154 5、0.151 1、0.120 5和0.110 0 nm,相应的 BCP电荷密度分别为 0.235 1、0.260 8、0.412 7和0.266 1 a.u.; 与Re中相比,C(2)—C(3)、C(3)—C(4)键长均有所增加,BCP电荷密度均减小.产物苯丙醛(P1)经过渡态TS1形成产物3-苯基丙烯醇(P2),过渡态TS1中C(3)—H(4)—O—C(4)的RCP电荷密度为0.083 1 a.u.,表明过渡态TS1为四元环状过渡态;C(3)—C(4)、C(4)—O、C(3)—H(4)、H(4)—O 键长分别为 0.141 5、0.128 4、0.152 7和0.127 8 nm,BCP电荷密度为0.306 0、0.352 2、0.093 2 和 0.144 6 a.u..以上数据表明P1→TS1过程中C(3)—H(4)键部分断裂,H(4)—O键部分形成.由表1能量数据可知,气相条件下P1→TS1→P2过程的活化能为289.32 kJ/mol,P2→TS1→P1过程的活化能为253.76 kJ/mol,表明该反应在气相条件下顺反反应都不易发生.
产物3-苯基丙烯醇(P2)中,C(2)—C(3)、C(3)—C(4)、C(4)—O、O—H(4)键长分别为0.150 7、0.133 5、0.136 6 和 0.096 4 nm,相应的BCP电荷密度分别为0.252 3、0.344 8、0.281 9和0.351 2 a.u.,表明O—H(4)键已完全形成.3-苯基丙烯醇(P2)经过渡态TS2形成肉桂醇(P3),过渡态TS2中C(2)—C(3)—C(4)—H(2)形成四元环,其 RCP电荷密度为 0.074 0 a.u.;C(2)—C(3)、C(3)—C(4)、C(2)—H(2)、C(4)—H(2)键长分别为 0.143 1、0.141 3、0.146 5 和0.146 0 nm,相应的BCP电荷密度分别为0.295 0、0.308 7、0.107 1和0.109 6 a.u..以上数据表明 P2→TS2过程中C(2)—H(2)键部分断裂,H(4)—O键部分形成.由表1能量数据可知,气相条件下P2→TS2→P3过程的活化能为396.63 kJ/mol,P3→TS2→P2过程的活化能为394.66 kJ/mol,表明该反应在气相条件下顺反反应都不易发生.
3.2 能量分析由表1和2中能量数据可以看出,肉桂醛选择性加氢产物苯丙醛(P1)、3-苯基丙烯醇(P2)、肉桂醇(P3)在气相条件下,过程P1→TS1→P2的活化能为 ΔE1=289.32 kJ/mol,过程P2→TS1→P1的活化能为ΔE1′=253.76 kJ/mol;过程P2→TS2→P3的活化能为ΔE2=396.63 kJ/mol,过程P3→TS2→P2的活化能为ΔE2′=394.66 kJ/mol.比较发现,气相条件下,3种加氢产物之间的互变异构过程顺反反应活化能均大于250.00 kJ/mol,所以发生互变异构的可能性很小.
在乙醇溶剂中,过程P1→TS1→P2的活化能为ΔE1=294.87 kJ/mol,过程P2→TS1→P1的活化能为ΔE1′=254.72 kJ/mol;过程P2→TS2→P3的活化能为ΔE2=395.13 kJ/mol,过程P3→TS2→P2的活化能为ΔE2′=395.61 kJ/mol.以上数据表明,在乙醇溶剂条件下,3种加氢产物之间的互变异构过程顺反反应活化能均大于250.00 kJ/mol,所以发生互变异构的可能性很小.在甲苯溶剂中,过程P1→TS1→P2的活化能为ΔE1=291.75 kJ/mol,过程P2→TS1→P1的活化能为ΔE1′=254.27 kJ/mol;过程P2→TS2→P3 的活化能为ΔE2=395.77 kJ/mol,过程P3→TS2→P2的活化能为ΔE2′=395.03 kJ/mol.以上数据表明,在甲苯溶剂中,3种加氢产物之间的互变异构过程顺反反应活化能均大于250.00 kJ/mol,所以发生互变异构的可能性很小.在THF溶剂中,过程P1→TS1→P2的活化能为ΔE1=293.78 kJ/mol,过程P2→TS1→P1的活化能为ΔE1′=254.78 kJ/mol;过程 P2→TS2→P3的活化能为ΔE2=395.42 kJ/mol,过程P3→TS2→P2的活化能为ΔE2′=395.44 kJ/mol.以上数据表明,在THF剂中,3种加氢产物之间的互变异构过程顺反反应活化能均大于250.00 kJ/mol,所以发生互变异构的可能性很小.

在酸性条件下,过程P1→TS1→P2的活化能为ΔE1=252.82 kJ/mol,过程P2→TS1→P1的活化能为ΔE1′=175.54 kJ/mol;过程 P2→TS2→P3 的活化能为ΔE2=142.30 kJ/mol,过程P3→TS2→P2的活化能为ΔE2′=198.20 kJ/mol.比较发现,P2→TS2→P3过程的活化能最低,表明3-苯基丙烯醇(P2)与肉桂醇(P3)可能发生互变异构.碱性条件下,过程P1→TS1→P2的活化能为ΔE1=205.59 kJ/mol,过程P2→TS1→P1的活化能为ΔE1′=44.23 kJ/mol;过程P2→TS2→P3的活化能为ΔE2=80.59 kJ/mol,过程P3→TS2→P2的活化能为ΔE2′=169.98 kJ/mol.比较发现,ΔE1′和 ΔE2较小,即 P2→TS1→P1、P2→TS2→P3过程的活化能都较低,说明碱性条件下产物3-苯基丙烯醇(P2)易转化成产物苯丙醛(P1)和产物肉桂醇(P3);而产物苯丙醛(P1)和产物肉桂醇(P3)在乙醇、甲苯、THF、酸性及碱性条件下都难以发生互变异构.由此说明,要想得到肉桂醛加氢高选择性的产物,重点还是应该考虑催化剂的选择性.
由表2数据可知,在P1→TS1→P2→TS2→P3路径中,在气相、乙醇、甲苯以及THF溶剂中速控步骤为P2→TS2→P3,且在乙醇溶剂中活化能相对较低;而在酸、碱条件下速控步骤为P1→TS1→P2,且在碱性条件下活化能最低.在P3→TS2→P2→TS1→P1路径中,在气相、乙醇、甲苯、THF溶剂以及酸碱条件下速控步骤均为P3→TS2→P2,同样在碱性条件下活化能最低,表明碱性条件有利于反应的进行.此外,在乙醇、THF和甲苯溶剂中各步骤的活化能比较接近,而乙醇、THF和甲苯溶剂的极性大小分别为4.30、4.20和2.40.由此可以推断溶剂极性对该反应影响不大.
4 结论
采用密度泛函理论中的 B3LYP方法,在6-311++G**基组水平上研究了气相和乙醇、甲苯、THF溶剂中肉桂醛选择性加氢可能的3种产物之间的互变异构过程.研究结果表明,气相条件和3种不同溶剂中苯丙醛(P1)、3-苯基丙烯醇(P2)、肉桂醇(P3)互变异构的活化能均大于250 kJ/mol,互变异构难以发生.在酸性条件下,P2→TS2→P3过程的活化能为142.30 kJ/mol,该反应有可能发生;碱性条件下,P2→TS1→P1、P2→TS2→P3过程的活化能分别为44.23和80.59 kJ/mol,表明产物3-苯基丙烯醇(P2)易转化成产物苯丙醛(P1)和产物肉桂醇(P3);而产物苯丙醛(P1)和肉桂醇(P3)在乙醇、甲苯、THF、酸性及碱性条件下都难以发生互变异构.且在乙醇、THF和甲苯溶剂中各步骤的活化能数值比较接近,我们可以推断溶剂极性对该反应影响不大.
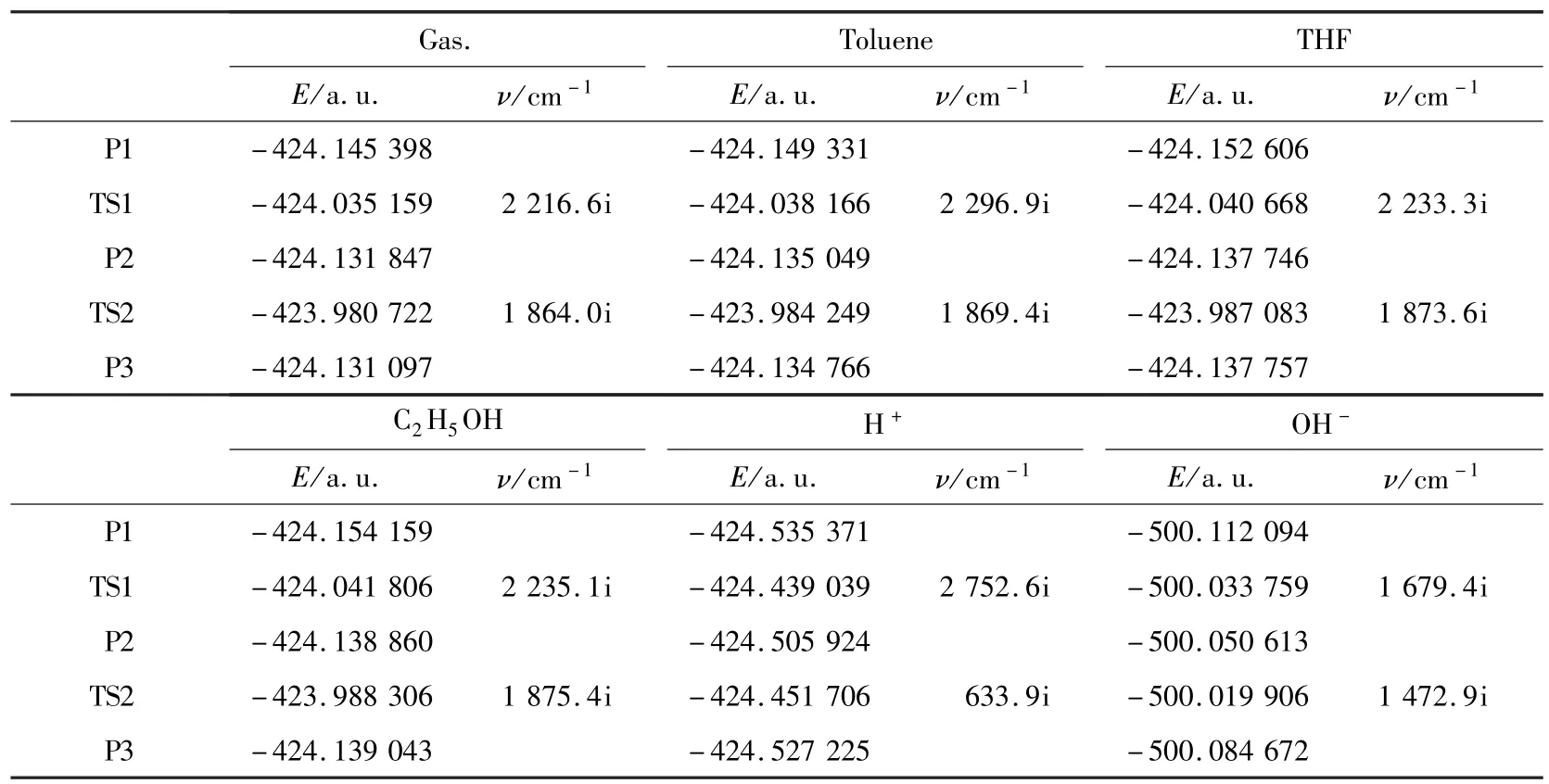
表1 反应各驻点的能量(E/a.u.)、振动虚频率(ν/cm-1)Table 1 The list of energies(E/a.u.)and vibration frequencies(ν/cm-1)

表2 不同条件下顺反反应活化能Table 2 Energies of cis-trans isomerism under different conditions
[1]Muller A,Bowers J.WO Patent Application WO 99/08989[M].Pascagoula MS:First Chemical Corporation,1999.
[2]许莉勇,张新波,张斌,等.肉桂醛多相催化选择性加氢制肉桂醇的研究进展[J].中国现代应用药学,2010,27(7):599-603.
[3]孙宝国,何坚.香料化学与工艺学[M].2版.北京:化工工业出版社,2004:76-90.
[4]Bouvier d'Yvoire M,Bouchabke-Coussa O,Voorend W,et al.Disrupting the cinnamyl alcohol dehydrogenase 1 gene(BdCAD1)leads to altered lignification and improved saccharification in Brachypodium distachyon[J].Plant J,2013,73(3):496-508.
[5]Cao Y P,Zhang A Q.Selective hydrogenation of cinnamaldehyde over Pt-supported styrene-butadiene-styrene block copolymer[J].Chin Org Chem,2011,31(4):577-581.
[6]Li Y,Zhou R X,Lai G H.Effect of transition metals(Cr,Mn,Fe,Co,Ni and Cu)on selective hydrogenation of cinnamldehyde over Pt/CNTs catalyst[J].Reaction Kinetics and Catal Lett,2006,88(1):105-110.
[7]Andrea B M,Bruno F M,Virginia V,et al.PtSn/SiO2catalysts prepared by surface controlled reactions for the selective hydrogenation of cinnamaldehyde[J].Appl Catal A:Gen,2010,383(8):43-49.
[8]刘其海,廖列文,刘自力.非晶态合金Co—Fe—B催化剂上肉桂醛选择加氢制肉桂醇[J].石油化工,2010,16(4):426-430.
[9]刘迎新,孟令富,魏作君,等.LaO3助剂对Au/TiO2催化肉桂醛选择性加氢性能的影响[J].催化学报,2011,32(7):1269-1274.
[10]Delbecq F,Sautet P.Competitive C=C and C=O adsorption of α -β unsaturated aldehydes on Pt and Pd surfaces in relation with theselectivity of hydrogenation reactions[J].Theoretical approach,J Catal,1995,152(2):217-236.
[11]高雪霞,王春霞,刘忠文,等.炭材料负载Pt催化肉桂醛选择性加氢性能的研究[J].工业催化,2008,16(10):88-91.
[12]Lee C,Yang W,Parr R G.Development of the colle-salvetti correlation-energy formula into a functional of the electron density[J].Phys Rev,1988,B37(1):785-789.
[13]Miehlich B,Savin A,Stoll H,et al.Results obtained with the correlation-energy density functionals of becke and lee[J].Chem Phys Lett,1989,157(2):200-206.
[14]Bader R W F.Atoms in Molecules[M].Oxford:Oxford University Press,1990.
[15]Barone V,Cossi M.Quantum calculation of molecular energies and energy gradients in solution by a conductor solvent model[J].Phys Chem,1998,A102(11):1995-2001.
[16]Frisch M J,Trucks G W,Schlegel H B,et al.Gaussian 09[S].Rev A.2nd.Wallingford CT:Gaussian Inc,2009.
