响应面法优化热泉菌Bacillus sp.Lc50-1的发酵产卡拉胶酶条件*
2014-10-08胡秋实苏忠亮何培青
胡秋实,苏忠亮,何培青,李 江
(1.青岛科技大学 化工学院,青岛 山东 266042;2.国家海洋局 第一海洋研究所,青岛 山东 266061)
卡拉胶是红藻细胞壁中的一种亲水性多糖,是由重复的α-(1,4)-D-吡喃半乳糖和β-(1,3)-D-吡喃半乳糖二糖单元为基本骨架,交替连接而成的线性硫酸多糖[1]。根据是否含有3,6内醚-D-半乳吡喃糖、硫酸基以及硫酸基在分子中的位置不同,可以将卡拉胶分为十几种类型,工业上目前主要使用和生产的有κ-、λ-、ι-三种类型。目前,近80%的卡拉胶用于食品及与食品相关工业,其余近20%用于医药、轻工、纺织、化工和化妆品领域。有研究成果表明卡拉胶在医药领域有很大的应用价值而且具有多种生物活性,如抗病毒、抗氧化、抗凝血、免疫调节等[2-5]。但由于卡拉胶多糖分子质量太大,使得其溶解性差、很难被机体吸收,严重限制了卡拉胶在医药领域的应用。相比卡拉胶多糖,卡拉胶寡糖具有较小的相对分子质量,其溶解性、安全性和稳定性也都有所增加。因为传统的化学方法和物理降解方法反应条件不易控制、产物分布不均匀,所以利用反应条件温和、底物专一的卡拉胶降解酶制备卡拉胶寡糖成为研究的热点。因此开展对卡拉胶降解酶的研究具有深远的理论意义和应用价值。
迄今为止,研究发现的卡拉胶酶多为热不稳定酶,当温度高于60℃时就会迅速失活[6]。而来源于嗜热微生物的高温酶因其作用温度高、热稳定性好等优点,在多个生物工程领域具有巨大的应用潜能。热泉是一个独特的生态环境,其温度一般在50℃以上,有些甚至高于100℃,因而生存于此环境的热泉菌具有独特的适应机制和新颖的代谢产物。近年来,有关高温酶的研究日益广泛,越来越多具有潜在应用前景的高温酶被发现和应用,但有关高温卡拉胶酶的研究还未见相关报道。
本研究从印尼热泉中筛选出1株高产卡拉胶酶菌株,初步研究表明该酶的最适酶活高于70℃,具有良好的应用前景。本研究采用响应面法对其产酶的发酵条件和培养基进行了优化,以提高其产酶量及稳定性,从而为该高温卡拉胶酶的分离纯化、酶学性质研究、酶解特性及工业化应用提供基础数据。
1 材料和方法
1.1 材 料
1.1.1 菌 种
产卡拉胶酶菌株分离自印尼热泉水样,保存于国家海洋局海洋生物活性物质重点实验室超低温冰箱(-80℃)。
1.1.2 培养基
液体培养基:蛋白胨3g,酵母粉3g,氯化钠3g,蒸馏水1L;
固体培养基:蛋白胨3g,酵母粉3g,卡拉胶15g,琼脂粉15g,氯化钠3g,蒸馏水1L;
斜面培养基:蛋白胨5g,酵母粉1g,琼脂粉15g,氯化钠3g,蒸馏水1L。
1.2 方 法
1.2.1 酶活的测定-DNS法
取0.5mL的酶液加入到1mL的卡拉胶底物(含0.2%卡拉胶的0.2mol·L-1甘氨酸-NaOH缓冲液,pH 9.0)中,70℃反应15min,用100℃灭活10min的酶液作对照;取1mL反应物与1.5mL DNS试剂分别加入比色管中,沸水浴中加热5min,立即冷却至室温,定容到25mL,摇匀,于520nm处测光吸收值;根据半乳糖标准曲线确定产生还原糖的量。1个酶活力单位(U)定义为:在该条件下,每分钟产生1μg还原糖(以 D-半乳糖计)所需要的酶量[7]。
1.2.2 单因素筛选
将上述液体培养基作为发酵基本培养基,分别对接种量、C源、N源、金属离子、pH值和培养温度进行单因素变量实验,其他发酵条件均与液体培养基相同,每组设置3个平行对照用DNS法测酶活。
1.3 响应面实验
根据Plackett-Burman实验(略)筛选出的4个显著性因素,设计Box-Behnken试验,根据设定参数进行一系列实验,将实验结果输入 Design-Expert.V8.0.6软件中。在 Design-Expert.V8.0.6软件中进行二次响应面回归分析并建立回归模型、方差分析及可信度分析。
根据回归方程及相应曲面确定最大值点以及其对应的因素的编码水平,在该水平下进行发酵产酶实验,比较实际值与预测值的差别,验证模型的正确性[8]。
2 结果与分析
2.1 单因素试验结果
本研究分别考察了培养温度、pH值、C源、N源、金属离子、接种量六种单因素变量对酶活的影响,结果表明各种环境因子对该菌的生物量(OD600)和酶活都有较显著的影响。在综合考虑环境因子对生物量和酶活影响的基础上,初步确定培养温度为50℃、pH 7.0及培养基成分(卡拉胶0.3%、蛋白胨0.3%、KCl 25 mmol·L-1、NaCl添加量3‰)(图1)。
2.2 Box-Behnken实验设计及结果
C源通过Plackett-Burman实验筛选出了4个显著性因素:培养温度、卡拉胶质量分数、蛋白胨质量分数(N源)、KCl浓度,设计Box-Behnken实验,考察了这4个显著因素之间的交互作用及最佳取值。对这4个显著因素的水平设计及编码见表1,Box-Behnken实验设计及结果见表2。

表1 Box-Behnken实验因素及水平Table 1 Tested Factors and level values of Box-Behnken test
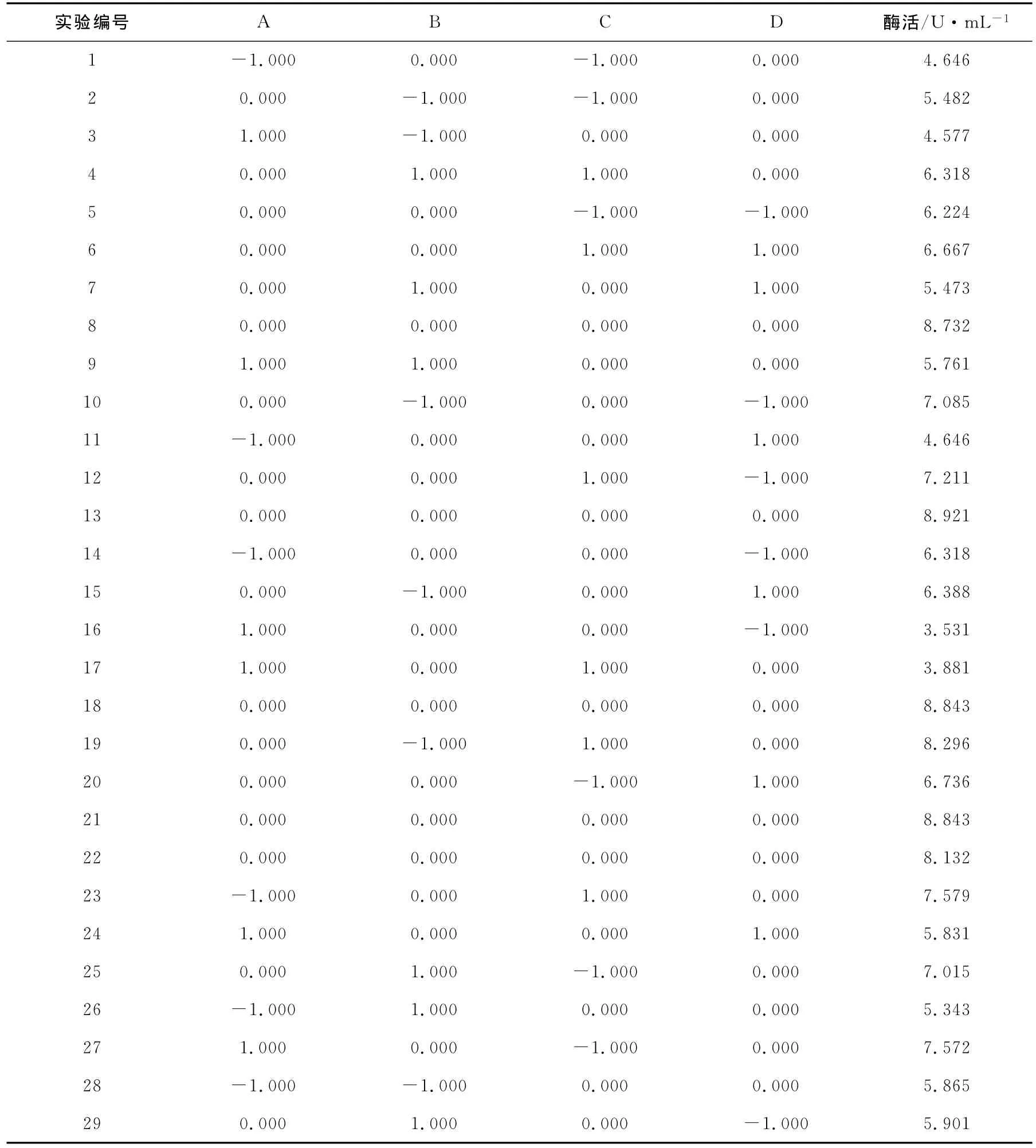
表2 N=29的Box-Behnken实验设计及结果Table 2 Experimental design and results of Box-Behnken test(N=29)
根据Box-Behnken实验结果(表2),以菌株Lc50-1发酵液酶活(U·mL-1)为响应值利用Design-Expert.V8.0.6软件进行回归分析,得到二次回归模型:
Y=8.7098-0.22867A-0.11517B+0.18975C-0.044083D+0.3015AB-1.656AC+0.993AD-0.87775BC+0.06725BD-0.264CD-2.21723A2-1.22298B2-0.64511C2-1.34711D2
由回归方差分析(表3)可知:此模型回归性显著,回归模型的R2=93.87%,说明该模型可以解释93.87%实验所得菌株Lc 50-1酶活的变化,从而说明该模型与实际拟合较好,可用于菌株Lc 50-1酶活的分析与预测,适合菌株Lc 50-1发酵产酶条件的优化。

表3 回归方程的方程方差分析Table 3 Variance a Analysis of regression equation
2.3 响应面分析及最佳发酵条件的确定
利用Design-Expert软件对回归模型进行响应面分析得到6个响应面回归分析图(图2~7),可直观地反映出各因子的变化对响应值影响。
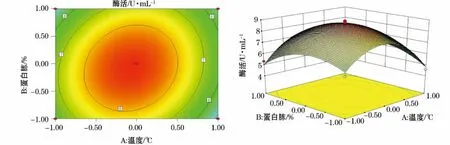
图2 Y=(A,B)的等高线图及响应面立体分析图Fig.2 Y=(A,B)contour plot and response surface stereogram
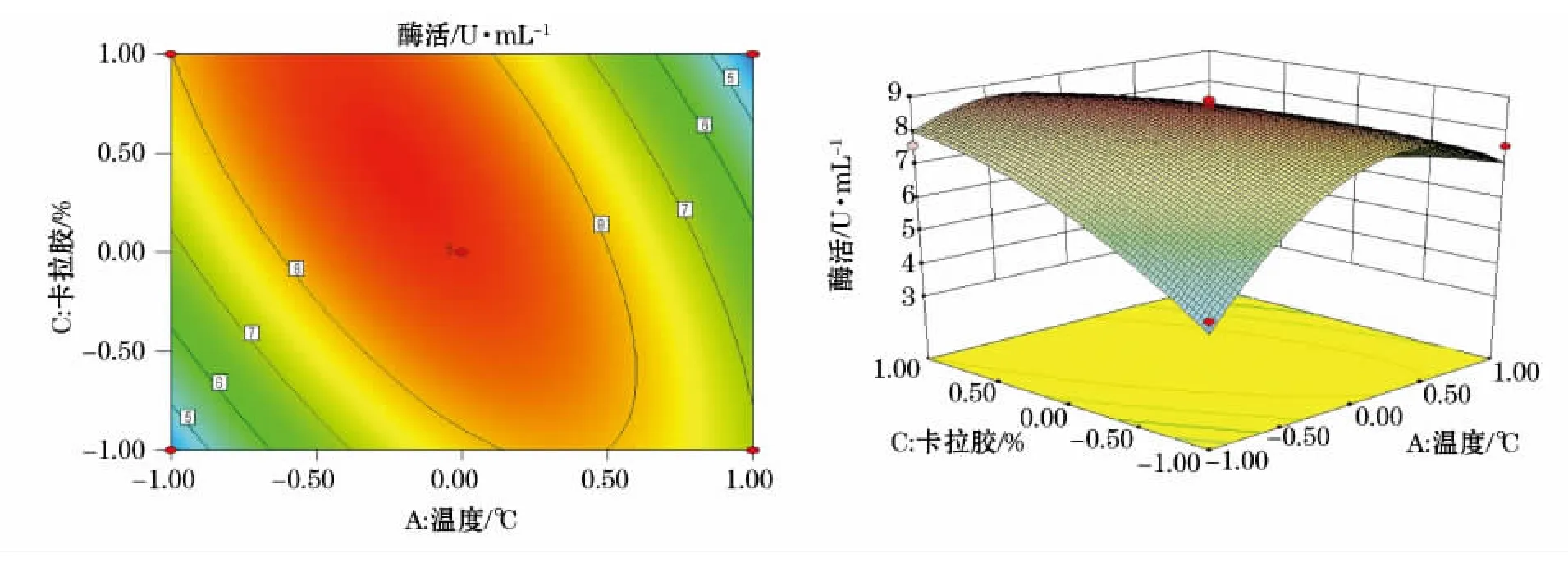
图3 Y=(A,C)的等高线图及响应面立体分析图Fig.3 Y=(A,C)contour plot and response surface stereogram
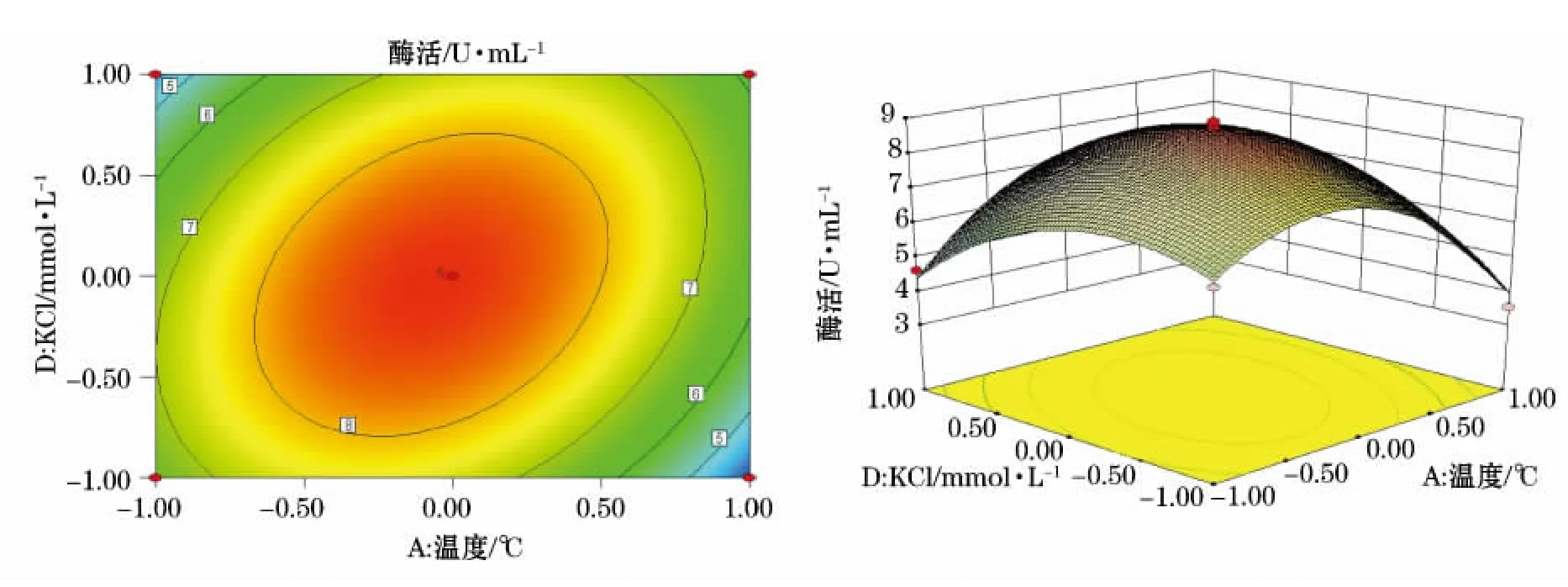
图4 Y=(A,D)的等高线图及响应面立体分析图Fig.4 Y=(A,D)contour plot and response surface stereogram
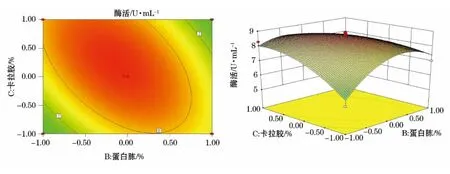
图5 Y=(B,C)的等高线图及响应面立体分析图Fig.5 Y=(B,C)contour plot and response surface stereogram
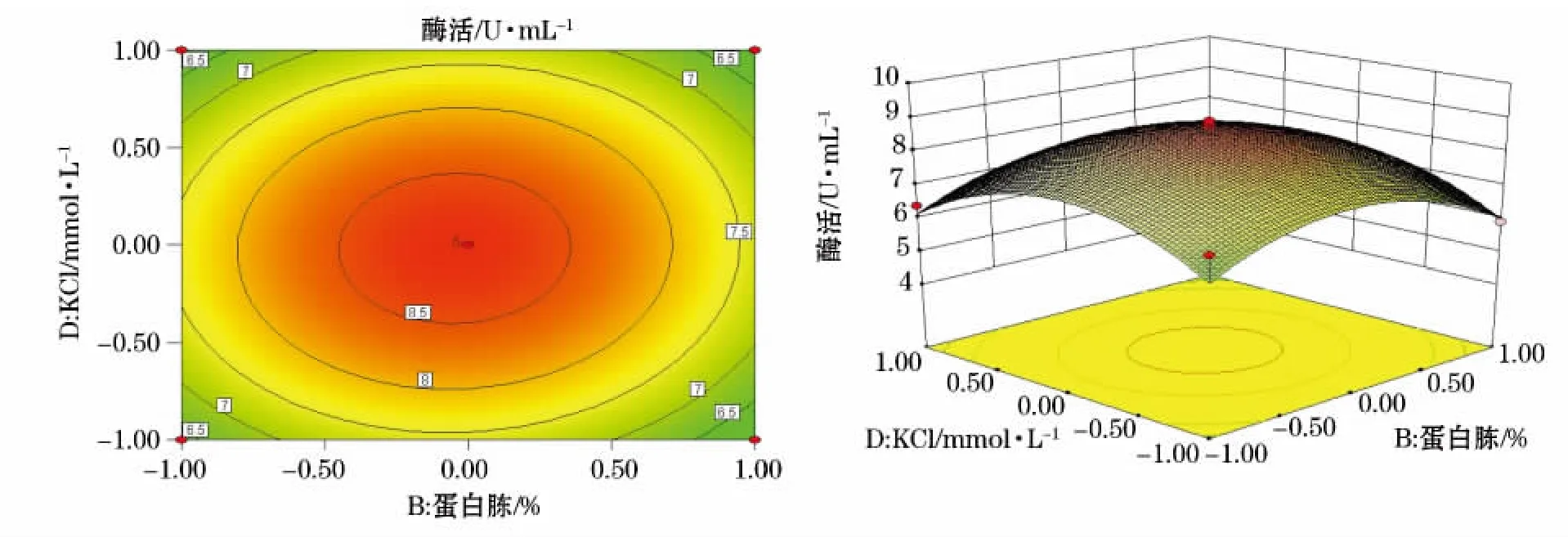
图6 Y=(B,D)的等高线图及响应面立体分析图Fig.6 Y=(B,D)contour plot and response surface stereogram
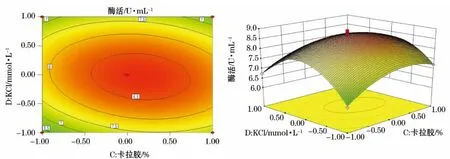
图7 Y=(C,D)的等高线图及响应面立体分析图Fig.7 Y=(C,D)contour plot and response surface stereogram
通过Design-Expert软件进一步分析预测,达到最高酶活值时,其所对应的A、B、C、D四个因素的编码值分别为-0.49、-0.48、1、-0.31,即培养温度47.5℃(理论值47.45℃)、蛋白胨0.25%(理论值0.248%)、卡拉胶0.3%、KCl 21.55mmol·L-1(由于实验室具体条件无法达到一些理论值的精确度,故选取与理论值最接近的值),此时预测最大酶活值为8.904U·mL-1。根据预测的最佳条件进行3组发酵实验,得出的实际酶活值为:8.883 2U·mL-1、8.824 3U·mL-1、8.921 2U·mL-1,均与预测值8.904 1U·mL-1接近,说明该模型能够较好地预测该菌实际发酵情况。
3 讨 论
本研究从印尼热泉水样中筛选出的高产耐高温卡拉胶酶菌株Lc 50-1,初步鉴定为芽孢杆菌属(Bacillus.sp)。以往研究报道的产卡拉胶酶的菌种多是假单胞菌[12]、弧菌[13]、噬纤维菌[14]等,而对芽孢杆菌属(Bacillus.sp)产卡拉胶酶的研究尚未见报道。该研究进一步丰富和扩大了现有的卡拉胶酶资源。
菌株Lc50-1所产的卡拉胶酶具有较高耐热性和热稳定性,与已报道的卡拉胶酶[15-17]相比具有明显优势,有望开发应用于高温条件的工业生产中,避免多步反应和副反应过程,可为优化工艺流程开辟一条新的途径。
与传统的正交实验相比,响应面分析法具有周期短、精度高、实验次数少等优点,不仅能够评价各因素对生物发酵过程的影响,并且还能探究几个因素的交互作用,得到最佳条件,是优化培养条件的有效方法。目前,响应面分析法已在生物技术的众多领域,尤其是微生物产酶条件优化方面得到广泛应用[8-11]。本实验经响应面法优化后所得酶活与预测值较为吻合,从而说明该模型设计的合理有效性,优化后发酵上清液的酶活比未优化时提高了1.5倍。影响菌株卡拉胶酶产量和活力的因素,除菌种外,培养基组成和发酵条件也十分重要。因此,选择适当的C源、N源及金属离子并对其组成进行合理的设计和配制,使其既能满足产酶微生物生长的需要,也能满足菌株产酶的需要。本研究采用响应面法对产卡拉胶酶热泉菌株Lc50-1的培养条件进行了优化,有效提高了酶活和产量,从而为高温卡拉胶酶及卡拉寡糖的开发利用提供了科学依据和技术支撑。
(References):
[1] MCLEAN M W,WILLIAMSON F B.κ-Carrageenase fromPseudomonascarrageenovora[J].European Joumal of Biochemistry,1979,93:553-558
[2] YUAN H,SONG J,LI X,et al.Immunomodulation and antitumor activity of kappa-carrageenan oligosaccharides[J].Cancer Lett,2006,243(2):228-234.
[3] HU X K,JIANG X L,AUBREE E,et al.Preparation and invivo antitumor activity of kappa-carrageenan oligosaccharides[J].Pharmaceutical Biology,2006,44:646-650
[4] MOU H J,JIANG X L,GUAN H S.Aκ-carrageenan derived oligosaccharide prepared by enzymatic degradation containing antitum or activity[J].Journal of Applied Phycology,2003,15:297-303
[5] YAMADA T,OGAMO A,SAITTO T,et al.Preparation an danti-HIV activity of low-molecular-weight carrageenans and their sulfated derivatives[J].Carbohydrate Polymers,1997,32(1):51-55.
[6] TANG Z H,LV J S,ZHANG Z,et al.Screening of marine bacterium producing carrageenan enzyme and its enzymatic properties[J].
Food Science and Technology,2011,36(6):18-21.唐志红,吕家森,张振等.产卡拉胶酶海洋菌株的筛选和酶学性质的初步研究[J].食品科技,2011,36(6):18-21.
[7] GU Y S.Determination methods of enzymatic activities of pectinase as a biologic additive in textile[J].Textile Sci Res,2002,3:29-35.
[8] ZHANG T T,SHEN M H.Optimization of culture medium for laccase production fromPycnoporussanguineus(Fr.)Murr.by Plackett-Burman design and response surface methodology[J].Science and Technology of Food Industry,2011,32(9):223-227.张田田,沈明浩.Plackett-Burman设计和响应面法优化火红密孔菌发酵产漆酶培养基[J].食品工业科技,2011,32(9):223-227.
[9] SUN W Y,CHEN X,SHI Y,et al.Optimization of fermentation medium of acetic acid by Acetobacter through response surface method[J].Chemistry &Bioengineering,2011,28(1):37-41.孙文瑛,陈雄,石勇等.响应面法优化醋酸菌的发酵产酸培养基[J].化学与生物工程,2011,28(1):37-41.
[10] ZHOU M F,HUANG P,ZHANG W W.Optimization of fermentation production medium of Glutathione by Saccharomyces cerevisiae using response surface methodology[J].Food and Fermentation Technology,2011,47(5):15-21.周铭锋,黄璠,张为巍,等.响应面法优化谷胱甘肽发酵培养基的研究[J].食品与发酵科技,2011,47(5):15-21.
[11] WANG H,DENG Z Y,LIU R,et al.Optimization of extraction technology of polysaccharides fromPetasitestricholobusroots by response surface analysis[J].Food Science,2010,30(2):46-50.王鸿,邓泽元,刘蓉,等.响应曲面法优化山蕗菜根多糖的提取工艺[J].食品科学,2010,30(2):46-50.
[12] KHAMBHATY Y,MODY K,JHA B,et al.Statistical optimization of medium components forκ-carrageenase production byPseudomonaselongata[J].Enzyme and Microbial Technology,2007,40:813-822.
[13] ARAKI T,HIGASHIMOTO Y,MORISHITA T.Purification and characterization ofκ-carrageenase from a marine bacteriumVibriosp.CA-1004[J].Fisheries Science,1999,65(6):937-942.
[14] SARWAR G,MATAYOSHI S,ODA H.Purification of a kappa-carrageenase from marineCytophagaspecies[J].Microbiology and Immunology,1987,31:869-877.
[15] WANG F F,YAO Z A,WU H G,et al.Optimum cultivation conditions forκ-carrageenanase produced byCellulophagalyticastrainN5-2[J].China Brewing,2011,(8):21-25.王飞飞,姚子昂,吴海歌,等.κ-卡拉胶酶海洋CellulophagalyticastrainN5-2的最佳培养条件研究[J].中国酿造,2011,(8):21-25.
[16] ZHOU M H,MA J S,LI J,et al.Aκ-carrageenase from a newly isolatedpseudoalteromonas-like bacterium,WZUC10[J].Biotechnology and Bioprocess Engineering,2008,13(5):545-551.
[17] YASMIN K,KALPANA M,JHA B.Purification and characterization ofκ-carrageenase from a novelγ-proteobacterium,Pseudomonaselongata(MTCC 5261)syn.Microbulbiferelongatuscomb.Nov.[J].Biotechnology and Bioprocess Engineering,2007,12(6):668-675.
