米库氯铵用于腹腔镜胆囊手术的临床观察
2014-09-26伍江明罗远国
伍江明,李 洪,张 旭,王 东,罗远国
(解放军第一八一医院麻醉科,广西桂林541002)
米库氯铵是临床上最短效的苄异喹啉类非去极化肌肉松弛药,单次给药或长时间连续输注在体内不产生快速耐受、无明显蓄积,主要在血浆中被乙酰胆碱酯酶或其他酯酶水解[1]。本文探讨米库氯铵和顺阿曲库铵肌肉松弛恢复时间及拔管情况,旨在为临床实践提供参考,现报道如下。
1 资料与方法
1.1 一般资料 选择气管插管全身麻醉下行腹腔镜胆囊手术患者60例,年龄20~60岁,美国麻醉医师学会(ASA)分级Ⅰ~Ⅱ级,心、肺、肝、肾功能检查均正常,均无酸碱平衡失调及水电解质代谢紊乱,无神经、肌肉系统疾病史,无1个月内服用可能影响神经肌肉功能的药物史。将研究对象分为A组、M组,每组30例。两组间年龄、性别构成、ASA分级等的差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 药物配制 根据分组配制两种外观相同的肌肉松弛药:A组:顺阿曲库铵[东英(江苏)药业有限公司,批号:20120516]每50mL 15mg生理盐水;M组米库氯铵(葛兰素史克公司,批号:1449)每50mL 50mg生理盐水。麻醉开始时交给实验者,不告知组别。
1.2.2 麻醉方法 患者入手术室后开放左侧上肢外周静脉,采用DASH4000麻醉监护仪监测血压、心电图及脉搏血氧饱和度等,使用合肥诺和NW-9005麻醉深度监测仪指导麻醉药泵入量。麻醉诱导给予咪达唑仑0.05mg/kg,瑞芬太尼2μg/kg,丙泊酚2mg/kg,患者入睡后给予琥珀胆碱1.5mg/kg,肌肉松弛起效后气管插管。术中维持:持续泵注丙泊酚、瑞芬太尼,肌肉松弛药,维持平均动脉压(MAP)、心率(HR)±20%,麻醉深度CSI 40~50,手术结束前给予舒芬太尼0.15μg/kg,缝皮停药。拔管指证:第1个肌颤搐反应幅度的比值(TOFR)大于或等于90%,且患者能听从指令,抬臂和抬头能持续5s,脱氧呼吸空气维持血氧饱和度大于或等于95%达5min。
1.2.3 肌肉松弛监测及维持 麻醉诱导前在左上肢安置HXD-1CO28肌肉松弛监测仪(黑龙江华翔科技公司),将传感器固定于患者拇指掌侧,相关电极置于尺神经表面皮肤上。待患者入睡后开始肌肉松弛定标,然后以4个成串刺激(TOF,刺激电流60mA,频率2Hz,波宽200μs,串间间隔12s)连续刺激尺神经,监测拇内肌肌颤搐的程度。假设两组肌肉松弛药的浓度均为1 000μg/mL,气管插管后3min两组患者均以10 μg·kg-1·min-1输注速度泵注肌肉松弛药,术中根据肌肉松弛监测值调整输注速率,维持肌肉松弛深度TOF的第一个肌颤搐反应幅度小于或等于5%。
1.2.4 观察指标 肌肉松弛药平均输注速度;TOF的第一个肌颤搐反应幅度恢复25%时(T1)、TOF的第一个肌颤搐反应幅度恢复75%时(T2)、TOF的第4个肌颤搐反应幅度与TOF的TOFR≥90%时(T3)、拔管时(T4)的时间及各时点 MAP、HR、血氧饱和度(SPO2),并计算肌肉松弛恢复指数;术中并发症:皮肤潮红、皮疹、支气管痉挛。术后并发症:乏力、恶心、呕吐、意识障碍、低氧血症。所有实验结束后解盲,按每组肌肉松弛药配制方法换算术中肌肉松弛药的实际平均输注速度,并分组统计各项观察指标。
1.3 统计学处理 采用SPSS19.0统计软件进行分析,计量资料以表示。组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 肌肉松弛药平均泵注速度比较 A组为(2.4±0.7)μg·kg-1·min-1,M组为(8.9±3.3)μg·kg-1·min-1。

表1 两组肌肉松弛恢复时间比较(n=30,x±s,min)
2.2 肌肉松弛恢复时间 米库氯铵组与顺阿曲库铵组比较,恢复指数、拔管时间均明显缩短,见表1。
2.3 肌肉松弛恢复过程 MAP、HR、SPO2变化情况 两组患者在肌肉松弛恢复过程中各时点 MAP、HR、SPO2比较,差异均无统计学意义(P>0.05),见表2。
2.4 并发症 两组术中均未出现皮肤潮红、皮疹、支气管痉挛等、术后均未出现乏力、恶心、呕吐、意识障碍、低氧血症等并发症。
表2 两组肌肉松弛恢复各时点MAP、HR、SPO2比较(n=30,±s)
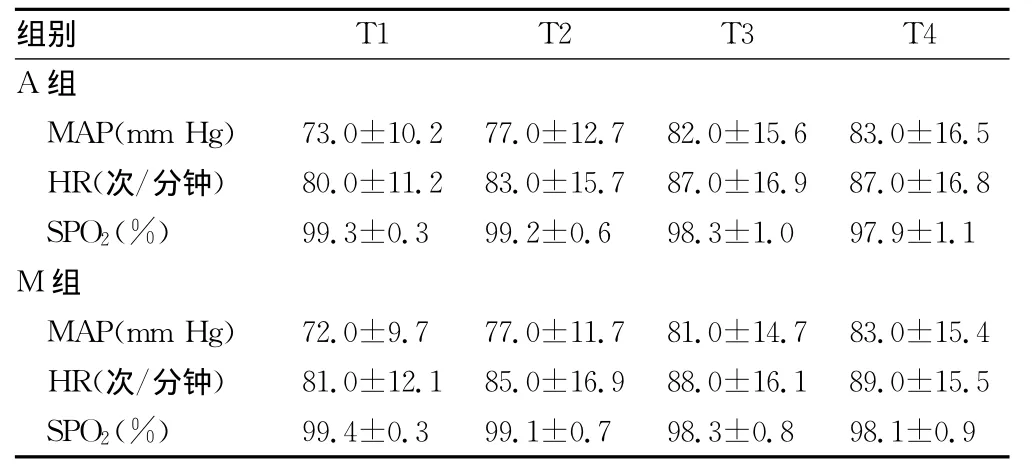
表2 两组肌肉松弛恢复各时点MAP、HR、SPO2比较(n=30,±s)
T1 T2 T3 T4 A组别组MAP(mm Hg) 73.0±10.2 77.0±12.7 82.0±15.6 83.0±16.5 HR(次/分钟) 80.0±11.2 83.0±15.7 87.0±16.9 87.0±16.8 SPO2(%) 99.3±0.3 99.2±0.6 98.3±1.0 97.9±1.1 M组MAP(mm Hg) 72.0±9.7 77.0±11.7 81.0±14.7 83.0±15.4 HR(次/分钟) 81.0±12.1 85.0±16.9 88.0±16.1 89.0±15.5 SPO2(%)99.4±0.3 99.1±0.7 98.3±0.8 98.1±0.9
3 讨 论
米库氯铵是可迅速被血浆假性胆碱酯酶分解代谢,且具有作用时间短的非去极化肌肉松弛药[2-3]。但是因其构效关系的特殊及剂量依赖性组胺释放效应,可能会继发心血管不良反应[4-5]。有研究[6-7]表 明 持 续 泵 注 剂 量 为 5~15μg·kg-1·min-1的米库氯铵或2μg·kg-1·min-1的顺阿曲库铵可以维持90%~99%的肌颤束抑制效应而达到满意的肌肉松弛效果。本研究中两组均达到满意的肌肉松弛效果时的平均给药速度分别为:米库氯铵组(8.9±3.3)μg·kg-1·min-1,顺阿曲库铵组(2.4±0.7)μg·kg-1·min-1,结果进一步证明上述研究。且术中观察两组均未出现皮肤潮红、皮疹、支气管痉挛等并发症,这可能与给药方法有关:采用琥珀胆碱诱导气管插管,避免了使用短时、量大的诱导负荷剂量;术中泵注给药维持满意肌肉松弛效果,而不是间断地推注,降低了体内药物浓度的峰值。
对于血浆胆碱酯酶正常的患者,米库氯铵自然恢复十分迅速,在体内无蓄积[8-9]。本研究中米库氯铵恢复指数(3.9±1.7)明显短于顺阿曲库铵(9.2±4.7),拔管时间米库氯铵(19.3±5.5)也明显短于顺阿曲库铵(32.2±7.3),结果进一步证明了上述研究。
周业建等[10]认为,在瑞芬太尼全身麻醉术后给予舒芬太尼0.15μg·kg-1·min-1能达到满意的止痛效果和有效抑制拔管时并发症。本研究中,肌肉松弛恢复各时点 MAP、HR、SPO2的差异均无统计学意义也进一步证明了上述研究。
肌肉松弛拮抗一向备受争议,深度肌肉松弛下新斯的明拮抗后出现肌肉松弛延长现象[11-12],由于米库氯铵自然恢复十分迅速,可不使用肌肉松弛拮抗药[13],避免了肌肉松弛拮抗药使用不当导致的心血管不良反应[14]。Curran等[15]报道,米库氯铵肌肉松弛拮抗相关并发症明显低于其他非去极化肌肉松弛药。本研究中,肌肉松弛恢复阶段米库氯铵心血管不良反应与顺阿曲库铵无明显差异,拔管后30min观察与顺阿曲库铵无明显差异(意识、睁眼、咳嗽、视觉、压舌板实验均未见异常)。术后两组均未出现乏力、恶心、呕吐、意识障碍、低氧血症等并发症,相关因素可能有:(1)未使用肌肉松弛拮抗药物,避免了其本身的不良反应和对血流动力学的影响;(2)手术结束前使用了合适剂量的舒芬太尼,抑制了肌肉松弛恢复期间的各种不良反应。
苄异喹啉类非去极化肌肉松弛药的立体异构特性跟其组胺释放效应强弱有关,顺阿曲库铵几乎无组胺释放作用[16]。某些报道米库氯铵所至皮肤潮红、皮疹、支气管痉挛等不良反应,虽然本实验未出现这些组胺释放的不良反应,但临床上使用仍有较多顾虑。如针对其立体异构体的改进或许可以减少其组胺释放的不良反应,米库氯铵在临床上定能得到更广泛的应用。
综上所述,米库氯铵在临床麻醉范围内的药量在体内无明显蓄积,不受静脉剂量多少或维持时间长短而影响恢复曲线,术后恢复时间短,无需拮抗,不良反应小,可以良好地预测清醒时间,特别适用于短小手术、日间手术麻醉、术中泵注给药,为某些神经外科手术的术中唤醒提供了可能;若对其立体异构体进行改进,减少其组胺释放的不良反应必有更大的临床应用空间。
[1]鲁显福,曾因眀.米库氯铵的过去、现在与未来[J].国际麻醉学与复苏学杂志,2010,31(5):423-426.
[2]Savaress JJ,Ali HH,Barta ST,et al.The chinical neuromuscular pharmacology of mivacurium chlorid(BWB109u)[J].Anesthesiology,1988,68(5):723-732.
[3]Caldwell JE,Heier T,Kitts JB,et al.Comparision with meutomuscular block induced by mivacurium,suxamthonium or artacurium during nitrous oxide-fentanylanesthesia[J].Br J Anaesth,1989,63:393-399.
[4]Sorooshian SS,Stafford MA,Eastwood NB,et al.Pharmacokinetics and pharmacodynamics of cisatracurium in young and elderly adult patients[J].Anesthesiology,1996,84(5):1083-1091.
[5]Gursoy S,Bagcivan I,Durmus N,et al.Investigation of the cardiac effects of pancuronium,rocuronium,vecuronium,and mivacurium on the isolated rat atrium[J].Current Therapeutic Research,2011,72(5):195-203.
[6]Mofarrahi M,Nouh T,Qurshi S.Regulation of angiopoietin expression by bacterial lipopolysaccharide[J].Am J Physiol Lung Cell Mol Physiol,2008,294(5):955-963.
[7]王毅,张晓琳.持续输注国产顺式阿曲库铵在全身麻醉中肌松作用的研究[J].甘肃医药,2012,31(1):17-20.
[8]Ezzine S,Donati F,Varin F,et al.Mivacurium arteriovenous gradient during steady state infusion in anesthetized patients[J].Anesthesiology,2002,97(3):622-629.
[9]Lacroix M,Donati F,Varin F.Pharmacokinetics of mivacurium isomers and their metabolites in healthy volunteers after intravenous bolus administration[J].Anesthesiology,1997,86(2):322-330.
[10]周业建,夏玉军.舒芬太尼在瑞芬太尼静脉全麻术后拔管时的应用[J].中国医药指南,2012,10(18):173.
[11]Rubin LA,Lien CA,Savarese JJ.Mivacurium:a novel,shortacting,nondepolarizing muscle relaxant[J].Seminars in Anesthesia,1995,114(4):245-256.
[12]Lee KS,Lee KY,Kim SR,et al.Blockade of airway inflammation and hyper-responsiveness by an angiopoietin-1 variant,COMPAngl[J].Exp Mol Med,2007,39(6):733-745.
[13]段赫,王俊科,盛卓人,等.美维库铵持续静滴与单次静注肌松效应及恢复过程的临床药学观察[J].临床麻醉学杂志,2000,16(5):225.
[14]李艳,周晓莉,王保国,等.新斯的明和阿托品用于肌松拮抗时对血流动力学的影响[J].首都医科大学学报,2003,24(1):67-70.
[15]Curran MJ,Shaff L,Savarese JJ.Comparison of spontaneous recovery and neostigmine-accelerated recovery from mivacurium neuromuscular blockade[J].Anesthesiology,1988,69(Suppl):A528.
[16]Naguib M.Neuromuscular effects of rocuronium bromide and mivacurium chloride administered alone and in combination[J].Anesthesiology,1994,81(2):388-395.
