纳米TiO2固载脂肪酶及其固载界面表征
2014-09-22陶玉贵刘任龙
周 朋,陶玉贵,曹 宁,张 健,刘任龙
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
脂肪酶又称三酰甘油酯水解酶(EC3.1.1.3),可以专一高效地催化分解甘油三酯,普遍存在于动植物和微生物中[1-3].脂肪酶广泛应用于医药、化工、食品和化妆品等行业[4-5].相较于游离酶而言,固定化酶有着更好的操作稳定性,有利于下游产物的分离纯化,便于回收重复利用[6].
目前,利用纳米无机材料作为酶固定化的载体已得到广泛应用[7-8].无机材料TiO2对有机物质具有较好的吸附性,生物亲和性好、无毒害,化学稳定性好,机械强度高,将会是很好的酶固定化载体[9-10].在酶的固定化中,酶与载体表面的作用方式可能会引起酶结构的变异,增加底物与酶活中心的空间位阻,从而导致酶活力下降、酶固定量也受到限制.因而,研究酶蛋白在载体表面的界面特性是酶固定化的关键[11].
本文在前期仿生合成纳米TiO2基础上,分别以仿生合成的纳米线、纳米花以及纳米片TiO2为载体进行脂肪酶固定化,进一步研究固定化效果最好的载体.采用SEM、XRD、FT-IR以及比表面积分析仪等表征固定化酶,对纳米TiO2载体固定脂肪酶的界面特性进行了初步探究.
1 实验部分
1.1 实验药品
脂肪酶,牛血清蛋白,考马斯亮蓝,聚乙烯醇(PVP),无水乙醇,橄榄油,均为化学纯,国药集团化学试剂有限公司;TiO2纳米线(锐钛矿,SBET=312.58m2/g,Pore Radius Dv(r)=16.69nm)、纳米花(TiO2/ZnO复合体,SBET=219.54m2/g,Pore Radius Dv(r)=18.53nm)以及纳米片(钛酸盐,SBET=169.50m2/g,Pore Radius Dv(r)=48.44nm)载体均为实验室自制.
1.2 酶固定化方法
在25mL浓度为0.1mol/L的磷酸盐缓冲溶液(PBS,pH=7.5)中加入一定量的酶粉,搅拌0.5h使之充分溶解.然后将0.5g载体(静置在pH=7.0,浓度0.1mol/mL的磷酸缓冲溶液24h)加入脂肪酶的PBS中,室温下搅拌一定时间,过滤,将固定化酶用滤液反覆洗涤,收集滤液,滤液待用,以便测定滤液中酶的活力.所得的固体干燥至恒重,得到固定化酶.
1.3 蛋白负载率和酶活测定方法
固定化酶蛋白含量的测定采用Brandford法.
固定化效率(% )=(初始酶液总蛋白-残液总蛋白)/初始酶液总蛋白×100%.
固定化酶活力采用橄榄油乳化及NaOH滴定法测定.固定化酶活力单位:每克固定化酶在37℃下,每分钟水解橄榄油产生1μmol脂肪酸所需的酶量为1个活力单位(U/g).
1.4 表征方法
采用日立S-4800扫描电子显微镜研究样品形貌;在Bruker D8Advance型X射线衍射仪上进行XRD表征,采用连续扫描方式,扫描范围2θ=10°~80°;利用岛津IRPrestige-21傅立叶变换红外光谱仪研究样品中基团的变化;通过美国康塔NOVA 2000e比表面积及孔径分析仪测试样品的比表面积.
2 结果与讨论
2.1 纳米TiO2形貌对酶固载率的影响
分别以自制的线状、花状和片状TiO2为载体,在相同条件下固定化脂肪酶,再测定固定化酶的活力和固载率,实验结果如图1所示.由图1可知,3种载体中线型形貌载体的固载率最高,且酶活也较好.纳米线型的TiO2为纯的锐钛矿,在3种载体中具有较高的BET、孔径与脂肪酶也较为接近.因而,最终选择固定化效果最好的线型形貌TiO2为载体,并研究了固定化时间、温度、pH以及酶载量对固定化的影响.
2.2 纳米线TiO2固载脂肪酶的条件研究
(1)加酶量对固定化的影响.在25mL、pH为7.5磷酸盐缓冲液中分别加入0.1~1.6g的脂肪酶,于40℃下固定化6h,考察加酶量对固定化的影响,结果如图2所示.由图2可知,随着酶量的增加,固定化的固载率和固定化酶活性都呈现出先增后降的趋势.酶量达0.2g时,固载率和固定化酶活性均最高,此后再增加酶量,固载率和固定化酶活性呈现下降趋势.这可能是由于加酶量为0.2g时,吸附到载体上的脂肪酶已达到饱和,难以继续与反应介质中酶分子反应.因此,本实验采用0.2g作为最佳加酶量.
(2)pH对固定化的影响.在25mL、pH为6.0~8.5的磷酸盐缓冲液中加入0.2g的脂肪酶,于40℃下固定化6h,考察了反应体系pH值对固定化的影响,结果如图3所示.由图3可知,随pH的升高,固定化的固载率和固定化酶活性都呈现先升后降.当pH=7.0时,固载率达到最高;而pH=7.5时,固定化酶活性达到最高.综合考虑选择pH=7.0为最适固定化pH.

图1 不同载体对固定化的影响

图2 加酶量对固定化的影响

图3 pH对固定化的影响
(3)固定化时间对固定化的影响.在25mL、pH为7.5磷酸盐缓冲液中分别加入0.2g的脂肪酶,于40℃下固定化1~9h,考察反应时间对固定化的影响,结果如图4所示.由图4可知,随着固定化时间的延长,固定化的固载率和固定化酶活性呈现增大的现象,但到一定条件后,固载率和酶活性的增加均趋向平缓.这可能是由于固定时间达到6h以后,TiO2载体的负载量也基本达到饱和,时间的延长,将不会增加酶的固载量.所以,固定化为6h已可以达到要求.
(4)固定化温度对固定化的影响.在25mL、pH为7.5磷酸盐缓冲液中分别加入0.2g的脂肪酶,于25~55℃下固定化6h,考察反应温度对固定化的影响,结果如图5所示.由图5可知,随固定温度的升高,固载率变化幅度较小,但对酶活性影响较大.在40℃时,固定化酶活性最高,随温度的升高酶活性迅速下降.原因是在高温下,酶活性部位遭到破坏,从而导致酶活性下降.综合考虑,以40℃为最佳的固载温度.根据上述单因素试验结果,确定pH、加酶量、吸附时间为影响脂肪酶固载率的3个显著因素.采用Box-Beheken统计学试验设计方法,对上述3个显著因素进行优化,得到3个条件的最佳组合为:pH为7.0、加酶量为0.25g、反应时间为6.3h,在此条件下,脂肪酶的理论固载率为80.12%.
2.3 纳米线TiO2固载酶及其界面表征
(1)SEM分析.纳米线TiO2固定前后的SEM图如图6所示.由图6a可知,载体为形貌较好、线条分明的纳米线,其直径在20~40nm之间,长度达几微米至十几微米,纳米线彼此交叉弯曲、相互交织.由图6b可知,絮状物是团聚在纳米线载体表面的脂肪酶.

图4 固定化时间对固定化的影响

图5 固定化温度对固定化的影响

图6 固定化前后样品的SEM图
(2)XRD分析.实验所用的纳米线TiO2具有一定的介孔性质,其孔径为16.69nm,较接近于脂肪酶的三维尺寸.当孔大小与蛋白质尺寸相当时,蛋白质在孔内的扩散系数远高于在溶液中[12].蛋白质是否进入载体材料的孔道内,可根据XRD强度变化来判断,一般载体吸附蛋白质后XRD强度会下降[13].纳米线TiO2固定前后的XRD图谱如图7所示.对比可知,固定化前后的样品均为无定形结构,虽然很难判断XRD衍射强度是否下降,但可明显看出固定化前后两者的XRD图谱存在区别,一定程度证明了脂肪酶与载体纳米线发生了作用.
(3)FT-IR分析.FT-IR对固载酶蛋白质分子与载体的界面表征,结果如图8所示.由图8可知,游离脂肪酶(见图8a)在1 651cm-1和1 533cm-1出现了红外特征峰,分别属于氨基I区和氨基II区.其中氨基I区(1 600~1 700cm-1)来自于蛋白质的ɑ-螺旋、β-折叠、β旋转以及无规则卷曲.酰胺II区(1 500~1 600cm-1)为C-N伸缩振动和蛋白质骨架的N-H弯曲振动[14].对比可见,固定化酶(见图8c)中也明显含有这两个特征吸收峰,从而证明游离的脂肪酶已固载于TiO2载体上,可能是由于脂肪酶在载体界面上二级结构发生变化,与文献[15]报道一致.
(4)比表面积及孔径分析.实验中所用纳米线载体具有较高的比表面积,同时具有介孔性质.当脂肪酶固定到纳米线上,会引起纳米线载体比表面积和孔径上的改变.对固定化前后的样品进行N2吸附-脱附实验,结果如图9和表1所示.由图9可知,两者均属于Ⅴ型等温线,且表现出一定的磁滞现象,但两者存在明显的区别.由表1可知,固定化酶的比表面积和平均孔径均小于纳米线载体,这说明脂肪酶结合到纳米线载体的表面和空隙内.

图7 固定化前后样品的XRD图谱
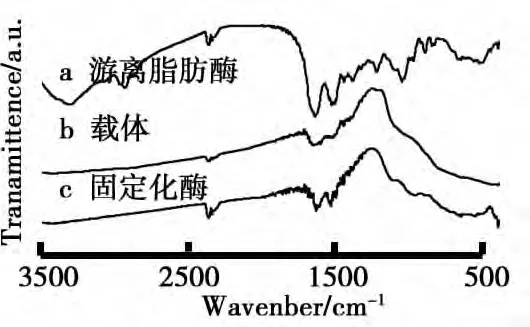
图8 样品的FT-IR图谱

图9 样品的N2吸附-脱附等温线
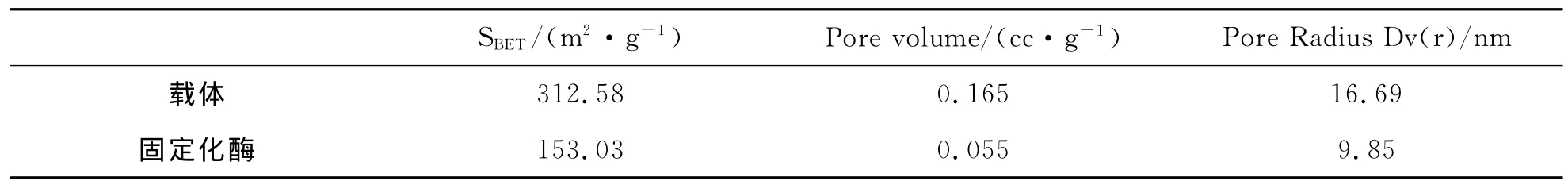
表1 样品的比表面积及孔径分析数据
3 结论
本文讨论了3种不同形貌的TiO2为载体固定化脂肪酶,对固定化效果更好的纳米线TiO2载体固定化脂肪酶做了进一步研究.通过单因素实验确定最佳条件,其中加酶量、pH、固定化时间的影响更为显著.采用响应面实验设计方法对加酶量、pH和固定化时间3个条件进行优化,得到最优的组合为加酶量0.25g、pH 7.0、固定化时间6.3h.在此条件下,脂肪酶的理论固载率为80.12%.研究了纳米二氧化钛固定脂肪酶的界面特性.采用SEM、XRD、FT-IR以及比表面积分析仪等进行表征,结果显示,在纳米线形貌的载体上存在脂肪酶的吸附.
[1]戴清源,朱秀灵.非水相中脂肪酶催化合成糖酯类食品添加剂的研究进展[J].安徽工程大学学报,2012,33(10):385-389.
[2]张开平,惠明,田青,等.微生物脂肪酶的应用领域及研究进展[J].河南工业大学学报,2012,33(1):90-94.
[3]K Manali,N G Munishwar.Lipase promiscuity and its biochemical applications[J].Process Biochemistry,2012,47:555-569.
[4]刘虹蕾,缪铭,江波,等.微生物脂肪酶的研究与应用[J].食品科技,2012,33(12):376-381.
[5]F J Contesini,D B Lopes,G A Macedo,et al.Aspergillus sp.Lipase:potential biocatalyst for industrial use[J].Journal of Molecular Catalysis B:Enzymatic,2010,67(3):163-171.
[6]李萌萌,杨天奎,牟英,等.脂肪酶固定化新技术[J].粮食与油脂,2012(11):1-4.
[7]隋颖.无机载体固定化脂肪酶及其催化制备生物柴油性能[D].济南:济南大学,2012.
[8]黄磊,程振民.无机材料在酶固定化中的应用[J].化工进展,2006,25(11):1215-1250.
[9]M S Sadjadi,N Farhadyar,K Zare.Improvement of the Alkaline Protease Properties via Immobilization on the TiO2Nanoparticles Supported by Mesoporous MCM-41[J].Superlattices Microstruct.,2009,46(1/2):77-83.
[10]S Q.Liu,A Chen.Adsorption of Horse Radish Peroxidase with Thionine on TiO2Nanotubes for Biosensing[J].Langmuir,2005,21(18):8 409-8 413.
[11]卢珊.介孔氧化硅仿生固定化酶的构筑及性能[D].北京:北京化工大学,2011.
[12]A Katiyar,N G Pinto.Visualization of size-selective protein separations on spherieal Mesoporous silieates[J].Small,2006,2(5):644-648.
[13]A Vinu,V Murugesan,M Hartmann.Adsorption of lysozyme over mesoporous molecular sieves MCM-41and SBA-15:Influence of pH and aluminum incorporation[J].J.Phys.Chem.B,2004,108:7 323-7 330.
[14]A Vinu,V Murugesan,Tangennanno,et al.Adsorption of eytochrome c on mesoporous molecular sieves:Infiuenee of PH,pore diameter,and aluminum ineorporation[J].Chem.Mater.,2004,16:3 056-3 065.
[15]L Gao,Q Gao,Q Wang,et al.Immobilization of herooglobin at the galleries of layered niobate HCa2Nb3O10[J].Biomater.,2005,26(26):526-527.
