两种含金刚烷基连接子的偶氮化合物的制备与表征
2014-02-28彭星星虞少波周文娟郑本陪高建纲
彭星星,虞少波,周文娟,董 菁,郑本陪,高建纲,3*
(1.安徽工程大学生物与化学工程学院,安徽芜湖 241000;2.芜湖市产品质量监督检验所,安徽芜湖 241000;3.安徽光电子科学与技术重点实验室,安徽合肥 230026)
偶氮化合物是一种分子结构中含有偶氮基团(-N=N-)的化合物,可分为脂肪族偶氮化合物和芳香族偶氮化合物两大类.1861年C.Mene[1]首次制备出第一个芳香族偶氮化合物苯胺黄至今,由于偶氮苯生色团具有独特的顺-反异构化性能,芳香族偶氮化合物在染料、彩色显示等方面的应用越来越广泛.人们将芳香族偶氮化合物引入聚合物体系中,催生了各种结构新颖、性质独特的偶氮聚合物和一系列新方法[2],使芳香族偶氮化合物在液晶材料、智能响应材料、光开关和光存储材料、纳米材料等领域的发展和应用日新月异[2-6].
近年来,超分子自组装的方法,可以更为灵活地制得超分子偶氮聚合物,并将其应用到光存储等领域,引起了人们的关注[7-8].在非共价键自组装制备超分子聚合物的研究中,金刚烷基团与β-环糊精具有良好的尺寸匹配和结合强度,被广泛作为一对具有高选择性的连接子来组装各种复杂的超分子聚合物[9-11].
有鉴于此,本文以对氨基苯腈、对硝基苯胺为主要原料,经重氮化-偶联、亲核取代及酰胺化反应制备了含金刚烷基连接子[12]的芳香族偶氮化合物,为后续通过超分子相互作用自组装制备侧链型超分子偶氮聚合物,并探讨其在光存储等领域的应用提供原料.
1 实验部分
1.1 实验药品和仪器
对氨基苯腈、对硝基苯胺、亚硝酸钠、苯酚、6-氯-1-己醇、1-金刚烷甲酰氯等均为分析纯试剂,购自国药集团化学试剂有限公司;UV-2550紫外-可见分光光度计(日本岛津公司);IRPrestige-21傅立叶变换红外光谱仪(日本岛津公司);AVANCE 300核磁共振波谱仪(瑞士Bruker公司).
1.2 偶氮化合物的合成
(1)含金刚烷基连接子的偶氮化合物的合成方案.以对氨基苯腈、对硝基苯胺为原料,通过多步反应合成金刚烷基偶氮化合物的合成路线如图1所示.
(2)对氰基金刚烷基偶氮化合物的合成.①4-[(4-羟基苯基)偶氮]苯腈(1a).将对氨基苯腈(5.91 g,0.05 mol)加入到100 mL盐酸(1.5 M)中配成悬浊液,在冰水浴中冷却至0℃.将亚硝酸钠(3.45 g,0.05 mol)溶于20 mL水中配成溶液,在搅拌下滴加到前述的悬浊液中,重氮化反应约30 min至悬浊液逐渐变澄清.用预冷的布氏漏斗抽滤除去少量悬浮物并将重氮盐的滤液倒回至冰水浴中.将苯酚(4.71 g,0.05 mol)和氢氧化钠(4.01 g,0.1 mol)溶于70 mL水中配成溶液,搅拌下逐滴加入重氮盐滤液中,浅黄色澄清透明的滤液很快变为红褐色悬浊液.用碳酸钠调节p H到5~6,继续搅拌4 h后抽滤.水洗后真空干燥,用乙醇重结晶得到10.12 g亮橙色晶体,产率为90%,熔点203~204℃.②4-[[4-[(6-羟基己氧基)苯基]偶氮]苯腈(2a).将6-氯-1-己醇(2.61 g,18.8 mmol),碳酸钾(2.63 g,18.8 mmol)和1a(4.0 g,18.8 mmol)溶于100 mL的DMF中,加入少量碘化钾作为催化剂在100℃下反应72 h.反应物冷却至室温后倒入水中得到橙色沉淀,抽滤收集固体并水洗多次;用乙醇进行重结晶得到固体4.67 g,产率为77%,熔点145~146℃.③6-[[4-[(4-氰基苯基)偶氮]苯氧基]己基-1-金刚烷甲酸酯(3a).将三乙胺(0.55 g,5.4 mmol)和2a(1.52 g,4.9 mmol)溶解于130 mL二氯甲烷中配成溶液,在冰水浴中冷却至0℃.将1-金刚烷甲酰氯(0.98 g,4.9 mmol)溶于20 mL的二氯甲烷中,搅拌下滴加到前述溶液中反应8 h.抽滤并旋干滤液,真空下干燥后用硅胶(H-60)色谱柱纯化,得到橙色晶体1.81 g,产率为78%,熔点107~108℃.
(3)对硝基金刚烷基偶氮化合物的合成.①4-[(4-硝基苯基)偶氮]苯酚(1b).将对硝基苯胺(6.91 g,0.05 mol)溶于100 mL盐酸(1.4 M)中配成悬浊液,后在冰水浴中冷却至0℃.将20 mL亚硝酸钠(3.45 g,0.05 mol)的水溶液在搅拌下逐滴加入,反应约30 min后悬浊液逐渐变澄清.将苯酚(4.71 g,0.05 mol)和氢氧化钠(4.01 g,0.1 mol)溶于70 mL水中配成溶液逐滴加入,原来浅黄色澄清透明的滤液很快变为褐色的悬浊液;用碳酸钠把反应体系的p H值调节到5~6继续搅拌4 h停止反应.将抽滤得到的固体水洗,并用乙醇重结晶得固体10.38 g,产率为85%,熔点219~220℃.②6-[[4-[(4-硝基苯基)偶氮]苯氧基]己基-1-醇(2b).将6-氯-1-己醇(2.62 g,18.8 mmol)、碳酸钾(2.63 g,18.8 mmol)和1b(4.25 g,18.8 mmol)溶于100 mL的DMF中,加入少量碘化钾作为催化剂在100℃下反应72 h.反应物冷却至室温后倒入水中沉淀.抽滤收集固体并水洗多次,用乙醇进行重结晶,得橙黄色晶体5.61 g,产率87%,熔点131~132℃.③6-[[4-[(4-硝基苯基)偶氮]苯氧基]己基-1-金刚烷甲酸酯(3b).将三乙胺(0.55 g,5.4 mmol)和2b(1.68 g,4.9 mmol)溶于130 mL二氯甲烷中配成溶液,在冰水浴中冷却至0℃;将1-金刚烷甲酰氯(0.98 g,4.9 mmol)的20 mL二氯甲烷溶液在搅拌下滴加到其中,继续反应8 h.抽滤,将滤液旋转蒸干后真空下干燥,最后用硅胶(H-60)色谱柱纯化,得橙黄色晶体2.01 g,产率81%,熔点93~94℃.
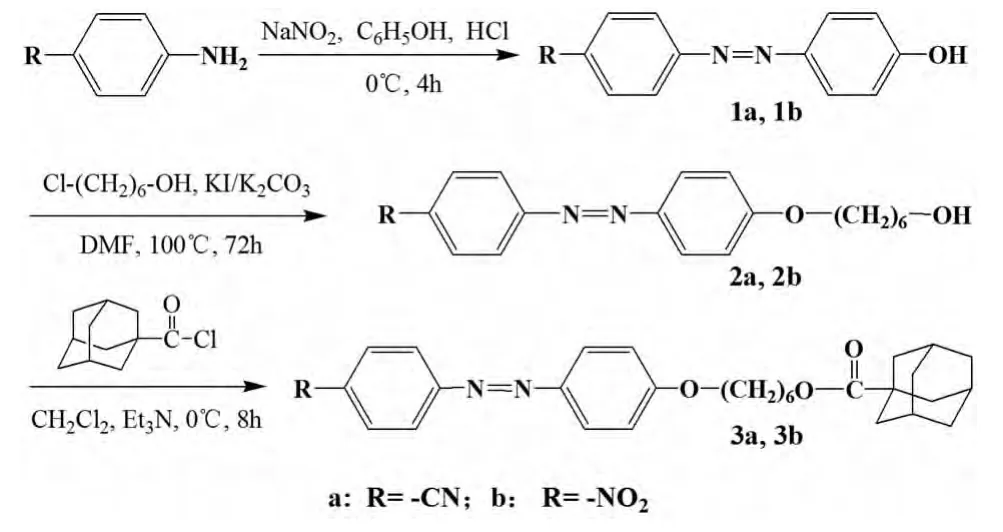
图1 含金刚烷基连接子的偶氮化合物的合成路线
2 结果与讨论
2.1 紫外-可见吸收光谱(UV-Vis)表征
以二氯甲烷为溶剂,测定了3a、3b的紫外-可见吸收光谱图如图2所示,并定量测定了其最大吸收波长(λmax)处的表观摩尔吸光系数εmax.从图2可知,3a、3b在紫外-可见光区最大吸收波长分别为365.0 nm和378.5 nm,分别对应于两种化合物的中偶氮苯反式构型发生的π-π*跃迁吸收.与偶氮苯在此处的吸收波长约为320 nm相比[2],两种金刚烷基偶氮化合物的反式构型π-π*跃迁的最大吸收波长分别发生了约45.0 nm、58.5 nm的明显红移,究其原因应为-CN和-NO2的吸电子效应使π电子的流动性增加甚至产生永久性转移.与此同时,两种化合物中偶氮苯对位的烷氧基给电子基团的存在有利于分子内电荷的吸收,因此产生了比较明显的红移.就吸电子能力比较而言-NO2强于-CN,因而3b的最大吸收波长大于3a.在3a、3b最大吸收波长处测定了各自的表观摩尔吸光系数εmax,其数值分别为47 560 L·mol-1·cm-1、29 480 L·mol-1·cm-1.
2.2 红外吸收光谱(FT-IR)表征
通过KBr压片法测定了两种含金刚烷基连接子的偶氮化合物及其中间体的傅里叶变换红外光谱图,分别分析如下.
(1)对氰基金刚烷基偶氮化合物的红外光谱表征.对氰基偶氮化合物1a~3a的红外吸收光谱图如图3所示.在1a谱图中,3 319 cm-1处的吸收峰为酚羟基的-O-H伸缩振动峰,2 241 cm-1处为氰基典型的-C≡N伸缩振动吸收,1 606 cm-1处则为-N=N-伸缩振动对应的强度较弱的吸收峰.1 587 cm-1、1 462 cm-1处的两个苯环骨架呼吸振动吸收峰说明存在苯环,1 281~1 138 cm-1的多个吸收峰对应于-C-N-、-C-C-、-C-O等单键的伸缩振动吸收类型.另外,1 000~650 cm-1之间只有849 cm-1一个吸收峰,证明结构中苯环的取代类型是对位1,4-二取代形式.由1a对应的红外光谱图可知,该中间体已成功制备.
与1a的谱图对比可以发现,在2a图中出现了2 933 cm-1、2 870 cm-1两个脂肪族-C-H的不对称和对称伸缩振动吸收峰,且在1 257 cm-1处出现了芳醚的-C-O-单键的伸缩振动、1 024 cm-1处出现了伯醇的-C-O-伸缩振动吸收峰,说明6-羟基己基与苯氧基相连形成了2a.
3a的谱图与前两者相比,在1 716 cm-1处出现了酯羰基>C=O双键的伸缩振动吸收峰,2a中原有的3 502 cm-1处醇羟基-O-H伸缩振动吸收峰完全消失,说明6-[[4-[(4-氰基苯基)偶氮]苯氧基]己基-1-金刚烷甲酸酯(3a)也已成功合成.
(2)对硝基金刚烷基偶氮化合物的红外光谱表征.对硝基金刚烷基偶氮化合物及中间体的红外光谱图如图4所示.与上述分析类似,1b谱图中3 416 cm-1、1 583 cm-1、1 136 cm-1等吸收峰分别对应酚羟基的-O-H伸缩、苯环的骨架振动和-C-O-伸缩振动吸收,856 cm-1处对应对位1,4-二取代苯环的结构.有别于氰基偶氮化合物的是,1b谱图中在2 200 cm-1左右没有吸收峰,且1 506 cm-1、1 338 cm-1处出现了较强的-NO2不对称、对称伸缩振动峰,可证明其结构的确是1b.将2b谱图与1b的对照,在2 930 cm-1、2 858 cm-1处多了两个脂肪族-C-H的不对称/对称伸缩振动吸收峰,1 256 cm-1处出现芳醚的-C-O-单键的伸缩振动,证实了2b的结构.与3a的分析类似,3b谱图中在1 720 cm-1处出现酯羰基的>C=O键伸缩振动,可以说明6-[[4-[(4-硝基苯基)偶氮]苯氧基]己基-1-金刚烷甲酸酯的合成是成功的.
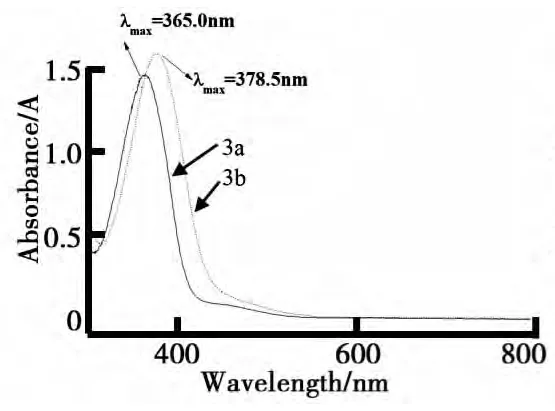
图2 两种含金刚烷基连接子的偶氮化合物3a、3b的紫外-可见吸收光谱

图3 含氰基偶氮化合物及中间体的红外光谱图
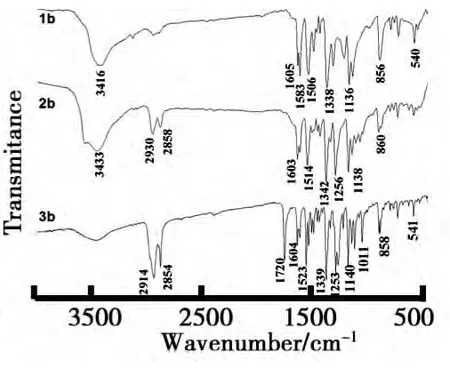
图4 含硝基偶氮化合物及中间体的红外光谱图
2.3 核磁共振氢谱(1 H-NMR)表征
对两种金刚烷基偶氮化合物3a、3b进行了核磁共振氢谱表征,结果如图5所示.溶剂为CDCl3,定标试剂为TMS,测定温度为298.15 K,结构表征如下.
对氰基金刚烷基偶氮化合物3a:δH/ppm=7.922-7.951(d,4 H,J=8.7,C6H4);7.773-7.801(d,2H,J=8.4,C6H2);6.997-7.026(d,2 H,J=8.7,C6H2);4.045-4.087(t,4H,J=6.3,CH2);1.445-2.001(m,23 H,CH2、CH).
对硝基金刚烷基偶氮化合物3b:δH/ppm=8.282-8.312(d,2 H,J=9.0,C6H2);7.909-7.929(d,2 H,J=6.0,C6H2);7.880-7.900(d,2H,J=6.0,C6H2);6.940-6.969(d,2 H,J=8.7,C6H2);3.982-4.024(t,4 H,J=6.3,CH2);1.184-1.935(m,23 H,CH2、CH).
根据谱图中各类质子核磁共振吸收峰不同的的化学位移、积分面积及裂分情况,可以确认成功合成了两种目标产物.

图5 两种偶氮金刚烷甲酸酯的1 HNMR谱图(CDCl3,298.15 K)
3 结论
本研究设计并经多步反应合成了两种含金刚烷基连接子的芳香族偶氮化合物,二者的紫外可见吸收最大吸收波长分别为365.0 nm和378.5 nm,其表观摩尔吸光系数分别为47 560 L·mol-1·cm-1、29 480 L·mol-1·cm-1.通过熔点测定、红外吸收光谱、核磁共振氢谱对目标化合物进行了表征,并确认得到了预期的结构,为进一步利用金刚烷基与含β-环糊精的聚合物骨架进行自组装制备侧链型超分子偶氮聚合物奠定了基础.
[1] Zollinger H.Color Chemistry,symthesis,properties and applications of organic dyes and pigments[M].Weinheim:VCH Verlagsgesellschaft,1987.
[2] Natansohn A,Rochon P.Photoinduced motions in azo-containing polymers[J].Chem.Rev.,2002,102,(11):4 139-4 175.
[3] Zhao Y,Ikeda T.Smart Light-responsive materials:azobenzene-containing polymers and liquid crystals[M].New Jersey:John Wiley &Sons,Inc.,2009.
[4] Yu Y L,Nakano M,Ikeda T.Photomechanics:Directed bending of a polymer film by light[J].Nature.,2003,425:145.
[5] Jaume G A,Dolores V.Recent advances towards azobenzene-based light-driven real-time information-transmitting materials[J].Beilstein J.Org.Chem.,2012,8:1 003-1 017.
[6] Yu Y L,Ikeda T.Photodeformable polymers:a new kind of promising smart material for micro-and nano-applications[J].Macromol.Chem.Phys.,2005,206(17):1 705-1 708.
[7] Gao J,He Y N,Liu F,et al.Azobenzene-containing supramolecular side-chain polymer films for laser-induced surface relief gratings[J].Chem.Mater.,2007,19(16):3 877-3 881.
[8] Wu S,Duan S Y,Lei Z Y,et al.Supramolecular bisazopolymers exhibiting enhanced photoinduced birefringence and enhanced stability of birefringence for four-dimensional optical recording[J].J.Mater.Chem.,2010,20:5 202-5 209.
[9] Kretschmann O,Choi S W,Miyauchi M,et al.Switchable hydrogels obtained by supramolecular cross-linking of adamantyl-containing LCST copolymers with cyclodextrin dimers[J].Angew.Chem.Int.Ed.,2006,45(26):4 361-4 365.
[10]Kuad P,Miyawaki A,Takashima Y,et al.External stimulus-responsive supramolecular structures formed by a stilbene cyclodextrin dimer[J].J.Am.Chem.Soc.,2007,129(42):12 630-12 631.
[11]Nguyen H T,Pham D T,Lincoln S F,et al.Host-guest chemistry of linkedβ-cyclodextrin trimers and adamantyl substituted poly(acrylate)s in aqueous solution[J].Polym.Chem.,2013,4:820-829.
[12]袁金颖,闫强.运用连接子化学合成特定结构功能聚合物[J].高分子通报,2011,4:55-67.
