超纯水对溶剂合成纳米TiO2粒径的调控及其表征
2014-09-22陶玉贵刘任龙石贝杰
张 健,陶玉贵,刘任龙,郑 洁,雷 蕾,石贝杰
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
1972年Fujishima[1]在Nature上首次发表了TiO2光催化分解水制氢的论文,纳米TiO2逐渐成为研究的重点和热点[2].作为纳米TiO2的合成方法之一,溶剂热法相对简单且易于控制,引起了研究者们广泛的关注[3-5].目前,在纳米TiO2合成的调控过程中,反应体系中往往添加螯合剂、胶化剂、表面活性剂等化学物质[6-8].然而,这些化学物质不仅结构复杂,且反应体制系中反应物种类的增加也会使反应过程更趋向复杂化.因此,采用相对简单的方法和反应体系来合成性能良好的产品就显得十分必要.而水作为清洁易得的资源,对于纳米TiO2的合成至关重要,已有文献[9]报道利用水来调节纳米尺寸.
本文以TBOT为钛源,在冰醋酸体系中通过改变溶剂中超纯水的添加量来控制纳米TiO2的粒径,获得了分散性良好、比表面积较大且表现出介孔性质的锐钛矿型纳米TiO2单晶颗粒.并通过EDS、XRD、FT-IR和N2吸附-脱附实验对其性质进行研究.
1 实验部分
1.1 实验药品
钛酸正四丁酯(TBOT),化学纯(国药集团化学试剂有限公司);冰醋酸,分析纯(国药集团化学试剂有限公司);甘氨酸,分析纯(国药集团化学试剂有限公司);无水乙醇,分析纯(国药集团化学试剂有限公司);超纯水(电导率小于0.2μs/cm),实验室自制;商业P25粉末,分析纯(上海凌峰化学试剂有限公司).
1.2 合成方法
未加水体系中样品的制备:准确称取0.45g甘氨酸溶于30mL冰醋酸中,在磁力搅拌条件下逐滴加入2mL TBOT,搅拌30min后转入聚四氟乙烯内衬的高压反应釜内,在200℃干燥箱中反应24h,自然冷却至室温.将得到的样品用无水乙醇和超纯水交替离心洗涤多次得到沉淀物,60℃下干燥,转入马弗炉中400℃煅烧2h,自然冷却,得到纳米TiO2.加水体系中样品的制备:在上述反应体系中分别添加1.0mL、1.5mL、2.0mL、2.5mL、3.0mL、3.5mL、4.0mL、4.5mL、5.0mL超纯水,其他条件不变.
1.3 表征
采用日本日立S-4800扫描电子显微镜(SEM)研究样品的形貌;样品的能谱分析(EDS)在英国牛津7593-H型X射线能谱仪上进行;样品X射线衍射(XRD)表征在德国Bruker D8Advance型X射线衍射仪上进行,采用连续扫描方式,X射线为单色的Cu-Kα辐射线,扫描范围2θ=10°~80°;采用日本岛津IRPrestige-21傅立叶变换红外光谱仪研究样品中基团的变化;通过美国康塔NOVA 2000e比表面积及孔径分析仪测试样品的N2等温吸附-脱附曲线和孔径分布曲线.
2 结果与讨论
2.1 超纯水添加量对纳米TiO2微球粒径的影响
为了研究超纯水对粒径的影响,采用SEM对制备的TiO2进行表征.未加水反应体系制得样品的SEM图如图1所示.由图1可以看出,制备的TiO2呈现完整球形,分散性较好,颗粒大小约为100nm,表面存在明显的孔径结构,并附着更小的纳米微粒.猜测其反应过程是冰醋酸体系中更小的纳米单元先生成并分散于体系中,随着时间的延长,一大部分纳米单元在反应釜的高温高压条件下逐步聚集成大的纳米球体,而另外没有聚集成大颗粒的纳米单元则附着于这些大颗粒之上,形成如图1所示的纳米结构.

图1 样品的SEM图
为了有效地控制纳米TiO2颗粒尺寸大小,在反应体系中添加了一定量的水.而为了去除水中金属离子对TiO2纳米粒子形成的干扰,对蒸馏水进行纯化制得超纯水(电导率小于0.2μs/cm)再添加到反应体系中进行研究.依次添加1.0mL、1.5mL、2.0mL、2.5mL、3.0mL、3.5mL、4.0mL、4.5mL、5.0mL超纯水时制得TiO2的SEM图如图2所示.由图2可知,添加1.0mL超纯水时,体系中不能形成具有明显特征的形貌,在生成纳米颗粒的同时还有一部分片状结构存在,且其硬团聚较为严重;添加1.5mL超纯水时,单个小颗粒开始生成,大小约为40nm,但其硬团聚仍然较为严重,且粒度分布不均匀;添加2.0mL超纯水时,生成的颗粒分散程度开始改善,颗粒大小开始趋向均匀,约为30nm;依次添加2.5mL、3.0mL超纯水时,生成的纳米颗粒得到了较好的分散性和均一性,分别达到25nm和15nm左右;当体系中超纯水的添加量达到3.5mL时,其尺寸进一步减小,最小粒径小于10nm;依次增加超纯水的体积为4.0mL、4.5mL时,虽然颗粒尺寸有所减小,但是其分散性开始逐步变差,硬团聚比3.5mL超纯水添加量时制得的TiO2要严重;当超纯水的添加量增加到5.0mL时,由于大量水参与到反应中,TBOT的过快水解使得样品坍塌,电镜下已经无法分辨出明显的形貌特征.
由图2SEM表征结果可知,冰醋酸反应体系中添加的超纯水能够明显控制TBOT的反应过程,进而控制TiO2的生成,而超纯水添加量的多少则能有效调控合成的TiO2尺寸大小.随着超纯水添加量的增多,纳米TiO2颗粒尺寸呈现逐渐减小的趋势,但添加量增大到一定程度又会使得反应体系中TBOT水解速率难以控制而得不到理想的颗粒.当超纯水添加量为3.5mL时,制得的TiO2颗粒分散良好,且均一性更好,最小粒径小于10nm.因此,后续将以此为研究对象进行表征,并将其与商业P25粉末进行比较.
2.2 实验制备纳米TiO2的表征
(1)能谱分析.为了研究纳米TiO2的物相组成等,采用EDS对实验制得的TiO2和P25进行表征,如图3所示.由图3b、图3dEDS数据结果可知,P25的Ti∶O原子百分比为1∶3.73,而制备得到的TiO2的Ti∶O原子百分比为1∶1.89,更加接近1∶2的物相组成,这可能是由于P25相较于实验制得TiO2物理吸附的水较多造成的.

图2 不同超纯水添加量样品的SEM图

图3 样品的EDS图谱及结果
(2)XRD表征.在EDS表征的基础上,采用XRD对TiO2样品进一步表征,如图4所示.由图4b可知,在2θ为25.3°左右,样品XRD图谱出现狭窄而尖锐的(101)晶面衍射峰,表明样品为锐钛矿型TiO2晶体.2θ为37.9°、48.25°、54.01°、55.25°、62.61°和75.04°时的衍射峰分别对应锐钛型 TiO2的(004)、(200)、(105)、(211)、(204)和(215)晶面,且图4b没有出现板钛矿或金红石型的特征峰,这说明制得的TiO2为纯净的单晶锐钛矿型.从图4a商业P25的XRD图谱可知,其在2θ为25.3°和27.48°出现的衍射峰分别对应锐钛矿型和金红石型TiO2的(101)、(110)晶面,表明P25为钛矿型和金红石型TiO2的混合晶体.另外,对比图4a和4b可知,煅烧后TiO2衍射峰强度比P25明显要大,表明制得的TiO2晶化程度相对P25较高.从图4b、图4c可知,样品经200℃冰醋酸溶液反应24h即形成锐钛矿型,400℃煅烧并未促使晶型转变,而是高温使得各晶面的衍射峰强度增大,亦即TiO2晶体晶化程度升高.发生此种变化的原因在于,高温提供Ti-O-H键断裂需要的能量而重新键合成Ti-O-Ti键[10].对比图4b和图4c可知,两者衍射峰型极其相似,两者最大的区别在70°左右,未煅烧的TiO2曲线平缓,而高温处理过的TiO2出现两个微弱的衍射峰.不同超纯水添加量制备纳米TiO2的XRD图谱如图5所示.由图5可知,不同超纯水添加量制备的纳米TiO2其曲线大致相同,其差异仅表现在衍射峰强度的不同和曲线的平缓程度上.过多的超纯水会使得TBOT水解过快而出现材料的坍塌,但依然不会促使混晶的出现,均为纯净的锐钛矿型.结合SEM表征结果,说明反应体系中的超纯水及其添加量不会促使晶体结构的改变,而是可以有效调控纳米TiO2的尺寸.
(3)FT-IR表征.纳米TiO2样品与P25的FT-IR表征如图6所示.由图6b可以看出,P25在500~900cm-1处有一个宽而平缓的吸收带,这是典型的Ti-O键吸收峰[11],而实验制得TiO2在此处则出现了单一的尖锐的吸收峰.图6a中在3 450cm-1处还出现了羟基(-OH)的伸缩振动峰,图6b中此处的吸收峰则不明显.结合前文的能谱分析,猜测出现这一明显差别的原因,可能是由于溶剂热法仿生合成使得其Ti∶O原子百分比更接近于1∶2所致.
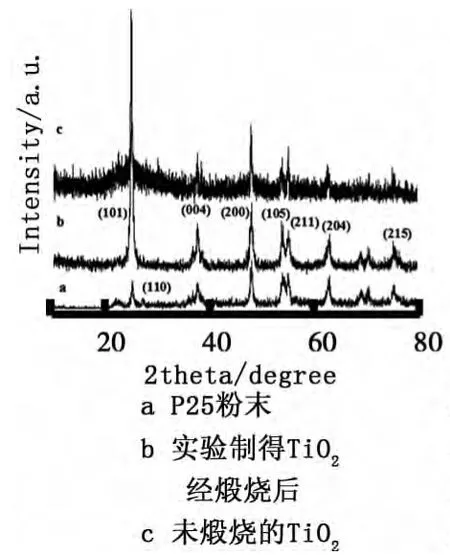
图4 样品的XRD图谱

图5 不同超纯水添加量制得样品的XRD图谱

图6 样品的FT-TR图
(4)比表面积及孔径分析.为研究样品的结构及性质,通过N2吸附-脱附实验对实验制得TiO2进行比表面积及孔径分析,通过BET和BJH公式计算样品的比表面积及孔径,并与商业P25粉末的性质对比.实验制得TiO2的N2吸附-脱附等温线图(见图7a).由于胞涨作用使得材料坍塌造成曲线在相对压力(P/P0)为0~0.6附近出现明显的分开而非闭合,而P25粉末也表现出相同的性质(见图7c).在P/P0为0.7处存在明显的拐点,在P/P0较高处出现毛细凝聚现象,呈现H1型迟滞环,吸附曲线表现为典型的V类曲线.当P/P0接近1时,存在的毛细管和孔凝现象,表明实验制得TiO2孔径分布相对较窄且尺寸较均匀,呈现固态介孔材料特征[12].而由图7c可知,P25的吸附-脱附等温线在P/P0为0.7附近则出现H3型迟滞环,在较高相对压力区域没有表现出任何吸附限制,为Ⅳ型吸附曲线,表现出缝形孔材料的性质.
实验制得TiO2和P25的孔径分布图如图7b、图7d所示,均呈现明显的正态分布.从图7b可知,实验制得TiO2的孔径分布在16~374nm,通过BJH公式计算其孔径在37.087nm,占比最多,并呈现介孔性质,这与吸附-脱附曲线一致.从图7d可知,P25的平均孔径为18.506nm.而实验制得的TiO2和商业P25粉末本身并没有孔,TiO2的平均孔径比P25要大,其表现的介孔性质则为材料的间隙孔,进而说明实验制得TiO2具有更好的分散性.实验制得TiO2和P25的比表面积及孔径分析数据由表1所示.由表1可知,P25的比表面积为74.368m2/g,而TiO2的比表面积则达到109.444m2/g,具有明显优势,对于后续利用TiO2吸附生物大分子的研究具有重要意义.对于孔容,TiO2和P25分别为(0.198cc/g和0.088cc/g)与孔径呈现一致性.

图7 样品的N2吸附-脱附

表1 样品的比表面积及孔径分析结果
3 结论
采用溶剂热法仿生合成TiO2纳米粒子,通过控制反应体系中水添加量实现对纳米TiO2粒径的有效调控,并使用超纯水以去除杂质对纳米形成的干扰,方法简单易行.SEM表征表明,反应体系中超纯水的最佳添加量为3.5mL,此时制得的TiO2最小粒径可达10nm以下,并获得较好的分散性和均一度.EDS表征表明,制备的纳米样品Ti∶O原子百分比为1∶1.89,接近于1∶2.XRD和FT-IR分析表明,样品为纯净的锐钛矿型单晶.比表面积及孔径分析表明,制备的纳米TiO2具有较高的比表面积,达到109.444m2/g,数倍于P25粉末.实验通过控制超纯水的添加量调控纳米TiO2粒径获得小于10nm的颗粒,其较高的比表面积使其具备较为广阔的应用前景.
[1]Fujishima A,Honda K.Electrochemical photolysis of water at a semiconductor electrode[J].Nature,1972,238(5358):37-38.
[2]Valtchev V,Tosheva L.Porous Nanosized Particles:Preparation,Properties,and Applications[J].Chemical reviews,2013,113(8):6 734-6 760.
[3]Liu J,Dong M,Zuo S,et al.Solvothermal preparation of TiO2/montmorillonite and photocatalytic activity[J].Applied Clay Science,2009,43(2):156-159.
[4]Zhang Z,Wang Y,Tan Q,et al.Facile solvothermal synthesis of mesoporous manganese ferrite(MnFe2O4)microspheres as anode materials for lithium-ion batteries[J].Journal of colloid and interface science,2013,398:185-192.
[5]Sun H,Jiao X,Wang H,et al.Solvothermal preparation of Pd nanostructures under nitrogen and air atmospheres and electrocatalytic activities for the oxidation of methanol[J].ACS applied materials &interfaces,2011,3(7):2 425-2 430.
[6]卢帆,陈敏.溶胶-凝胶法制备粒径可控纳米二氧化钛[J].复旦学报:自然科学版,2010,49(5):592-597.
[7]兰章,吴季怀,林建明,等.水热法可控合成二氧化钛纳米晶及其在染料敏化太阳能电池中的应用[J].中国科学:化学,2012,42(7):1 029-1 034.
[8]Li J,Wang L,Kong X,et al.A simple and efficient method using polymer dispersion to prepare controllable nanoporous TiO2anodes for dye-sensitized solar cells[J].Langmuir:the ACS journal of surfaces and colloids,2009,25(18):1 1162-1 1167.
[9]Rui Y,Li Y,Zhang Q,et al.Size-tunable TiO2nanorod microspheres synthesised via a one-pot solvothermal method and used as the scattering layer for dye-sensitized solar cells[J].Nanoscale,2013,5(24):12 574-12 581.
[10]曹宁,陶玉贵,周朋,等.两步法仿生合成 TiO2纳米及其表征[J].安徽工程大学学报:自然科学版,2012,27(4):8-11,20.
[11]林华香,王绪绪,付贤智.TiO2表面羟基及其性质[J].化学进展,2007,19(5):665-670.
[12]曹水良,周天祥,莫珊珊,等.介孔炭负载二氧化锰复合材料电化学的性能[J].暨南大学学报:自然科学与医学版,2011,32(1):57-60.
