沉积物中六氯苯对摇蚊幼虫的慢性毒性效应
2014-09-21刘丽钟文珏祝凌燕
刘丽,钟文珏,祝凌燕
南开大学环境科学与工程学院 环境污染过程与基准教育部重点实验室 天津市生态环境修复与防治重点实验室,天津300071
沉积物中六氯苯对摇蚊幼虫的慢性毒性效应
刘丽,钟文珏,祝凌燕*
南开大学环境科学与工程学院 环境污染过程与基准教育部重点实验室 天津市生态环境修复与防治重点实验室,天津300071
以淡水底栖动物花翅羽摇蚊(Chironomus kiiensis)幼虫为受试生物,研究了沉积物中六氯苯(HCB)对其28 d的慢性毒性效应,观察摇蚊幼虫的存活情况和活动行为,以死亡率、羽化率和羽化时间为受试终点,计算28 d试验后沉积物中HCB对摇蚊的半数致死浓度(lethal concentration 50, LC50)以及50%羽化时间(50% emergence time, EmT50)。结果表明,HCB对摇蚊28 d的LC50为59.8 mg·kg-1,对摇蚊羽化率的半数效应浓度(half maximal effective concentration, EC50)为59.8 mg·kg-1。与大多数污染物不同,HCB有促进摇蚊幼虫筑巢行为和羽化的作用,随着HCB染毒浓度升高,摇蚊幼虫筑巢行为加强,EmT50缩短。暴露于高浓度HCB(>21.6 mg·kg-1)时,摇蚊的EmT50与对照相比明显缩短,尤其对雄性摇蚊影响更大。但与对照相比,HCB对羽化摇蚊的性别比没有很大影响。
六氯苯;花翅羽摇蚊;沉积物;慢性毒性;羽化率;羽化时间;筑巢
六氯苯(hexachlorobenzene, HCB)是斯德哥尔摩公约首批控制的12种持久性有机污染物(persistent organic pollutants, POPs)之一[1-2]。HCB是一种选择性的有机氯抗真菌剂,易导致生物体内分泌紊乱,生殖及免疫机能失调,神经行为和发育紊乱等,属于典型的内分泌干扰物[3]。研究报道,人类由于意外或职业暴露长期接触HCB时,会表现出明显的疾病症状甚至是传染病症状,例如卟啉症等[4]。因此,许多国家于25年前限制或禁止生产HCB和其他活性较高的有机氯农药的中间产物或终产物[4]。然而由于HCB具有持久性和难降解性,并且HCB仍可能会掺杂在农药中或在一些化学过程中作为副产物产生,而被非故意排放到环境中[6-8]。因此,HCB仍广泛分布在环境中。HCB具有较高的辛醇/水分配系数(logKow=5.2),进入水体后极易吸附到沉积物中并长期存在,蓄积其中的HCB可能对栖息于沉积物中的生物产生不良影响。目前关于HCB毒性研究主要集中在高等动物以及啮齿类动物等上[9-11],对环境中底栖生物尤其是淡水底栖生物毒性效应研究较少。研究沉积物中HCB对底栖生物的毒性效应,对于推导其沉积物质量基准和进行沉积物生态风险评价具有重要意义。本文主要目的是研究沉积物中HCB对淡水底栖动物花翅羽摇蚊的慢性毒性作用,为淡水沉积物质量基准制定提供基础数据。
花翅羽摇蚊(Chironomus kiiensis),属于摇蚊科、双翅目长角亚目(Diptera: Nematocera)。摇蚊科的幼虫生物量约占底栖生物量的70%~80%[12-13],是种类多、分布广、生物量大的淡水底栖动物类群之一[14]。摇蚊不同种属之间的生态要求和生活习性多种多样,对环境因子的敏感性使得它们成为水环境监测的优良指示生物[15-16]。摇蚊是一类变态昆虫,整个生命周期经历卵、幼虫、蛹及成虫4个阶段。幼虫阶段在其生活史中时间最长,占据整个生命周期的90%。幼虫在成蛹前经历3次蜕皮,共4个龄期,此阶段主要在水体沉积物中完成,与沉积物直接接触时间较长,所以摇蚊幼虫是底栖动物的代表性生物之一,可以用于检测沉积物及化学品的生物毒性,也是美国国家环境保护局(USEPA)和欧盟推荐的生物毒性测试物种。故本文选取摇蚊幼虫(花翅羽摇蚊)为受试生物。
1 材料与方法(Materials and methods)
1.1 供试材料
1.1.1 沉积物
由于在天津自然保护区等地难以获得大批量背景值较低的沉积物,因此本文采用背景值较低的表层土,自然风干后剔除较大砾石、木屑等杂物,过40目筛,室温下保存。所选用土壤理化性质与沉积物接近,Pasteris等[17]也曾尝试用表层土作为沉积物用于生物暴露试验,泥水平衡后完全可以模拟沉积物环境。经测定所用沉积物(S)的理化性质如下:颜色为黄褐色,pH为7.86,阳离子交换量为38.47 cmol·kg-1,有机质的质量分数(foc)为1.9%,机械组成(质量分数)为粉砂64%、粘土24%、沙子12%。
1.1.2 化学试剂
HCB( ≥ 95%)购自北京化工厂,HCB标准品( ≥ 98%)购自百灵威科技有限公司,丙酮(分析纯)、正己烷(色谱纯)、二氯甲烷(色谱纯)均购自天津康科德科技有限公司。
1.2 沉积物中HCB含量测定
取8 g(湿重,3个平行样)HCB染毒沉积物,冷冻干燥、研磨、过筛、称量后,采用正己烷和丙酮混合溶剂(体积比1∶1)作为提取液,超声萃取60 min。过0.45 μm有机相膜,转移至1.5 mL进样瓶中,进行仪器分析。
分析仪器采用Agilent 7890A型气相色谱仪。载气为高纯氮气(纯度>99.999%),流速为2.0 mL·min-1,μ-电子捕获检测器。分离用HP-5毛细管柱(30 m×0.32 mm×0.25 μm),升温程序:柱初温60 ℃,恒温2 min后以20 ℃·min-1的速率程序升温至260 ℃,恒温2 min;进样口和检测器温度分别为230 ℃和300 ℃,进样量1 μL。仪器检测限为20 ng·L-1,方法检测限为4.0 μg·L-1。定量方法采用外标法。目标化合物加标回收率为97%~115%。
1.3 染毒试验
1.3.1 染毒沉积物制备
根据其他学者对环境中HCB含量检测分析[2]以及预试验结果,将沉积物HCB染毒浓度设定为5.00、10.0、20.0、40.0、80.0、120 mg·kg-1(以干重计)。将0.02 g HCB溶于20 mL二氯甲烷溶液中,作为储备液待用。取不同量储备液分别加入到一份干净的干沉积物中(总重量为100 g,每次取约1/10),搅拌均匀,置于通风橱内。待二氯甲烷完全挥发后(1~2 d),取一份洁净沉积物与之混合,搅拌均匀。重复此过程,直至所有的干净沉积物都混合均匀,加100 mL曝气水并搅拌均匀,形成不同浓度的HCB染毒沉积物(如表1)。静置2周,使泥水平衡。同时设置完全空白(只有相同量的洁净沉积物)和试剂空白(沉积物中只加相同量的二氯甲烷)对照组。将每个含不同HCB浓度的染毒沉积物均分为5份(每个平行样中含约20 g干沉积物)并分别置于100 mL玻璃烧杯中。
沉积物中有机质的质量分数为1.9%(测定采用重铬酸钾-还原容量法)[18]。为了确定染毒沉积物中HCB的实际浓度,利用1.2节所述方法分析测定了沉积物中的HCB含量,具体测定值见表1。洁净沉积物中HCB的背景值为36.3×10-3mg·kg-1,远低于试验染毒浓度。
1.3.2 摇蚊幼虫毒性试验 花翅羽摇蚊取自沈阳化工研究院安全评价中心,摇蚊幼虫在实验室驯养于干净水体中。用微型曝气泵连续曝气,水体pH (7.5±0.3),采用自然光照(16 h光照,8 h黑暗),温度(23±1) ℃。试验选用二龄摇蚊幼虫(卵孵化后10 d左右,体长约为0.5 cm)。 28 d毒性试验根据OECD 218指导规则进行[19],随机取10条二龄摇蚊幼虫于HCB染毒沉积物中进行毒性试验。摇蚊幼虫引入后曝气暂停6 h,使摇蚊幼虫能稳定待在沉积物中。将摇蚊食物(100%增色之素)用去离子水稀释成食物溶液(约10 mg·mL-1),每周喂食2次(每次约1 mL),每条摇蚊幼虫平均每天喂食0.25 mg。试验开始1周后将烧杯口用纱布罩住,每天定期观察,记录摇蚊活动行为、死亡和羽化情况。当有羽化蚊子出现时,将蚊子移出并分辨其性别。试验中保证温度、pH值、上覆水硬度等参数以及喂食次数与驯养期间一致。28 d试验结束后,沉积物过筛,记录存活幼虫数量,并计算其存活率、羽化率和50%羽化时间(EmT50),概率回归法计算HCB对摇蚊28 d试验的半数致死浓度(LC50)和对羽化率的半数效应浓度(EC50)。
2 结果与讨论(Results and discussions)
对完全空白和试剂空白结果进行t-检验(p<0.05),结果表明完全空白和试剂空白之间无显著性差异,在以下分析中均用试剂空白为对照组。
2.1 HCB对摇蚊幼虫死亡率和羽化率的影响
慢性试验中摇蚊幼虫存活率为发生羽化的摇蚊数量与试验结束后沉积物中存活的幼虫数量之和。28 d试验结束后,在完全空白组、试剂空白组和HCB处理组的沉积物中均没有发现存活的摇蚊幼虫,说明存活的摇蚊幼虫都羽化为蚊子,所以摇蚊存活率等于其羽化率。试剂空白摇蚊存活率为83.3%(±7.07%),由图1可以看出,随着HCB浓度增高,摇蚊幼虫的平均存活率和羽化率降低。根据摇蚊平均存活率和羽化率,计算HCB对摇蚊28 d试验后的LC50值为59.8 mg·kg-1(95%置信区间为[27.6,83.5]),HCB对摇蚊羽化率的EC50为59.8 mg·kg-1(95%置信区间为[27.6, 83.5])。
试验过程中观察到,摇蚊幼虫在蛹期即将羽化为蚊子时容易发生死亡,有的甚至羽化至一半时死亡。当HCB浓度为46.4、72.7和121 mg·kg-1时,摇蚊幼虫在蛹期即将羽化或正在羽化时的死亡率分别为16.7%、36.7%和40.0%(见图2)。同时还发现,高浓度HCB染毒组(72.7和121 mg·kg-1),与空白对照组以及低浓度HCB染毒组相比,羽化蚊子的身体和翅膀都较软,飞行无力。试验过程中存活的摇蚊都成功羽化为蚊子,但是高浓度HCB(72.7和121 mg·kg-1)对蛹期摇蚊致死作用较明显。HCB属于内分泌干扰物,作者推测其可能会干扰蛹期摇蚊幼虫的某种激素分泌,最终干扰其羽化。

表1 沉积物试验染毒浓度和实际测定浓度Table 1 The nominal and actual concentrations of the studied sediments
注:实际测定浓度值为3个平行的平均值±标准偏差。
Note:The actual concentration is the mean value ± standard deviation of 3 parallels
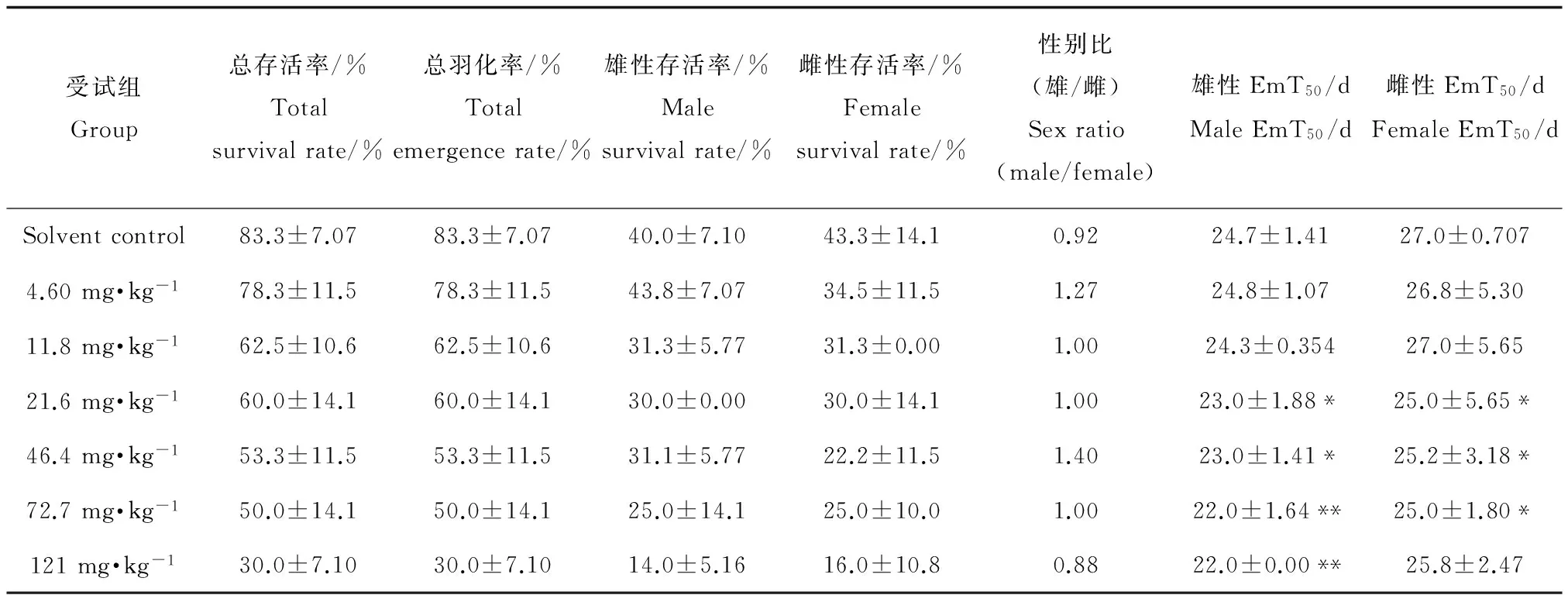
表2 沉积物中HCB对摇蚊存活率、羽化率及50%羽化时间(EmT50)的影响Table 2 Effect of HCB in sediments on survival rate, emergence rate and (EmT50) of C. kiiensis
注:每个浓度组5个平行,表中数值为平均值±标准偏差,*p<0.05,**p<0.01。
Note: Every group has 5 parallels and values in the table are mean value ± standard deviation, *p<0.05,**p<0.01.
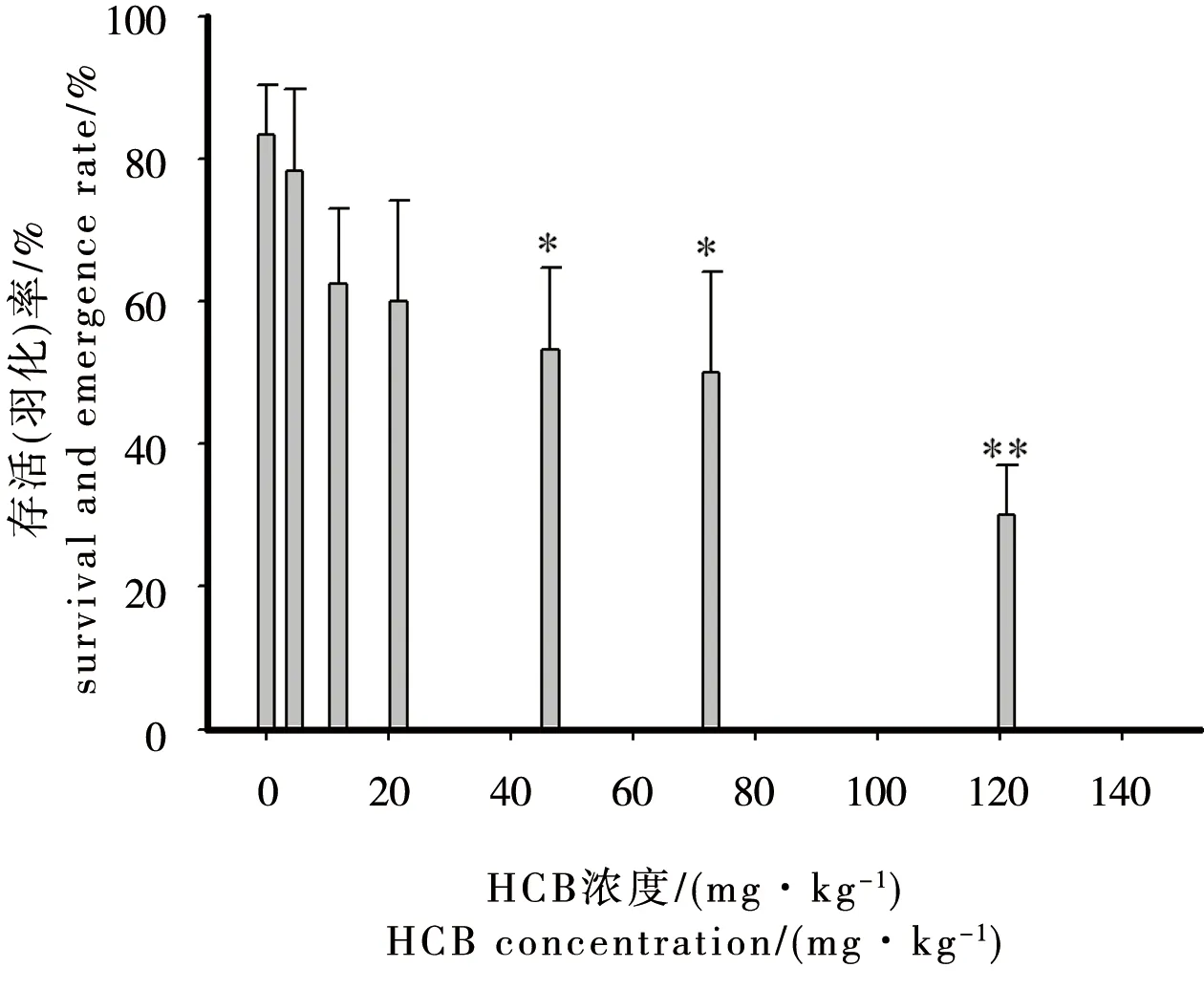
图1 沉积物中六氯苯(HCB)对摇蚊存活率和羽化率的影响注:0 mg·kg-1组为试剂空白,*p<0.05,**p<0.01。Fig. 1 Influence of hexachlorobenzene (HCB) in sediments on survival and emergence rate of Chironomus kiiensisNote: 0 mg·kg-1 group is solvent control; *p<0.05, **p<0.01.
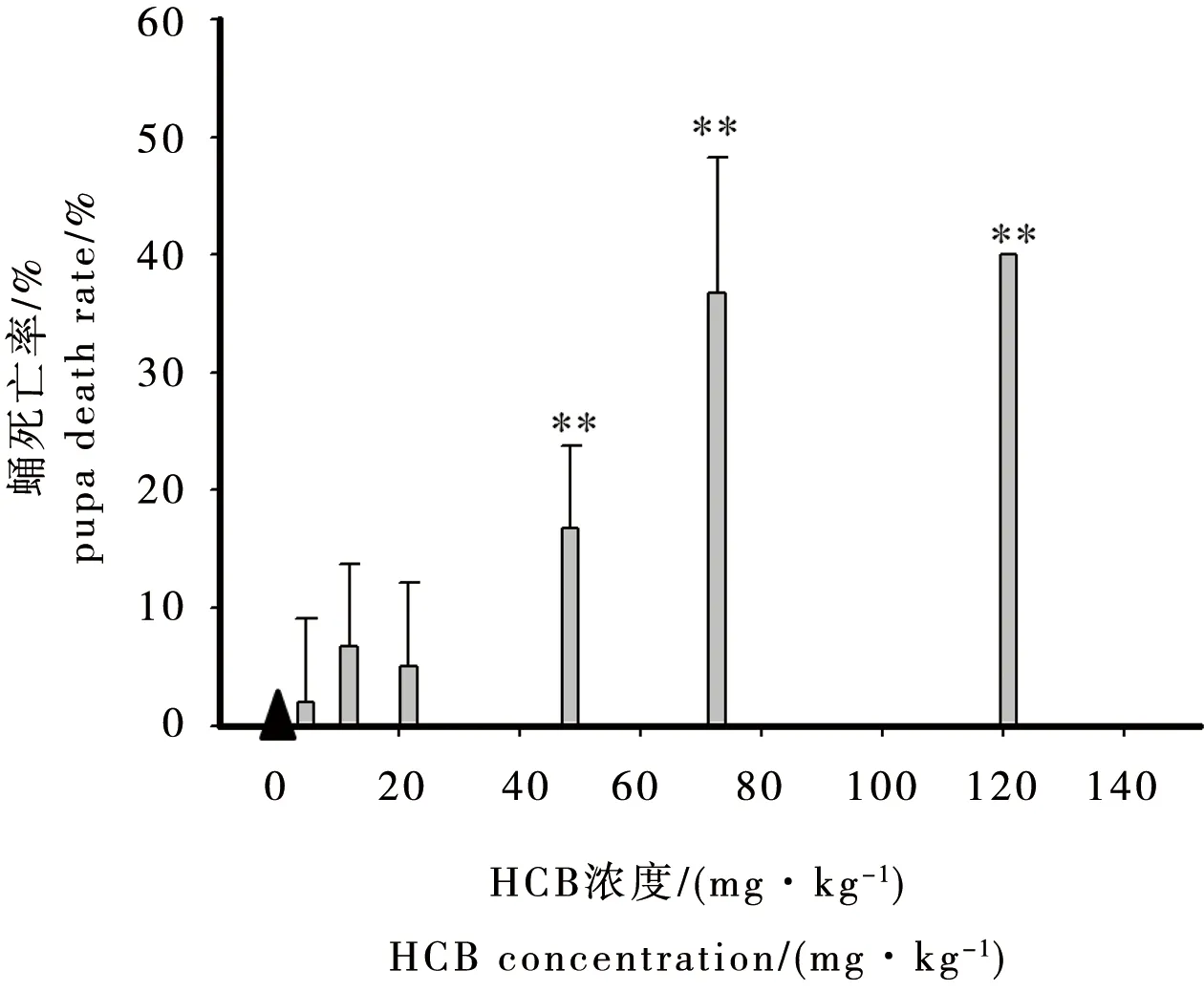
图2 沉积物中HCB对蛹期摇蚊死亡率影响注:▲无蛹死亡,**p<0.01。Fig. 2 Effect of HCB in sediments on mortality of C. kiiensis pupaNote: ▲no pupa mortality, **p<0.01.
2.2 HCB对摇蚊活动行为的影响
大多数摇蚊都有建巢的习性,幼虫筑巢营定居生活。巢是利用唾液腺分泌物(多为丝状物)将前原足收集来的植物碎片、微细的淤泥或砂粒粘合起来而建成的。巢多筑在沉积物表面或埋于淤泥中。摇蚊幼虫在巢中生活,筑巢的幼虫从巢中伸出头来摄取食物,随着摇蚊幼虫体长增长,所筑的巢也会增长。
比较不同处理组中摇蚊幼虫在沉积物表面的筑巢数量发现,沉积物中HCB染毒浓度为21.6、46.4和72.7 mg·kg-1时,摇蚊幼虫筑巢行为较试剂空白(图3K)明显加快(见图3),说明HCB对摇蚊的筑巢行为有促进作用。目前研究中发现多数污染物对摇蚊幼虫的筑巢行为有抑制作用,Macdonald等[20]发现全氟辛烷磺酸(PFOS)对摇蚊幼虫(Chironomus tentans)筑巢行为有明显的抑制作用,并且发现摇蚊幼虫多聚集在沉积物表面。Taylor等[21]发现摇蚊幼虫(Chironomus riparius)暴露于林丹后,其筑巢行为明显受到抑制。关于污染物对摇蚊幼虫筑巢行为活动有促进作用的报道甚少,具体的机理还需进一步研究确认。

图3 摇蚊幼虫在沉积物表面筑巢行为变化情况注:A-21.6 mg·kg-1,B-46.4 mg·kg-1,C-72.7 mg·kg-1,K-试剂空白。Fig. 3 Changes of tube building behavior of C. kiiensis on the surface of sedimentsNote: A-21.6 mg·kg-1, B-46.4 mg·kg-1, C-72.7 mg·kg-1, K-solvent control.
2.3 HCB对摇蚊羽化时间的影响
羽化时间是摇蚊生命周期试验中常用的指示终点[21-24],通常羽化时间比生长终点要敏感[25],这可能是由于羽化涉及3个龄期和复杂的羽化过程。本研究结果表明,沉积物中HCB有加速摇蚊羽化的作用。与对照相比,HCB染毒组的摇蚊幼虫提前羽化为成虫。摇蚊一般是雄性先羽化,雌性比雄性羽化时间要迟2~7 d[23,24,26],本研究结果也符合雄性先熟的规律(见表2)。整体来看,HCB对雌性和雄性摇蚊的羽化具有相似的加速趋势。试剂空白中雄性摇蚊幼虫平均EmT50约为24.7 d,雌性约为27.0 d。沉积物中HCB浓度为21.6和46.4 mg·kg-1时,雄性摇蚊平均EmT50均为23.0 d,比对照组显著缩短(p<0.05);当HCB浓度升高至72.7和121 mg·kg-1时,雄性摇蚊平均EmT50均为22.0 d,与对照相比差异极显著(p<0.01)。当HCB染毒浓度为21.6、46.4和72.7 mg·kg-1时,雌性摇蚊平均EmT50约为25 d,与对照相比差异显著(p<0.05),HCB浓度高达121 mg·kg-1时,雌性摇蚊平均EmT50有所延长,约为25.8 d,但仍比对照短。虽然沉积物中HCB能显著加速雄性和雌性摇蚊幼虫的羽化,但是HCB对雄性摇蚊的影响更加明显。HCB属于内分泌干扰物,可能在摇蚊幼虫生长阶段通过促进其前脑激活激素或前胸蜕皮激素的分泌来促进摇蚊的羽化,或者通过抑制摇蚊咽侧体保幼激素的分泌来促进摇蚊的羽化,这与HCB能促进摇蚊幼虫筑巢行为的结果是一致的。已有的研究中发现,多数污染物会抑制摇蚊幼虫羽化,使其羽化时间推迟,例如重金属(Pb、Cd、Cu等)、三丁基锡、多环芳烃(PAHs)、农药(林丹、毒死蜱和塞米宁等)等都导致摇蚊幼虫羽化时间延迟[21,24,27-28]。也有研究报道一些内分泌干扰物,如2,4,5-三氯苯酚能加速摇蚊羽化,使羽化时间缩短[24,28],这些推迟和促进作用可能是通过干扰摇蚊蜕皮和羽化过程来影响羽化时间的。Lowell等[30]发现纸浆废水可以促进苍蝇生长并影响苍蝇的翅膀发育,该作者推测可能是纸浆废水中的污染物刺激苍蝇体内激素或其他生长因素等原因造成的。Watts等[28]也发现17α-雌二醇会促进摇蚊幼虫一代和二代的羽化时间,但没有明显的剂量效应关系。
在染毒沉积物中摇蚊雄性和雌性性别比接近1∶1,与对照相比未发现有显著差异(p>0.05),说明HCB对摇蚊幼虫的影响不存在性别差异。这与其他有机污染物对羽化摇蚊性别比的研究结果有所不同,如Lee等[31]曾研究八氯苯乙烯对摇蚊幼虫(Chironomus tentans)生长、发育和繁殖的影响,发现八氯苯乙烯使羽化摇蚊雄性数量明显减少。Watts等[29]发现17α-乙炔雌二醇对摇蚊幼虫的性别比有严重影响。导致这种差异的原因尚不清楚,需要更深入的研究。
综上,HCB对摇蚊的致死效应随着浓度的升高呈现增高的趋势,高浓度HCB对蛹期摇蚊致死作用明显。HCB对摇蚊28 d试验的LC50为59.8 mg·kg-1,对摇蚊羽化率的EC50为59.8 mg·kg-1。HCB对摇蚊幼虫筑巢行为和羽化有明显的促进作用,但对羽化摇蚊的性别比影响不大。
[1] Meijer S N, Ockenden W A, Steninnes E, et al. Spatial and temporal trends of POPs in Norwegian and UK background air: Implications for global cycling [J]. Environmental Science & Technology, 2003, 37(4): 54-61
[2] Wang G, Lu Y L, Han J Y, et al. Hexachlorobenzene sources, levels and human exposure in the environment of China [J]. Environment International, 2010, 36(1): 122-130
[3] Chiappini F, Alvarez L, Lux-Lantos V, et al. Hexachlorobenzene triggers apoptosis in rat thyrid follicular cells [J]. Toxicological Science, 2009, 108(2): 301-310
[4] 陈晓东, 吕永生, 朱惠刚. 环境六氯苯及其健康危害研究进展 [J]. 江苏卫生保健, 1999, 1(2):75-76
[5] Jarrell J F, Gocmen A, Akyol D, et al. Hexachlorobenzene exposure and the proportion of male births in Turkey 1935-1990 [J]. Reproductive Toxicology, 2002, 16(1): 65-70
[6] Bailey R E. Global hexachlorobenzene emissions [J]. Chemosphere, 2001, 43(1): 67-82
[7] Malcolm H M. Concise International Chemical Assessment Document, 60, Chlorobenzenes Other than Hexachlorobenzene: Environmental Aspect [R]. Geneva: World Health Organization, International Programme on Chemical Safety, 2004
[8] Nagyeri G, Valkusz Z, Radacs M, et al. Behavioral and endocrine effects of chronic exposure to low doses of chlorobenzenes in Wistar rats [J]. Neurotoxicology and Teratology, 2012, 34(1): 9-19
[9] Randi A S, Cocca C, Carbone V, et al. Hexachlorobenzene is a tumor co-carcinogen and induces alterations in insulin-growth factors signaling pathway in the rat mammary gland [J]. Toxicological Science, 2006, 89(1): 83-92
[10] Pena D, Pontillo C, Cocca C, et al. Alterations in c-Src/HER1 and estrogen receptor α signaling pathways in mammary gland and tumors of hexachlorobenzene-treated rats [J]. Toxicology, 2012, 293(1-3): 68-77
[11] Mundy L J, Crump D, Jones S P, et al. Induction of cytochrome P4501A by highly purified hexachlorobenzene in primary cultures of ring-necked pheasant and Japanese quail embryo hepatocytes [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2012, 155(3): 498-505
[12] Ferrington L C. Global diversity of non-biting midges (Chironmidae; Insecta-Diptera) in freshwater [J]. Hydrobiologia, 2008, 198 (595): 447-455
[13] Armitage P D, Cranston P S, Pinder L C. The Chironomidae: Biology and Ecology of Non-Biting Midges [M]. London: Chapman and Hall, 1995: 1-572
[14] Timmermans K R, Peeters W, Tonkes M. Cadmium, zinc, lead and copper in Chironomus riparius (Merigen) larvae (Diptera, Chironomidae): Uptake and effects [J]. Hydrobiologia, 1992, 241(2): 119-134
[15] 齐鑫, 马勇军, 潘志祥. 水环境中的摇蚊幼虫研究进展[J]. 台州学院学报, 2008, 30(6): 38-42
Qi X, Ma Y J, Pan Z X. Progress about chironomid larvae in water environment [J]. Journal of Taizhou University, 2008, 30(6): 38-42 (in Chinese)
[16] 赵燕, 汤保华, 蔡磊明, 等. 杀菌剂戊唑醇对花翅摇蚊(Chironomus kiiensis)幼虫的急性毒性和抗氧化酶系统的影响[J]. 农药, 2012, 51(6): 446-448
[17] Pasteris A, Vecchi M, Reynoldson T B, et al. Toxicity of copper-spiked sediments to Tubifex tubifex (Oligochaeta, Tubificidae): A comparison of the 28-day reproductive bioassay with a 6-month cohort experiment [J]. Aquatic Toxicology, 2003, 65(3): 253-265
[18] 刘宪斌, 陈楠, 田胜燕, 等. 天津高沙岭潮间带泥螺对多环芳烃菲的累积特征[J]. 生态环境学报, 2009, 18(4): 1241-1246
[19] Organisation for Economic Co-operation and Development (OECD). OECD 218. OECD Guidelines for the Testing of Chemicals: Sediment-Water Chironomid Toxicity Test Using Spiked Sediment [S]. French: OECD, 2004
[20] MacDonald M M, Warne A L, Mabury S A, et al. Toxicity of perfluorooctane sulfonic acid and perfluorooctanoic acid to Chironomus tentans [J]. Environmental Toxicology and Chemistry, 2004, 23(9): 2116-2113
[21] Taylor E J, Blockwell S J, Maund S J, et al. Effects of lindane on the life-cycle of a freshwater macroinvertebrate Chironomus riparius Meigen (Insecta: Diptera) [J]. Archives Environmental Contamination Toxicology, 1993, 24(2): 145-150
[22] Leslie H A, Kraak M H, Hermens J L. Chronic toxicity and body residues of the nonpolar narcotic 1,2,3,4-tetrachlorobenzene in Chronomus riparius [J]. Environmental Toxicology and Chemistry, 2004, 23(8): 2022-2028
[23] Marinkovi M, Verweij R A, Nummerdor G A, et al. Life cycle responses of the midge Chironomus riparius to compounds with different modes of action [J]. Environmental Science & Technology, 2011, 45(4): 1645-1651
[24] Paumen M L, Borgman E, Kraak M H S, et al. Life cycle responses of the midge Chironomus riparius to polycyclic aromatic compound exposure [J]. Environmental Pollution, 2008, 152(1): 225-232
[25] Ristola T, Kukkonen J V, Pellinen J. Body residues and responses of the midge Chironomus riparius to sediment-associated 2,4,5-trichlorophenol in subchronic and chronic exposures [J]. Archives Environmental Contamination Toxicology, 1999, 37(1): 42-49
[26] S nchez P, Alonso C, Fern ndez C, et al. Evaluation of a multi-species test system for assessing acute and chronic toxicity of sediments and water to aquatic invertebrates: Effects of entachlorophenol on Daphnia magna and Chironomus prasinus (6 pp) [J]. Journal of Soils and Sediments, 2004, 5(1): 53-58
[27] Agra A, Soares A M. Effects of two insecticides on survival, growth and emergence of Chironomus riparius meigen [J]. Bulletin of Environmental Contamination and Toxicology, 2009, 82(4): 501-504.
[28] Ebau W, Rawi C S, Din Z, et al. Toxicity of cadmium and lead on tropical midge larvae, Chironomus kiiensis Tokunaga and Chironomus javanus Kieffer (Diptera: Chironomidae) [J]. Asian Pacific Journal of Tropical Biomedicine, 2012, 2(8): 631-634
[29] Watts M M, Pascoe D, Carroll K. Chronic exposure to 17-ethinylestradiol and bisphenol A-effects on development and reproduction in the freshwater invertebrate Chironomus riparius (Diptera: Chironomidae) [J]. Aquatic Toxicology, 2001, 55(1): 113-124
[30] Lowell R B, Culp J M, Wrona F J. Stimulation of increased short-term growth and development of mayflies by pulp mill effluent [J]. Environmental Toxicology and Chemistry, 1995, 14(9): 1529-1541
[31] Lee S W, Choi J. Multi-level ecotoxicity assay on the aquatic midge, Chironomus tentans (Diptera, Chironomidae) exposed to octahlorostyrene [J]. Environmental Toxicology and Pharmacology, 2009, 28(2): 269-274
◆
ChronicEffectsofHexachlorobenzen(HCB)inSedimentstoChironomuskiiensisLarvae
Liu Li, Zhong Wenjue, Zhu Lingyan*
Key Laboratory of Pollution Processes and Environmental Criteria of Ministry of Education/Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China
20 August 2013accepted20 September 2013
The chronic toxicities of hexachlorobenzen (HCB) in sediments to freshwater benthic organism Chironomus kiiensis were studied by exposing the larvae in HCB-spiked sediments for 28 days. During the experiment, the behavior of larvae was carefully checked. The mortality, emergence rate and emergence time were used as endpoints. The LC50(lethal concentration 50) and EmT50(50% emergence time) in 28-d tests were estimated. The results indicated that the survival rate was equal with the emergence rate and the LC50and EC50(half maximal effective concentration) of emergence were both 59.8 mg·kg-1. Different from most of the organic pollutants, HCB could accelerate tube building of larvae in sediments and emergence of adults. The acceleration of tube building of larvae and the emergence of adults were more obvious as the concentration of HCB in sediments increased. When the concentration of HCB in sediments was higher than 21.6 mg·kg-1, the EmT50was significantly lower than the control, especially for the male. However, HCB showed no significant effect on the sex ratio of adults.
hexachlorobenzen; Chironomus kiiensis; sediment; chronic toxicity; emergence rate; emergence time; tube building
国家水体污染控制与治理科技重大专项子课题(2012ZX07501-003)
刘丽(1987-),女,硕士,研究方向为生态修复,E-mail: liliu829@126.com;
*通讯作者(Corresponding author),E-mail: zhuly@nankai.edu.cn
10.7524/AJE.1673-5897.20130820001
刘丽,钟文珏,祝凌燕,等. 沉积物中六氯苯对摇蚊幼虫慢性毒性效应研究[J]. 生态毒理学报, 2014, 9(2): 261-267
Liu L, Zhong W J, Zhu L Y, et al. Chronic effects of hexachlorobenzen (HCB) in sediments to Chironomus kiiensis [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 261-267 (in Chinese)
2013-08-20录用日期2013-09-30
1673-5897(2014)2-261-07
X171.5
A
祝凌燕(1969—),女,博士后,特聘教授,博士生导师,主要研究方向为有持久性有机污染物的环境过程及生物有效性、新型高效修复材料制备及水体污染控制效应机理、水体沉积物环境质量基准等,在国内外学术刊物上发表论文80余篇,其中SCI论文47篇。
