红曲霉固态发酵产木聚糖酶培养基的响应面优化
2014-09-20,,*,,
,,*, ,
(四川农业大学食品学院,四川雅安 625014)
红曲霉固态发酵产木聚糖酶培养基的响应面优化
刘波1,邬应龙1,*,张霞2,黄雅丽2
(四川农业大学食品学院,四川雅安 625014)
研究了碳源、氮源、无机盐对红曲霉M2固态发酵产木聚糖酶酶活的影响。在单因素实验的基础上,采用响应面实验设计对红曲霉固态发酵产木聚糖酶的培养基进行了优化,并建立了玉米粉、牛肉膏、K2HPO4变化的二次回归方程,探讨了各因子对木聚糖酶酶活的影响。最终确定适宜的培养基条件为:玉米粉添加量为1.90g、牛肉膏添加量为0.55g、K2HPO4添加量为0.10g;在该条件下可得到红曲霉M2产木聚糖酶的最大酶活,预测值为1550.62U/g,对实验结果进行验证,得到木聚糖酶酶活为1545.38U/g。
红曲霉,固态发酵,木聚糖酶,Box-Behnken设计
木聚糖是半纤维素的主要成分,同时也是自然界中仅次于纤维素的第二大可再生资源[1]。木聚糖酶是指专一降解木聚糖为寡木聚糖、低聚木糖、木二糖和木糖的一组酶的总称[2-4]。木聚糖酶在造纸、食品、饲料、加工等方面具有潜在的应用价值[5-9]。近年来随着生物科学的迅速发展,使得木聚糖酶在生物技术、合成调节和分子生物学方面的研究取得一定的进展。主要包括基因工程[10],蛋白质工程,固定化细胞技术[11],离子束诱变育种技术[12]。木聚糖酶的生产菌有很多,包括细菌[13-15]、霉菌[16-17]和酵母菌等,但是利用红曲霉进行固态发酵产木聚糖酶的研究几乎未见报道。因此,本研究在对木聚糖酶产生菌的最佳碳源、氮源和无机盐的种类和数量需要进行系统研究的基础上,应用响应面法[18-22](response surface methodology,RSM)对其固态发酵培养基组成进行筛选和优化,旨在提高该菌株的产酶量。
1 材料与方法
1.1材料与仪器
红曲霉M2 四川农业大学功能性实验室保藏;麸皮 雅安市雨城区农贸市场购买;NaNO3、MgSO4、K2HPO4、葡萄糖等 均为国产分析纯;PDA培养基(斜面) 300.0g/L土豆,20.0g/L葡糖糖,20.0g/L琼脂;种子培养基 300.0g/L土豆,20.0g/L葡糖糖;固态发酵基础培养基 麸皮10.0g,蒸馏水12.0mL;BT-124S型电子天平 北京赛多利仪器系统有限公司;DHP-420电热恒温培养箱 重庆四达实验仪器有限公司顺达仪器厂;HHS-9S型恒温水浴锅 上海光地仪器设备有限公司;JOUANBR4i型冷冻离心机 Thermo公司;UV-2102型紫外可见分光光度计 尤尼柯(上海)仪器有限公司。
1.2实验方法
1.2.1 孢子悬液的制备 取培养好的斜面,用无菌生理盐水洗脱孢子后转移至装有玻璃珠的无菌三角瓶中,充分摇动使孢子散开,用带脱脂棉的无菌漏斗过滤除去菌丝得到孢子悬液,将孢子浓度调整到106个/mL。
1.2.2 固态发酵培养 将1mL孢子悬液接种到固态发酵基础培养基中,在32℃下,恒温培养6d测定其酶活。
1.2.3 粗酶液的制备 取培养后的固态发酵培养物,先称重,然后加蒸馏水100mL,在40℃水浴中浸提1h,四层纱布过滤,3000 r/min离心15min。
1.2.4 指标测定方法(DNS 法[23]测定酶活性) 酶活性单位定义为:在该实验条件下,每分钟水解木聚糖形成1μmol木糖(还原糖)所需酶量为1个酶活力单位(U)。
1.2.5 培养基成分的筛选
1.2.5.1 碳源对产酶的影响 在固态发酵基础培养基中,分别添加1%(w/w)的玉米粉、可溶性淀粉、蔗糖、葡萄糖和乳糖,于恒温培养箱中32℃培养6d后测定酶活。根据酶活的大小确定最佳的碳源种类。
1.2.5.2 氮源对产酶的影响 在固态发酵基础培养基中,分别添加1%(w/w)的蛋白胨、牛肉膏、尿素、NaNO3和(NH4)2SO4,于恒温培养箱中32℃培养6d后测定酶活。根据酶活的大小确定最佳的氮源种类。
1.2.5.3 无机盐对产酶的影响 在固态发酵基础培养基中,分别添加0.1%(w/w)的K2HPO4、KH2PO4、MgSO4∶7H2O、MnCl2∶4H2O、CuSO4∶5H2O和CaCl2,于恒温培养箱中32℃培养6d后测定酶活。根据酶活的大小确定最佳的无机盐种类。
1.2.6 培养基各成分添加量的单因素实验
1.2.6.1 碳源添加量对产酶的影响 根据碳源的筛选结果,选择酶活最高的作为最适碳源。在固态发酵基础培养基中,分别添加1%、2%、4%、6%、8%、10%、15%、20%。然后于恒温培养箱中32℃培养6d后测定酶活。根据酶活的大小确定最佳的碳源添加量。
1.2.6.2 氮源添加量对产酶的影响 根据氮源的筛选结果,选择酶活最高的作为最适氮源。在固态发酵基础培养基中,分别添加1%、2%、4%、6%、8%、10%、15%、20%。然后于恒温培养箱中32℃培养6d后测定酶活。根据酶活的大小确定最佳的氮源添加量。
1.2.6.3 无机盐添加量对产酶的影响 根据无机盐的筛选结果,选择酶活最高的作为最适无机盐。在固态发酵基础培养基中,分别添加0.1%、0.2%、0.4%、0.6%、0.8%、1.0%、1.5%、2.0%。然后于恒温培养箱中32℃培养6d后测定酶活。根据酶活的大小确定最佳的无机盐添加量。
1.2.7 响应面优化设计 根据单因素的试验结果,选用玉米粉、牛肉膏、K2HPO4为考察因素,采用Box-Behnken中心组合实验设计,设计三因素三水平的响应面分析(RSA)实验,实验因子和编码水平如表1。
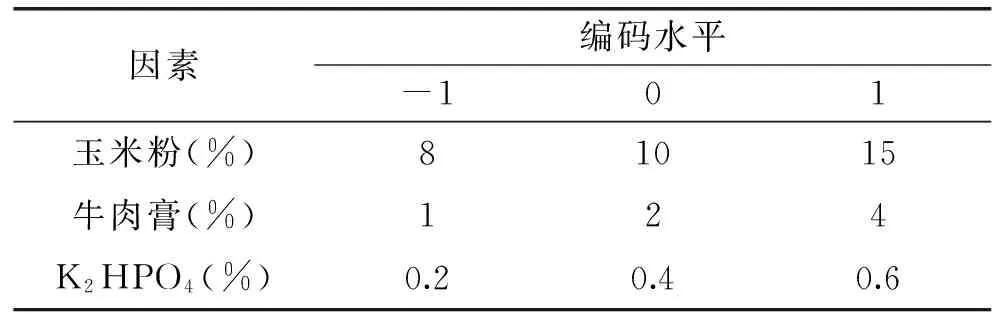
表1 实验因素水平及编码水平
1.2.8 数据处理 每个实验处理进行3次重复,取其平均值进行相关分析。利用Design Expert v7.0.0(Stat-Ease,Inc. Minneapolis,MN,USA)软件进行统计分析。
2 结果与讨论
2.1培养基成分的筛选
2.1.1 碳源的筛选 碳源作为真菌培养基的基本成分之一,能够为真菌的生长代谢提供能量。同时它也是菌体细胞组成的原料,也是菌体生长发育必需的能源物质。某些碳源是酶的诱导物,选择适宜的碳源有利于定向促进某些酶的合成。不同碳源对木聚糖酶酶活的影响如图1所示。红曲霉可以利用不同的碳源,但碳源类型对木聚糖酶酶活的高低影响较小。其中以玉米粉为碳源时,木聚糖酶酶活要高于其他的几种碳源。因此,选用玉米粉作为红曲霉固态发酵培养基的最佳碳源。

图1 碳源对木聚糖酶酶活的影响
2.1.2 氮源的筛选 氮的主要功能是提供细胞原生质和其他结构物质中的氮素,是微生物细胞需要量仅次于碳的元素。它是真菌培养基的基本成分之一,用于合成蛋白质、核酸等含氮类代谢物。不同氮源对木聚糖酶酶活的影响如图2所示。红曲霉能很好的利用有机氮源蛋白胨和无机氮源牛肉膏。两种有机氮源中,牛肉膏的效果明显好于蛋白胨。在三种无机氮源中,以NaNO3的效果最好。总体而言,有机氮源的效果好于无机氮源。故选择以牛肉膏作为红曲霉固态发酵培养基的最佳氮源。

图2 氮源对木聚糖酶酶活的影响
2.1.3 无机盐的筛选 除了上述的碳源和氮源外,微生物通常还需要一定量的无机盐来调节其生长代谢,比如磷是核酸和蛋白质的重要组成成分,能够影响微生物的生长;而镁作为许多重要酶的激活剂则能够影响基质氧化和蛋白质合成。不同无机盐对木聚糖酶酶活的影响如图3所示。添加K2HPO4的木聚糖酶酶活最高,说明K2HPO4对红曲霉产木聚糖酶优于其他几种无机盐。因此,选择在固体培养基中添加K2HPO4。

图3 无机盐对木聚糖酶酶活的影响
2.2培养基各成分添加量的单因素实验
2.2.1 玉米粉添加量对酶活的影响 根据碳源的筛选结果,红曲霉固态发酵选用玉米粉作为最佳碳源。如图4所示,考察了玉米粉添加量对木聚糖酶酶活的影响。由图4可以看出,随着玉米粉添加量的增加,木聚糖酶酶活逐渐升高;当玉米粉的添加量达到10%时,酶活达到最大,可达475.07U/g;而当玉米粉添加量继续增加时,木聚糖酶酶活反而下降,这表明过大的添加量并不利于酶活的增大。这可能是由于在培养空间一定时,玉米粉的添加量越多,通气量降低,导致生物量的积累下降从而使红曲霉的生长及产酶受到了一定的抑制。故在本实验的考察范围内玉米粉的最佳添加量为10%。

图4 玉米粉的不同添加量对木聚糖酶酶活的影响
2.2.2 牛肉膏添加量对酶活的影响 如图5所示,添加量在1%~2%的范围内,木聚糖酶酶活随着牛肉膏的增加而增大,但当牛肉膏的添加量超过2%时,木聚糖酶酶活随着牛肉膏的增加而减小。这表明过多的添加量并不利于酶活的升高,只有适宜的添加范围内才有利于红曲霉产木聚糖酶。原因可能在于牛肉膏添加量的增加使发酵基质过于稠密,黏度增大,影响发酵过程中微生物所需的氧气。故在本实验的考察范围内牛肉膏添加量应选择2%,此时酶活可达243.72U/g。

图5 牛肉膏的不同添加量对木聚糖酶酶活的影响
2.2.3 K2HPO4添加量对酶活的影响 如图6所示,添加量在0.1%~0.4%范围内,木聚糖酶的酶活随着K2HPO4添加量的增加而增大,原因可能在于K2HPO4作为酶激活剂能够激活红曲霉产木聚糖酶的活性。但当K2HPO4浓度超过0.4%时,木聚糖酶酶活随着K2HPO4的增加而减小。这表明过大的添加量并不利于红曲霉产木聚糖酶。只有适宜的添加量条件下才有利于红曲霉产木聚糖酶。故在本实验的考察范围内K2HPO4的最佳添加量为0.4%,此时酶活可达588.26U/g。

图6 K2HPO4的不同添加量对木聚糖酶酶活的影响
2.3响应面实验设计优化结果
2.3.1 模型的建立及显著性检验 利用Design Expert v7.0.0(Stat-Ease,Inc. Minneapolis,MN,USA)软件进行统计分析。根据表2的试验结果,对表中数据进行多元回归拟合,得到红曲霉固态发酵产木聚糖酶酶活(Y)对玉米粉(X1)、(NH4)2SO4(X2)、K2HPO4(X3)的多项回归方程为:Y=1462.71+102.52X1+53.49X2+209.57X3-6.89X1X2-34.47X1X3-43.22X2X3-108.24X12-117.00X22-149.46X32。对实验结果进行方差分析,结果如表3所示。
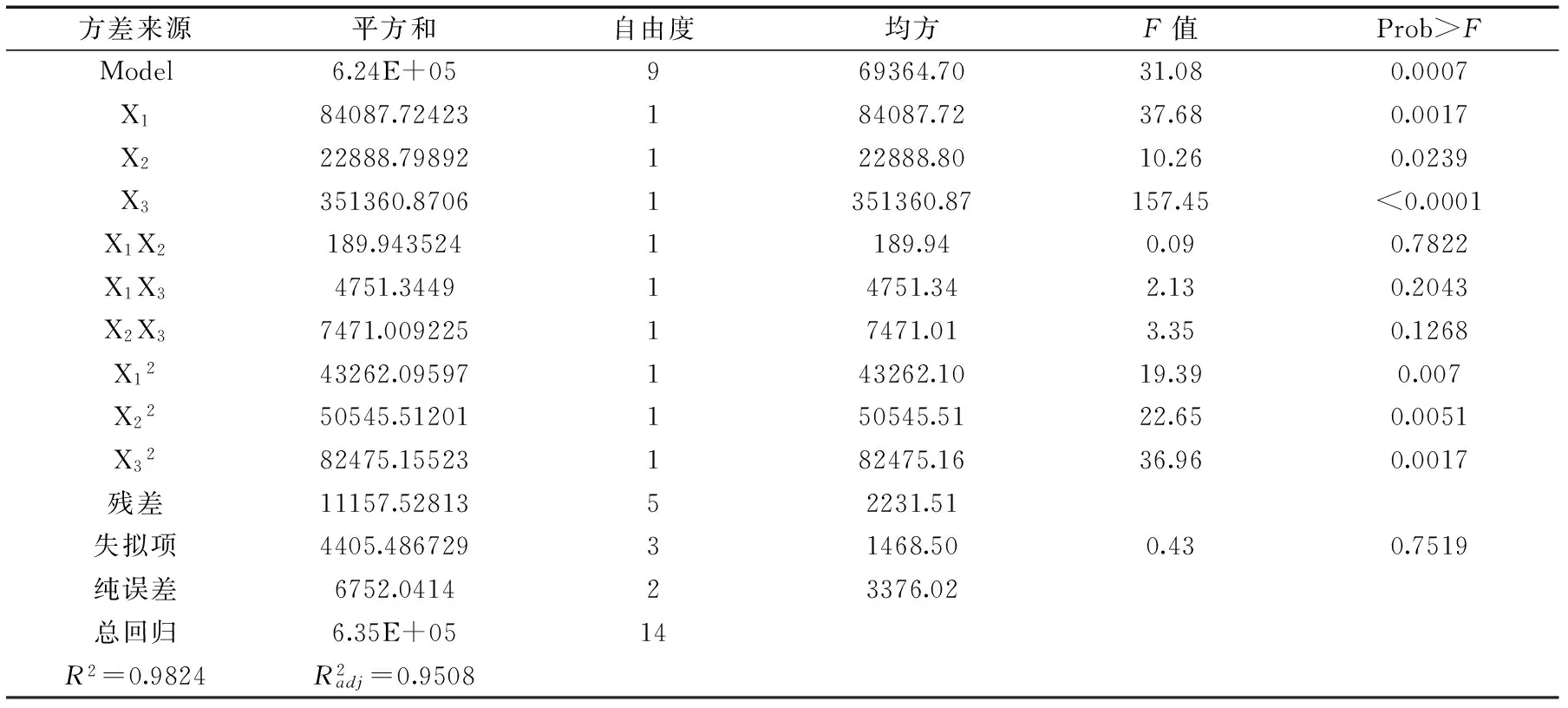
表3 木聚糖酶酶活多项式回归模型方差分析
2.3.2 响应面优化及分析 由回归方程所作的响应面立体分析图如图7~图9所示,它们分别反映了玉米粉(X1)、牛肉膏(X2)、K2HPO4(X3)这三个因素的两两交互作用对响应值的影响。玉米粉和牛肉膏对木聚糖酶的影响如图7所示,当玉米粉的添加量一定时,木聚糖酶的酶活随着牛肉膏添加量的增加而增大,但当牛肉膏的添加量大于0.55g时,木聚糖酶酶活呈下降趋势。当牛肉膏的添加量一定时,随着玉米粉添加量的增加,木聚糖酶的酶活随着玉米粉添加量的增加而增大,但当玉米粉的添加量继续增大时,木聚糖酶酶活逐渐降低。等高线的形状可以反映因素间交互作用的强弱大小,圆形表示交互作用不显著,椭圆形表示交互作用显著。如图8所示,X3因素(K2HPO4)与X1因素(玉米粉)交互作用显著。等高线与X3因素(K2HPO4)的交点多于与X1因素(玉米粉)的交点,因此玉米粉、K2HPO4的交互作用中,K2HPO4对木聚糖酶酶活的影响较大,为主效应因子。牛肉膏和K2HPO4对木聚糖酶酶活的影响如图9所示,当K2HPO4的添加量一定时,木聚糖酶酶活随着牛肉膏添加量的增加呈先增大后降低的趋势。当牛肉膏的添加量一定时,木聚糖酶酶活先增大后降低,这与图7和图8显示的规律相同。此外从响应面图可分析得出,在各因素之间的交互影响中,3因素中K2HPO4对木聚糖酶酶活响最大,玉米粉次之,牛肉膏最弱。此结果与方差分析表所反映出的结果一致。在此基础上,通过Design Expert软件,进行分析计算,可得到红曲霉M2固态发酵产木聚糖酶的最佳培养基配方为:玉米粉添加量为1.91g、牛肉膏添加量为0.56g、K2HPO4添加量为0.11g,在此条件下木聚糖酶酶活预测值可达1550.62 U/g。结合实际操作的方便和方差分析结果,最终确定培养基配方为:玉米粉添加量为1.90g、牛肉膏添加量为0.55g、K2HPO4添加量为0.10g。
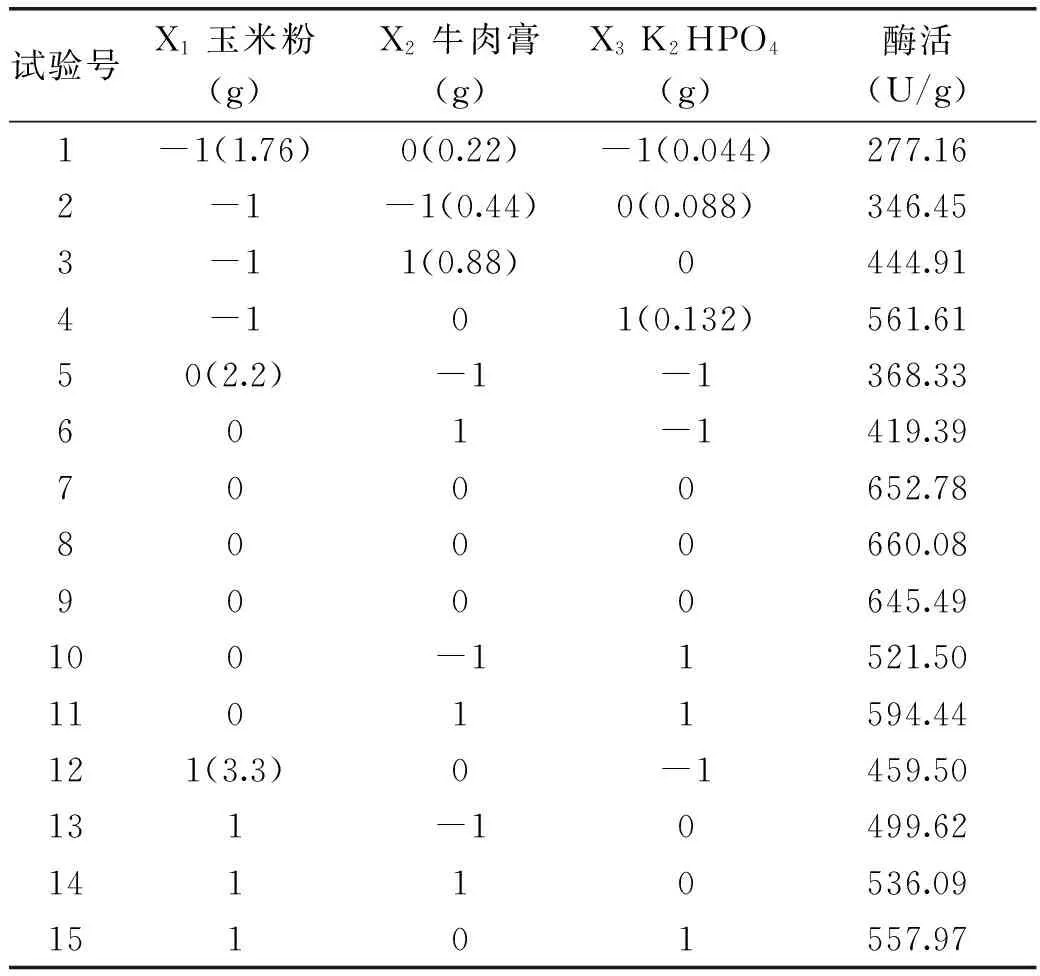
表2 响应面分析试验结果

图7 玉米粉和牛肉膏对木聚糖酶酶活影响的 响应面立体分析图

图8 玉米粉和K2HPO4对木聚糖酶酶活影响的 响应面立体分析图
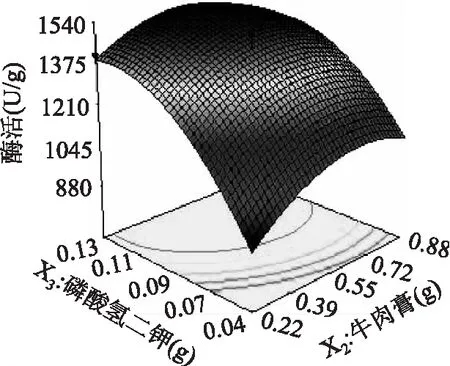
图9 牛肉膏和K2HPO4对木聚糖酶酶活影响的 响应面立体分析图
2.3.3 模型的验证 为了验证红曲霉M2固态发酵产木聚糖酶的精确性,对该模型进行验证实验。按照此最终培养基参数进行3次重复实验,可得木聚糖酶酶活平均值为1545.38U/g,实验值与预测值(1550.62U/g)只相差0.34%。表明此模型是可行有效的,并具有一定的实践参考价值。
3 结论
通过培养基的筛选,确定了红曲霉M2固态发酵产木聚糖酶的最佳培养基配方:碳源为玉米粉,氮源为牛肉膏,无机盐为K2HPO4。在单因素实验的基础上,采用Box-Behnken实验设计,对红曲霉产木聚糖酶培养基进行了优化,通过响应面法对实验数据进行优化与评价,得到影响木聚糖酶酶活的二次多项式回归模型,并对该模型进行显著性检验。最终得到优化培养基组成为:玉米粉添加量为1.90g、牛肉膏添加量为0.55g、K2HPO4添加量为0.10g;在此条件下可得到木聚糖酶的最高酶活,预测值为1550.62 U/g,对实验结果进行验证,可得木聚糖酶酶活平均值为1545.38U/g,与理论预测值基本一致证明该模型合理可靠。
目前对真菌产木聚糖酶研究主要集中在木霉属、曲霉属和毛霉属。Palaniswamy等[24]用燕麦木聚糖作为底物对53株真菌进行诱导产酶,结果53株都具有很好的木聚糖酶降解活性。其中内切1,4-β-D-木聚糖酶的酶活力为4.41~132.20 U/mL,β-D-木糖苷酶的酶活力为48.72~1510.32 U/mL。朱运平[25]等人对一株产木聚糖酶放线菌的液体发酵条件进行了优化,最佳产酶条件下木聚糖酶活力达1074.8U/mL。而周薇薇[26]等人以黑曲霉(Aspergillus niger FIP-09-24)为研究对象,利用响应面法优化了其工艺,最佳条件下的酶活可达66002U/g。本试验所得木聚糖酶酶活虽然与周薇薇等人的研究相差较大,这可能是由于酶活定义不同及所选用的菌种不同的缘故。因此后续研究可考虑诱变育种和基因工程育种等方法对红曲霉进行改造,以期获得更高的酶活。
[1]孙雷,朱孝霖,李环,等.基因工程菌1020耐热木聚糖酶的纯化与性质[J].食品科学,2006,27(9):76-78.
[2]Coughlan M P,Hazlewood G P.β-1,4-D-xylan-degrading enzyme system:biochemistry,molecularbiology and applications[J].Biotechnol Apply Bioche,1993,17:259.
[3]吴萍,李正鹏,何庆元,等.金针菇固态发酵产木聚糖酶的纯化及其性质研究[J].药用生物技术,2012,19(1):31-34.
[4]符丹丹,李爱江,谢慧,等.宇佐美曲霉木聚糖酶的纯化及其性质[J].食品科学,2006,27(2):116-120.
[5]江正强. 微生物木聚糖酶的生产及其在食品工业中应用的研究进展[J].中国食品学报,2005,5(1):1-8.
[6]孙振涛,赵祥颖,刘建军,等.微生物木聚糖酶及其应用[J].生物技术,2007,17(2):93-97.
[7]Fengxue Xin,Jianzhong He.Characterization of a thermostable xylanase from a newly isolated Kluyvera species and its applicat-ion for biobutanol production[J].Bioresource Technology,2013,135:309-315.
[8]Sella L,Gazzetti K,Faoro F,etal. A Fusarium graminearum xylanase expressed during wheat infection is a necrot-iczing factor but is not essential for virulence[J].Plant Physiology and Biohemistry,2013,64:1-10.
[9]Kumar T V. Satyanarayana.Thermo-alkali-stable xylanase of a novel polyextremophilic Bacillus halodurans TSEV1 and its application in biobleaching[J]. International Biodeterioration & Biodegradation,2012,75:139-145.
[10]暴立娟,宋庆凤,李杰.重组木聚糖酶的安全高效表达与应用研究[J].食品工业科技,2011(1):156-161.
[11]Sanjay,Asish Mandal,Pradeep K,etal.Production of xylanase byimmobilized Trichoderma reesei SAF3 in Ca-alginate beads[J]. Journal of Industrial Microbiology & Biotechnology,2008,35(4):245-249.
[12]李市场,白爱枝,余增亮,等.离子束诱变木聚糖酶产生菌(Aspergillusniger A3)筛选方法的比较研究[J].激光微生物学报,2003,12(2):149-152.
[13]Chun-Han Ko,Chung-Hung Tsai,Jenn Tu,etal. Identification ofPaenibacillussp. 2S-6 and application of its xylanase on bio-bleaching. [J].International Biodeterioration & Biodegradation,2011,65(2):334-339.
[14]Bajaj B K,Manhas K. Production and characterization of xylanase fromBacilluslicheniformis P11(C)with potential for fruit juice and bakery industry[J]. Biocatalysis and Agricultural Biotechnology,2011,1(4):330-337.
[15]Zhengqiang Jiang,Qianqian Cong,Qiaojuan Yan,etal.
Characterisation of a thermostable xylanase from Chaetomium sp. and its application in Chinese steamed bread[J]. Food Chemistry,2010,120(2):457-462.
[16]曹云鹤,陈小玲,贺平丽,等.硫色曲霉木聚糖酶基因xyn A的克隆、表达及酶学性质分析[J].生物技术通讯,2006,17(6):878-881.
[17]江正强,杨绍青,李里特,等.嗜热拟青霉固体发酵产木聚糖酶的纯化和性质[J].工业微生物,2006,36(3):1-4.
[18]徐子钧,李剑,梁凤来,等.利用SAS软件优化L-乳酸发酵培养基[J]. 微生物学通报,2004,31(3):85-87.
[19]王晓青,曾洪梅,石义萍. 农用抗生素2-16高产菌株选育及发酵优化组合研究[J]. 微生物学通报,2005,32(6):7-11.
[20]高鹏飞,李妍,赵文静,等.益生菌Lactobacilluscasei Zhang增殖培养基的优化[J]. 微生物学通报,2008,35(4):623-628.
[21]Suny,Wangzf,Wujh,etal. Optimising enzymatic macerationin pretreatment of carrot juice concentrate by response surface methodology[J]. International Journal of Food Science and Technology,2006,41(9):1082-1089.
[22]Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959,31:426-427.
[23]Lowry O H,Rosebrough N J,Farr A L,etal.Protein measurement with the Folin phenol reagent[J].The Journal of Biological Chemistry,1951,193:265-275.
[24]Palaniswamy M,Pradeep B V,Sathya R,etal. Isolation,identification and screening ofpotential xylanolytic enzyme from litter degrading fungi[J]. African Journal of Biotechnology,2008,7(11):1978-1982.
[25]代义,吕淑霞,林英,等.高产木聚糖酶菌株筛选、鉴定及产酶条件的研究[J].生物技术,2008,18(2):70-73.
[26]周薇薇,尹亚辉,赵长新.响应面法优化黑曲霉固态发酵产木聚糖酶工艺[J].大连工业大学学报,2013,32(3):176-179.
Optimization of solid state fermentation medium ofMonascusM2 for xylanase production by response surface analysis
LIUBo1,WUYing-long1,*,ZHANGXia2,HUANGYa-li2
(College of Food Science,Sichuan Agricultural University,Ya’an 625014,China)
The influence of carbon sources,nitrogen source,mineral salt on xylanase activity producted byMonascusM2 in the solid state fermentation was studied.On the base of single factors experiments,response surface analysis was applied to optimize the solid state fermentation medium ofMonascusM2 for xylanase production.The quadratic regression analysis was applied to get the optimal level of main factors(corn meal,beef extract,K2HPO4). Finally determined the optimal medium as follows:corn meal 1.90g,beef extract 0.55g,K2HPO40.10g. Under these optimal conditions,the predicted and experimental production of the activity of xylanase was high up to 1550.62 U/g and 1545.38 U/g,respectively.
Monascus;solid state fermentation;xylanase;Box-Behnken experiment design
2013-07-15 *通讯联系人
刘波(1987-),男,硕士研究生,研究方向:功能性食品。
TS201.1
:B
:1002-0306(2014)01-0254-06
