基于超细粉碎技术的鱼鱼皮胶原热稳定性研究
2014-09-20,,
, ,
(1.江南大学食品装备工程研究中心,江苏无锡 214122; 2.江南大学食品学院,江苏无锡 214122)
王立慧1,马倩2,张裕中1
(1.江南大学食品装备工程研究中心,江苏无锡 214122; 2.江南大学食品学院,江苏无锡 214122)
利用醋酸及胃蛋白酶从经过超细粉碎的鮰鱼鱼皮中提取了胶原,并对其热稳定性进行了研究。通过差示量热扫描分析测定其变性温度和收缩温度,并将鱼皮胶原在变性温度和收缩温度下处理1h,在4℃下复性24h,后通过圆二色谱分析、傅立叶红外扫描分析和SDS-PAGE凝胶电泳分析其复性情况。结果表明:胶原蛋白的变性温度为36℃,收缩温度为65℃;SDS-PAGE凝胶电泳图谱表明所提取的胶原具备Ⅰ型胶原的特征;热处理后的胶原蛋白发生了一定程度的变性,且结构不能完全恢复;65℃处理比36℃处理的胶原蛋白复性效果好。本研究可为斑点鮰鱼鱼皮胶原的应用提供理论依据。
鮰鱼鱼皮,胶原,变性温度,收缩温度,复性
胶原是自然界普遍存在的一类蛋白质,主要存在于动物的皮、骨、牙齿、韧带、肌腱、韧带中。从动物皮肤中提取的Ⅰ型胶原蛋白在止血、促进细胞生长、低抗原性等方面有有独特优势,因而广泛应用于医学、食品、营养保健品等领域[1]。蛋白质分子依靠分子内和分子间的氢键来保持它的天然构象,当温度过高时,氢键遭到破坏导致构象发生改变,蛋白的物理、化学性能及许多生物学性能都随之消失;变性后的蛋白质在4℃下能发生一定程度的复性,性质有所恢复。因此蛋白质的热稳定性对胶原蛋白的应用具有十分重要的意义。目前关于胶原蛋白的变性温度、热收缩温度国内外学者已有研究[2-5],但关于其复性的情况还未见报道。斑点叉尾鮰鱼属于大型的淡水鱼类,湖北省1986年从美国引进并养殖成功。近年来随着国际市场上斑点叉尾鮰鱼加工产品供不应求,国内市场水产品鱼类产品加工量巨大,生产过程就产生大量下脚料。从这些下脚料中提取胶原加以利用,既可以提高鱼产品加工业的经济效益,又可以减少下脚料废弃物造成的环境污染。本文以斑点叉尾鱼回鱼鱼皮为原料提取鱼皮胶原,探究其在变性温度和收缩温度下变性后的复性情况,旨在为鮰鱼鱼皮的利用提供理论基础。
1 材料与方法
1.1材料与设备
斑点叉尾鮰鱼 江苏省泰兴江泰食品有限公司;标准I型胶原蛋白 博美公司;冰乙酸、NaCl、HCl、AgCl等试剂均为分析纯;所用水均为超纯水。
差示扫描量热仪Pyris DSC 美国Perkin Elmer公司;傅立叶变换红外光谱仪NICOLET IS10 赛默飞世尔科技(中国)有限公司;圆二色谱仪MOS-450 法国Bio-logic公司;电热鼓风干燥箱 上海博迅实业有限公司医疗设备厂;低速离心机DL-5型 上海安亭科学仪器厂;真空冷冻干燥机 美国电热公司;分析天平AB104-N型 梅特勒-托利多仪器公司。
1.2实验方法
1.2.1 鱼皮胶原蛋白的提取
1.2.1.1 原料前处理 用自来水冲洗斑点叉尾鮰鱼,在冰上剥下鱼皮,剔除皮下结缔组织和脂肪组织。将鱼皮切成5mm×5mm的小块,用浓度为50g/L的NaCl溶液浸泡 6h(低于10℃,间歇搅拌,NaCl溶液与鱼皮的体积质量比为5∶1),之后鱼皮用冷去离子水(低于10℃)洗涤,并沥干,用2倍体积(v/m)正己烷浸泡6h,每2h搅拌15min以除去脂肪。通风橱中沥干后于冰箱内预冻[6]。
1.2.1.2 胶原提取与纯化 准确称取一定质量的干燥鱼皮,以料液比1∶30(W/V)加入0.5mol/L的乙酸,加入一定质量的胃蛋白酶,在4℃下提取24h,间歇搅拌。用多层纱布过滤浸提液,以NaCl盐析至浓度为0.9mol/L。在4000r/min下离心15min,分离沉淀,并将白色沉淀复溶于0.5mol/L乙酸,重复盐析沉淀,取得的沉淀依次用0.5mol/L乙酸,0.1mol/L乙酸和去离子水透析,所得鱼皮胶原经冷冻干燥至于干燥器中包藏[7]。
1.2.2 胶原变性温度和收缩温度的测定
1.2.2.1 变性温度的测定 将冷冻干燥的胶原干品溶于0.5mol/L乙酸中制成20mg/mL 的胶原溶液,准确量取10mL的溶液密封于液体坩埚内,置于差示扫描量热仪内,在20~80℃范围里扫描,升温速度1℃/min[8]。
1.2.2.2 收缩温度的测定 准确秤取2~3mg胶原冻干品,密封于固体坩埚内,置于差示扫描量热仪内,在20~80℃范围里扫描,升温速度1℃/min。
1.2.3 胶原复性的研究 用5mol/L乙酸将胶原干品配制成一定浓的胶原溶液,分别在比变性温度和收缩温度稍高的36、65℃下作用1h,于4℃下复性24h,用于后续研究。
1.2.3.1 圆二色谱分析 将胶原干品浓度配为0.125mg/mL的溶液,取两份于36、65℃处理并复性,注入1mm光径的样品池,在15℃,190~260nm下对样品进行扫描,以未处理的溶液做空白。扫描速率为100nm/min,每个点扫描3次,分辨率为1nm,狭缝宽度为1nm。
1.2.3.2 傅立叶红外扫描分析 将复性24h后的三种溶液再次冷冻干燥成胶原干品,采用傅立叶红外变换光谱仪做全反射,在4000~400cm-1的波数范围内测定其吸收光谱,扫描32次,分辨率4cm-1。
1.2.3.3 SDS-PAGE凝胶电泳 取三份胶原冻干品,分别加1mL去离子水浸泡至透明状,将其中两份分别置于36、65℃的水浴锅中作用1h,后同对照组于4℃下复性24h。分别加1mL 2%(w/v)SDS溶解,以1∶1(v/v)的比例同Sample buffer混合,沸水浴3min,冰浴冷却。采用5%分离胶,4%浓缩胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳[9]。
2 结果与分析
2.1胶原变性温度与收缩温度的测定
2.1.1 变性温度 鱼皮胶原溶液DSC曲线如图1所示。罗非鱼鱼皮胶原变性的初始温度为34.5℃,结束温度为37.6℃,它是由于胶原纤维失水以及发生热变性的温度范围。当胶原处在此温度范围中时,胶原的三螺旋结构将会被破坏,胶原活性也会丧失,也就是说胶原将发生结构和性质的改变。图1中的峰值温度即为鮰鱼皮胶原蛋白的变性温度,即TD=36℃,比鲍士宝[10]和喻亚丽[11]测得的鮰鱼鱼皮胶原略高,而低于猪皮胶原的变性温度(37℃),这主要是由于斑点叉尾鱼回鱼皮胶原脯氨酸羟基化程度比一般冷水鱼类高,而比猪牛胶原低的缘故。

图1 鱼皮胶原溶液DSC曲线
2.1.2 收缩温度 图2是鱼皮胶原冻干品的DSC温度曲线。在剧烈的条件下(如60℃以上)胶原三螺旋结构中某些共价键会被破坏,如1919年Ewald就曾报道过哺乳动物的皮或腿的胶原纤维在60~70℃的水中猛烈收缩。当其有序结构收缩为初始的1/3时的温度称为热收缩温度[5]。由图2中吸收曲线的峰值温度可知,胶原的热收缩温度为65℃,高于刘龙天[12]所提取的牛腱Ⅰ型胶原的收缩温度(60℃),在这个温度下鱼皮胶原纤维会出现强烈的收缩变性,此时胶原的螺旋体链散开,分子量降低。胶原的收缩通常认为是胶原肽链间的键被弱化或错位的结果,收缩温度是胶原结构稳定性的量度。收缩温度的确定可以为鱼皮胶原蛋白在实际生产中的利用和回收提供了理论基础,即回收胶原蛋白时,温度条件要低于其收缩温度。
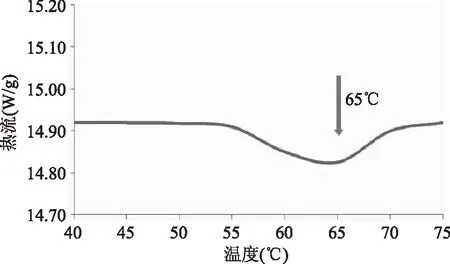
图2 鱼皮胶原冻干品的DSC温度曲线
2.2胶原复性的研究
复性操作是采用合理的方法使目标蛋白从变性的完全伸展状态恢复到正常的具有生物活性的折叠结构。
2.2.1 圆二色谱分析 蛋白质分子具有手性,也具有光学活性,其CD光谱在紫外区段有特征峰,可以用于解析蛋白质的二级结构,如α-螺旋、β-折叠、γ-转角和变性蛋白质的CD光谱[12]。
图3是经36℃和65℃处理并复性后的胶原,同对照组(原始胶原)的CD曲线。由图3 可知,同对照组相比,36℃和65℃处理的胶原DSC曲线的负吸收峰的峰位右移,峰强度均有大幅减弱,并且 36℃下的变化比65℃下变化更明显。胶原被加热时,氢键断裂,三螺旋结构解缠绕为形成三条肽链,分子结构从有序态变为无序态、从折叠态变为无规卷曲状态,故变性的胶原内部各二级结构的含量显著较少。而胶原在收缩温度下,三条分散的肽链会发生收缩,首尾端相互交联形成氢键,因此虽然65℃处理下的二级结构含量远比对照组胶原少,但仍多于36℃处理的胶原,CD曲线更接近对照组。
由此表明,在变性温度和收缩温度的作用下胶原的三螺旋结构受到明显的破坏,虽经24h的复性,仍无法恢复到原始的结构,且65℃处理后胶原的复性程度高于36℃的胶原。

图3 不同处理下鱼皮胶原的CD曲线
2.2.2 傅立叶红外分析 天然胶原的三级结构呈独有的右手三螺旋构型,由3个具有左手螺旋结构的P2亚基相互缠绕而成,每个亚基的三肽重复序列Gly-X-Y中的甘氨酸-NH与相邻X位亚基的C=O间形成1个直接氢键,其余2个C=O以及羟脯氨酸的一OH基团参与分子内或分子间的水桥氢键。因此在胶原三螺旋结构的红外光谱中,酰胺A、酰胺I、酰胺III具有明显特征。
图4是三种不同处理下胶原的红外图谱,表1是不同样品在1240、1450cm-1处的透光率。由以上数据可以看到,对照组胶原在3293.339cm-1有一个强而宽的吸收峰,该峰对应于胶原中-NH和-OH的振动,其吸收峰位置与吸收强度与氢键缔合程度及三螺旋结构有序程度密切相关。2926.312cm-1处为-CH2伸缩振动峰。在1700~1200cm-1间,分别出现了三个吸收峰,它们是蛋白质的酰胺Ⅰ(1635.822cm-1)、酰胺Ⅱ(1538.434 cm-1)及酰胺Ⅲ(1239.040cm-1)的吸收带,这是蛋白质在红外光谱中的特征吸收峰。且1240、1450 cm-1附近的峰透光率比值A1240/A1450值为1.011,很接近于1,说明其三股螺旋结构保持得较完整[13]。
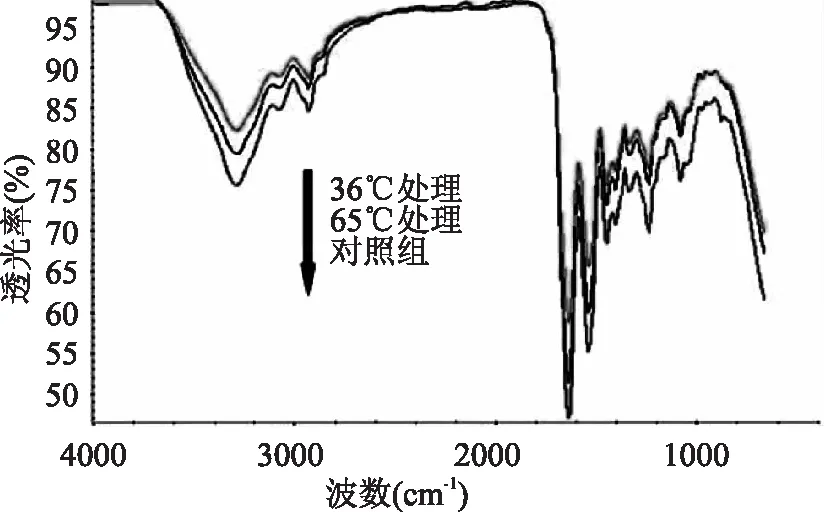
图4 不同处理下鱼皮胶原的红外图谱

样品1240cm-11450cm-1对照组69.09467.90836℃76.84675.15565℃73.91672.631
同对照组相比,36℃和65℃处理的胶原的几个特征吸收峰的峰位有一定程度的左移,透光率均有明显的减弱,表明各特征峰处的键强度减弱。同时65℃变化的幅度小36℃的处理,两者的A1240/A1450分别为1.022,1.017。表明胶原变性和收缩后,虽经24h的复性仍无法完全恢复到初始结构,部分二级结构被破坏,保留的二级结构使之出现特征峰,但由于含量大大减少,使透过强度减弱。这些变化同样表明了CD测试中,对于变性温度和收缩温度下处理的胶原的分子结构的变化情况:收缩温度处理后胶原的3条肽链在首末端通过氢键连接,故比变性后的胶原所含氢键多,分子量更大些。
2.2.3 SDS-PAGE凝胶电泳 图5所示的是实验所选取的淡水鱼鱼皮胶原蛋白的电泳图谱。图中对照组胶原含有3条分子质量谱带分别是胶原的α1组分、α2组分和β组分,其中β组分为α肽链的二聚体,由α1和α2组成,且α1链的光密度为α2链的2倍,符合已报道的对Ⅰ型胶原分子结构的描述,故可以推断所提取的胶原蛋白分子组成应为(α1)2α2,为Ⅰ型胶原[14-15]。
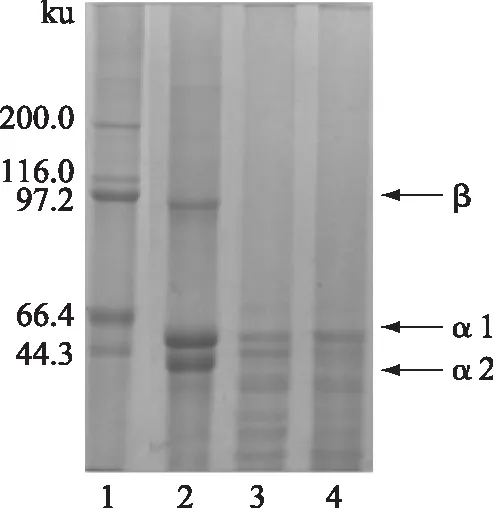
图5 不同处理下鱼皮胶原的电泳图谱
由图5可以看出,经36℃和65℃处理并复性后的胶原结构发生明显变化,在α链以下片区成像显示键断裂或解旋的碎片,没有对照组中明显的α链、β链。由此可推断经变性温度和收缩温度处理后,胶原的三条链被打散,成为分散的α链或者α链被进一步作用成更加零碎的片段。虽经过复性,仍无法恢复到原来的三螺旋结构,即单纯经4℃冷却的复性效果不如基因工程中的好,因此今后胶原的复性可尝试添加聚乙二醇等添加剂[16],进一步提高其复性效果。
3 结论
本实验主要是通过醋酸和胃蛋白酶从斑点叉尾鮰鱼皮中提取Ⅰ型胶原蛋白,测定其变性温度和收缩温度,并探究其在变性温度和收缩温度下处理1h,在4℃下复性24h后结构的变化。
利用差示量热扫描(DSC)法测得鱼皮胶原的变性温度为36℃、热收缩温度为65℃。分别在36℃、65℃下将胶原热处理1h,在4℃下复性24h后测定其CD光谱、红外光谱以及SDS-PAGE凝胶电泳,结果均表明:经热处理后的胶原三螺旋结构受到破坏,二级结构减少,虽经复性仍无法完全恢复到初始结构。另外,胶原变性和热收缩时结构的变化存在差异:变性时胶原的三螺旋结构解体,成为三条独立的游离肽链;热收缩时三条肽链并不是完全分离,相互间在首末端作用,形成氢键,因此,65℃处理胶原的CD光谱、红外光谱更加接近未处理的胶原。在工业生产中,利用鱼皮时需注意环境温度低于36℃,以免造成鱼皮胶原不可恢复的变性。
[1]刘秉慈.胶原蛋白在医用生物材料中的应用[J].生命的化学,1991,11(4):23-24.
[2]康俊霞,康永锋,包斌,等.Na+、Ca2+和pH对鲸鲨皮胶原蛋白热变性温度的影响[J].食品科学,2011,32(13):66-70.
[3]何有节,彭必雨.被蒙囿络合物对胶原热稳定性的作用[J].皮革科学与工程,1997,7(4):39-44.
[4]宋瑞瑞,包斌,卜勇士,等.Ⅱ型胶原蛋白的热稳定性、圆二色性和红外光谱研究[J].中国海洋药物,2013,32(1):55-62.
[5]Nishtar Nishad Fathima,Balaraman Madhan,Jonnalagadda Raghava Rao,etal.Interaction of aldehydes with collagen:effect on thermal,enzymatic and conformational stability[J].Biological Macromolecules,2004,34:241-247.
[6]L S Senaratne,Pyo-JamPark.Isolation and characterization of collagen from brown backed toadfish(Lagocephalus gloveri)skin[J].Bioresource Technology,2006(97):191-197.
[7]户业丽,吴洁,张瑞,等.酸法提取人工养殖鲟鱼皮中胶原蛋白工艺的研究[J].食品科技,2008,(2):109-210.
[8]赵露,刘海英,袁信华,等.斑点叉尾鲴鱼皮胶原的提取及其基本特性的研究[J].大连水产学院报,2009,24:423-430.
[9]Motowidlo,Sladewska,Mulkiewicz,etal. Isolation and Characterization of a Thermally Stable Collagen Preparation from The Outer Skin of The Siver[J].Aquaculture,2008,78(13). 130-134.
[10]鲍士宝,王璋,许时婴,等. 鮰鱼鱼皮胶原的提取及性质研究[J]食品与发酵工业,2008,34(9):84-88.
[11]喻亚丽,周运涛,何力,等.斑点叉尾鮰鱼皮胶原蛋白的理化特征研究[J].食品工业科技,2013,34(4):89-93.
[12]刘龙天.胶原蛋白三螺旋结构及热稳定性的研究[D].北京:北京协和医学院,2009.
[13]Plepis A M,Goissis G Das-Gupta D K.Dielectric and Pyroelectric Characterizationof anionic and native collagen[J]. Polymer Engineering and Science,1996,36(24):2932-2938.
[14]Prabjeet Singh,Soottawat Benjakul,Sajid Maqsood,etal. Isolation and characterisation of collagen extracted from the skin of stripedcatfish(Pangasianodon hypophthalmus)[J]. Food Chemistry,2011,124:97-105.
[15]赵苍碧,黄玉东,李艳辉. 从牛腱中提取胶原蛋白的研究[J]. 哈尔滨工业大学学报,2004,36(4):516-519.
[16]牛建楼,刘白玲,王斌.促蛋白复性高分子及其作用机制[J].中国科学院研究生院学报.2012.29(5):693-698.
Study on the thermal stability of channel catfish skin collagen based on ultrafine grinding
WANGLi-Hui1,MAQian2,ZHANGYu-zhong1
(1.Research Center of Food Equipment,Jiangnan University,Wuxi 214122,China; 2. School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Through the method of acid-pepsin,the collagen was extracted from the skin of channel catfish which was grinded,and its thermal stability was studied. The denaturation temperature and shrinkage temperature of skin collagenwere analyzed through differential scanning calorimetric measurements,and the renaturation of collagen was investigated through circular dichroic,FT-IR spectra and SDS-PAGE after it was treated in denaturation temperature and shrinkage temperature for 1h and placed at 4℃ for 24h. The result indicated that the denaturation temperature and shrinkage temperature were respectively 36℃ and 65℃,and the collagen was characterized as type I by SDS-PAGE spectra. The structure of collagen treated in 36℃ and 65℃ was damaged to a certain extent compared with the untreated collagen,and it could’t revert to the original structure. What’s more,the collagen of 36℃ treatment had a better denaturation than that of 65℃ treatment. The research can provide theoretical basis for the use of channel catfish skin collagen(CCSC).
channel catfish skin;collagen;denaturation temperature;shrinkage temperature;renaturation
2013-05-31
王立慧(1987-),男,硕士研究生,研究方向:食品加工装备技术。
江苏省科技型创新资金项目(BC2010031)。
TS254.9
:A
:1002-0306(2014)01-0070-04
