过敏性紫癜患儿血浆 IL-2、IFN-γ、IL-4 与TGF-β1的变化及其意义
2014-09-20吴容,王强,董巍
吴 容,王 强,董 巍
(1.四川省岳池县人民医院儿科,四川 岳池 638399;2.四川省医学科学院·四川省人民医院a.儿科,b.临床医学中心实验室,四川 成都 610072)
过敏性紫癜(henoch-schonlein purpura,HSP)是儿童时期最常见的出血性疾病之一,也是儿童时期最常见的一种自身免疫性血管炎性疾病。近年来该病的发生率呈逐年上升趋势。其确切病因及发病机制尚目前未完全阐明,但主要的病理机制目前仍公认为是免疫应答机制介导的血管炎[1]。有关细胞因子在其发病机制中的作用近年来引人关注。本研究通过检测HSP急性期患儿血浆白细胞介素-2(IL-2)、干扰素-γ(IFN-γ)、白细胞介素-4(IL-4)、转化生长因子β1(TGF-β1)水平,旨在探讨其在HSP发病中的变化及其意义。
1 对象与方法
1.1 研究对象 四川省人民医院儿科2009年2月至2010年2月收治的初诊HSP患儿46例(HSP组),符合2008年欧洲疾病防治委员会和欧洲儿童肾脏病防治委员会对HSP的诊断标准[2]以及2009年中华医学会儿科分会对紫癜性肾炎的诊治循证指南(试行)[3],均为首次发病,近4周未用过糖皮质激素及其他免疫抑制剂,采血前24小时未用过任何药物且排除其他疾病,年龄2~13岁[(7.94±2.93)岁],男27例,女19例。其中单纯皮肤紫癜8例,皮肤紫癜合并胃肠道症状10例,皮肤紫癜合并关节症状15例,皮肤紫癜同时合并胃肠道症状及关节症状4例,紫癜肾炎9例。同期四川省人民医院儿童保健门诊常规体检的30名健康儿童(对照组),无过敏性疾病及免疫性疾病史,年龄3~13岁[7.25±2.12)岁],男19例,女11例。两组儿童家长均知情同意,患儿年龄、性别比较差异无统计学意义(P>0.05)。
1.2 方法 HSP患儿初诊时外周血标本的采集:经拟诊过HSP患儿的法定监护人同意后,进行抽血检查,每份抗凝血标本约3 ml,1500转/分离心5分钟收集血浆,-70℃冻存备用。对照组儿童外周抗凝血标本的采集:方法同上。应用Luminex-100试剂盒 IL-2、IL-4、IFN-γ(Millipore USA),采用 Luminex-100液相芯片技术检测血浆细胞因子IL-2、IL-4、IFN-γ水平。人TGF-βELISA试剂盒(欣博盛生物科技有限公司),采用双抗体夹心ABC-ELISA法检测血浆细胞因子TGF-β1水平。
1.3 统计学方法 采用SPSS 16.0统计学软件进行分析,计量资料以均数±标准差表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
HSP组血浆细胞因子IL-2、IFN-γ水平均低于对照组,IL-4、TGF-β1表达水平高于对照组,差异均有统计学意义(P<0.05),见表1。
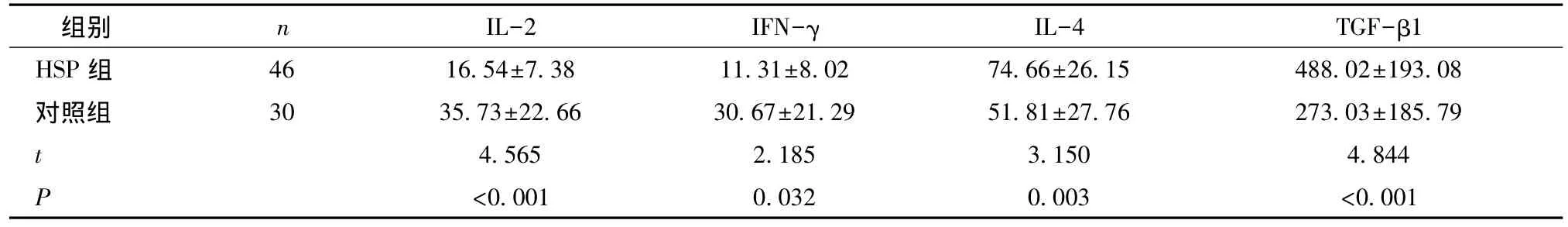
表1 两组 IL-2、IFN-γ、IL-4、TGF-β1 水平比较 (pg/ml)
3 讨论
本研究结果显示:HSP患儿急性期Th1类细胞因子IL-2、IFN-γ水平降低,Th2类细胞因子 IL-4水平增高,与对照组比较差异有统计学意义(P<0.05)。提示HSP患儿急性期存在Th1/Th2失衡,Th2优势活化,与文献报道一致[6~10]。HSP患儿急性期存在Th1和Th2失衡,主要为Th2的优势活化,导致其分泌的细胞因子IL-4、IL-6增多,IL-4可促进多克隆B细胞活化、增殖并大量合成、分泌特异性IgE抗体,产生循环免疫复合物沉积于血管壁引起炎症反应,IL-6亦能活化B细胞,产生大量的IgE和IgA,形成免疫复合物引起血管炎;而Th1减少,其分泌的细胞因子IL-2、INF-γ水平明显降低,INF-γ可拮抗IL-4诱导的 B 淋巴细胞活化[11],IL-2水平降低,使CTL和NK细胞等的功能降低,从而抑制B细胞活化、增殖的作用减弱,对外来抗原的清除能力明显下降,从而出现异常的免疫应答引起免疫损伤[6~9]。
TGF-β是一类具有激素样活性的多肽,一般认为它是负性免疫调节因子,抑制或下调Th1/Th2功能,TGF-β在维持机体免疫平衡中起重要的作用。本研究结果显示HSP急性期TGF-β1水平明显高于对照组,差异有统计学意义(P<0.05)。与国内外文献报道一致[10,12~17]。在 Th1/Th2 失衡的情况下,Th2优势活化,导致Th2类细胞因子分泌增加,体内的TGF-β1升高可能为体内出现保护性(或调节性)Th3功能增强所致,以抑制Th2的活化,纠正Th1/Th2失衡。研究表明TGF-β能刺激IgA的产生,参与了免疫复合物的形成及血管炎的发生[1]。过度表达能促进系膜细胞增生及细胞外基质沉积,使其生成增多,分解减少,导致肾小球硬化;促进成纤维细胞的增殖,加速肾组织纤维化[17]。但目前国内也有不一致的报道[6,18]。有关 TGF-β1 在 HSP发病中的作用有待进一步研究。
[1] 杨华彬,易著文.过敏性紫癜肾炎病因及发病机制[J].中国实用儿科杂志,2009,24(2):103-105.
[2] Ozen S,Fuhlbrigge RC.Update in paediatric vasculitis[J].Best Pract Res Clin Rheumatol,2009,23(5):679-688.
[3] 中华医学会儿科学分会肾脏病学组.儿童常见肾脏疾病诊治循证指南(二)紫癜性肾炎的诊治循证指南(试行)[J].中华儿科杂志,2009,47(12):911-913.
[4] Saito S,Nakashima A,Shima T,et al.Th1/Th2/Th17 and regulatory T-cell paradigm in pregnancy[J].Am J Reprod Immunol,2010,63(6):601-610.
[5] Xiang L,Marshall GD.Immunomodulatory effects of in vitro stress hormones on FoxP3,Th1/Th2 cytokine and costimulatory molecule mRNA expression in human peripheral blood mononuclear cells[J].Neuro immunomodu-ation,2011,18(1):67-72.
[6] 杨军,李成荣,祖莹,等.调节性T细胞在儿童过敏性紫癜发病机制中的作用初探[J].中华儿科杂志,2006,44(6):114.
[7] 李晓红,张梅梅.过敏性紫癜患儿急性期免疫功能状态的研究[J].医药论坛杂志,2010,31(2):5-6.
[8] 余艳红,潘凯丽.细胞因子在过敏性紫癜肾炎发病机中的作用[J].医学研究杂志,2008,37(1):100-102.
[9] 谢海棠,张剑白.过敏性紫癜的免疫生物学研究进展[J].内蒙古民族大学学报(自然科学版),2009,24(4):453-456.
[10] 郭在培,杨翠霞.过敏性紫癜免疫及遗传异常研究进展[J].实用医院临床杂志,2006,3(2):6-8.
[11] Del Vecchio.Cytokine pattern and endothelium damage markers in Henoch-Schonlein purpura[J].Immunopharmacol Immunotoxicol,2008,30(3):623-629.
[12] Yang YH,Chuang YH,Wang LC,et al.The immuno-biology of Henoch-Schonlein purpura[J].Autoimmun Rev,2008,7(3):179 -184.
[13] Seo GY,Youn J,Kim PH.IL-21 ensures TGF-beta1-induced IgA isotype expression in mouse Peyer's patches[J].J Leukoc Biol,2009,85(5):744-750.
[14] 章高平,党西强,易著文,等.肥大细胞在过敏性紫癜肾炎患儿肾间质纤维化中的作用[J].中国当代儿科杂志,2007,9(2):125-128.
[15] 王兰英,张慧玉,岳爱红.过敏性紫癜患儿血、尿TGF-β1检测及临床意义[J].现代预防医学,2010,37(7):1257-1259.
[16] 王强,董巍.血管内皮生长因子和转化生长因子β1在儿童过敏性紫癜中的作用探讨[J].实用医院临床杂志,2006,3(6):34-35.
[17] 赵梅青,赵洪国.过敏性紫癜病人血清TGF-β1和HGF水平的变化[J].齐鲁医学杂志,2011,26(6):514-515.
[18] 杨军李,成荣,王国兵,等.Th17细胞与CD4+CD25+调节性T细胞在儿童过敏性紫癜发病机制中的作用[J].临床儿科杂志,2009,27(7):645-647.
