组织块法和酶消化法培养大鼠颌下腺细胞的比较研究
2014-09-18王雪红张华炎汪义菲韩立赤
王 蕾,王雪红,张华炎,汪义菲,熊 永,韩立赤
(大连大学 医学院,辽宁 大连 116622)
0 引言
位于颌下三角的颌下腺是三大唾液腺之一,属混合性腺。其主要功能是产生和分泌涎液,为无刺激状态下涎液分泌的主要来源[1]。头颈部恶性肿瘤放疗及其他非肿瘤性颌下腺疾病均涉及到腺体结构和功能的损伤,导致口干、咀嚼吞咽困难和语言障碍等,严重影响患者的健康和生活质量。组织工程重建颌下腺是目前极具前景的治疗手段,如何有效地获得大量颌下腺细胞,进而深入探讨颌下腺的生理和病理机制,是需要解决的关键问题。本实验通过比较组织块法和酶消化法原代培养大鼠乳鼠颌下腺细胞的优劣,寻求一种最佳的颌下腺细胞体外培养方法,为涎腺非肿瘤疾病的防治研究提供实验基础。
1 材料和方法
1.1 实验材料及主要仪器设备
新出生3~5天Wistar大鼠乳鼠(大连大学动物中心),净化工作台(上海新苗医疗器械制造有限公司),CO2培养箱(Thermo Scientific,美国),倒置显微镜(Olympus,日本),低速离心机(安徽中科中佳科学仪器有限公司),胰酶(Hyclone,美国),DMEM高糖培养液(Hyclone,美国),PBS缓冲液,优质胎牛血清(Hyclone,美国),羊抗小鼠Cytokeratin-8单克隆抗体(Santa Cruz,美国)。
1.2 研究方法
1.2.1 组织块法培养大鼠乳鼠颌下腺细胞
选择健康大鼠乳鼠,在超净台内取颌下腺,在PBS缓冲液中去除颌下腺包膜及血管,并漂洗3次;在培养皿中将颌下腺剪切成1 mm3小块,剪切过程中适当向组织块滴加1~2滴DMEM高糖无血清培养液,以保持湿润;用眼科剪将剪切好的20~30块组织送入血清包被的培养瓶中,组织块间距约5 mm;放置后,缓慢翻转培养瓶,瓶底朝上,将培养瓶倾斜放置于培养箱中;4 h后,培养瓶缓慢翻转后平放,在净化工作台内加入5 mL DMEM高糖培养液以覆盖组织块,于培养箱中静置培养。
1.2.2 酶消化法培养大鼠乳鼠颌下腺细胞
选择健康大鼠乳鼠,超净台内取颌下腺,PBS洗3次;将组织块移入2 mL EP管,剪切成糊状,加入1 mL消化液(无血清培养液0.5 mL+0.25%胰酶0.5 mL);放入培养箱中,消化40 min,每10 min振荡一次;消化结束,重悬细胞,移入10 mL离心管,向离心管中加入3 mLDMEM高糖培养液,800 rpm,5 min离心;弃上清,加入3 mL培养液重悬细胞,接种于培养瓶,DMEM高糖培养液补足至5 mL;将培养瓶放于培养箱中静置培养。
1.2.3 细胞的传代培养
细胞覆盖瓶底80%以上时,即可进行细胞传代。①弃去旧培养液,加入0.25%的胰酶1 mL消化2 min,再用3 mLDMEM高糖培养液终止消化;②用毛滴管吹打重悬细胞,将其移入到10 mL的离心管中,1000 rpm,5 min离心;③弃上清,加入3 mL的培养液重悬细胞,彻底吹打离心管壁和底部,充分重悬;④将重悬液平均移入3个培养瓶中,分别补足DMEM高糖培养液至5 mL,放入培养箱中继续培养。
1.3 观察细胞生长情况
利用倒置显微镜连续观察原代和传代细胞的生长情况,并拍照记录。
1.4 细胞来源鉴定
取第二代细胞,爬片,4%多聚甲醛室温固定20 min,PBS冲洗后用0.2%Triton X-100透化15 min,PBS冲洗,0.3%H2O2室温孵育30 min阻断内源过氧化物酶,再用PBS冲洗,20%的马血清室温封闭20 min后加入细胞角蛋白-8,置湿盒中4°C过夜。经PBS冲洗后加入生物素标记的二抗室温孵育2 h,PBS冲洗后加入辣根酶标记的三抗室温孵育 30 min,PBS冲洗后用DAB显色,镜下控制反应强度,PBS冲洗后甘油封片。
2 结果
2.1 形态学观察结果
组织块法原代培养2天后,少量细胞从组织块中游离出来,不均匀分布;3天后,组织块周围游离出较多细胞,以组织块为中心呈放射状排列分布,初步形成了腺泡、腺管样结构,但覆盖范围较小,不能进行传代。酶消化法原代培养2天后,约3/4的培养瓶底部覆盖了大量分布不均的细胞;4天后,细胞完全覆盖整个培养瓶底,并出现复层生长,形成了腺泡、腺管样结构,可传代培养。
传代后,两种方法获得的细胞均出现了3种形态。第一种为圆亮、界限清晰且无胞质突起的圆形亮细胞;第二种为扁平、数量及胞质突起均较多的多角形暗细胞,相互聚集形成腺泡、腺管样结构;第三种为数量少、界限清晰的梭形暗细胞。传代2天后,组织块法培养的细胞数量较少,贴壁较差;酶消化法培养的细胞贴壁情况好,数量较多,生长情况较好。

图1 组织块法和酶消化法原代培养颌下腺细胞

图2 组织块法和酶消化法传代培养颌下腺细胞
2.2 RSGC的鉴定结果
镜下见细胞角蛋白-8免疫细胞化学染色呈阳性。细胞呈立方形、三角形或多边形。细胞伸展良好,胞核蓝染偏向一侧,核仁1~2个,胞质呈棕黄色,核膜及包膜清晰,部分细胞中可见深染细小颗粒状物质。细胞团块中部黄染较强,周边减弱,提示为上皮细胞来源。阴性对照组中细胞形态同上述,胞质呈淡蓝色,胞核蓝染偏向一侧,核仁1~2个,部分细胞中亦可见深染细小颗粒状物质。
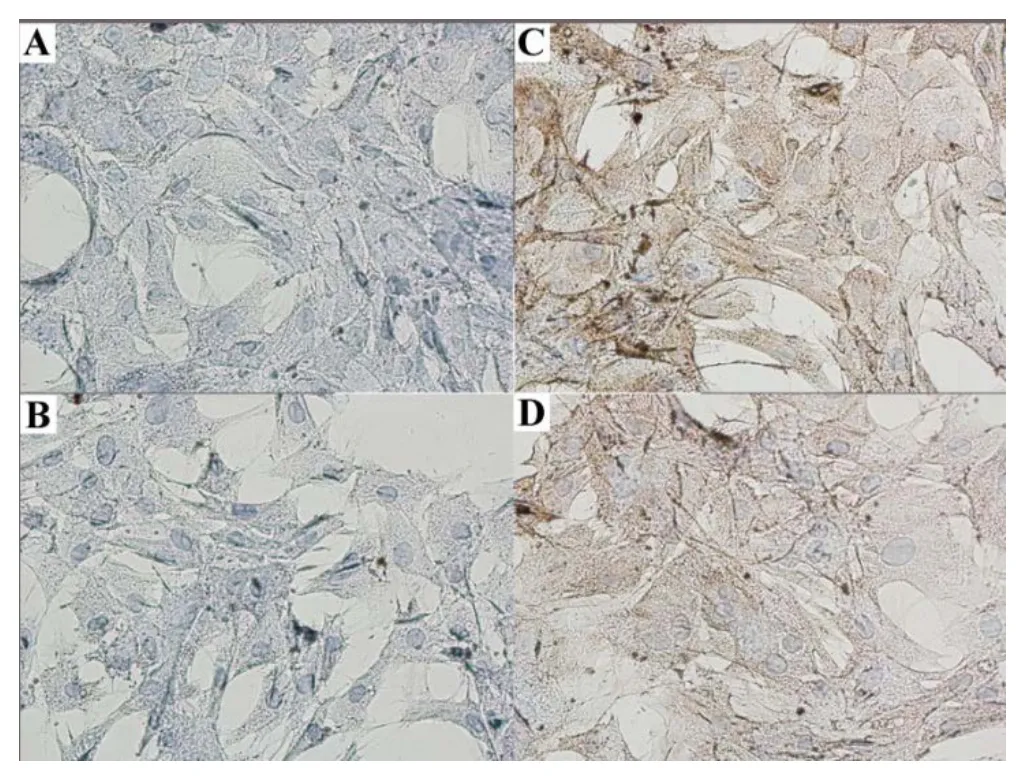
图3 DAB染色
3 讨论
舍格伦综合征、放射性涎腺炎、药物过敏及其他自身免疫疾病等原因造成的涎腺分泌功能严重损害十分常见,给人们的健康带来很大影响。20世纪80年代后期提出“组织工程”概念后,其原理和方法已广泛应用于骨、软骨、皮肤和肌腱等组织及器官的再造,并取得了令人瞩目的成就。随着颌下腺组织工程的发展,在再造涎腺的研究中, 对于细胞的来源及增殖能力提出要求[2,3],如何成功培养颌下腺细胞变得至关重要。
大鼠颌下腺在出生时并未发育完全,颌下腺细胞在出生后继续分化增殖[4]。Oliver等[5]成功分离、培养了涎腺细胞,在体外培养存活达 4周以上。Burford-Mason等[6]取新生乳鼠颌下腺组织进行体外培养,新生乳鼠细胞增殖能力强,细胞可保持较长时间的稳定性。国内学者刘超等[7]取1天的乳鼠,罗小宁[8]等用8天的乳鼠培养颌下腺细胞,均成功培养传代。我们的实验中选择3~5天的乳鼠作为细胞取材对象。相较1天乳鼠的颌下腺过小而言,3~5天取材和去除筋膜更容易;又较8天乳鼠的细胞活性更强。
颌下腺细胞培养方法有组织块法和酶消化法,组织块法是将组织剪碎培养,酶消化法是利用胰蛋白酶消化细胞间质,使颌下腺细胞分离出来。组织块法操作简单,但是细胞要从组织块中游离生长,原代细胞培养时间相对较长。胰酶消化法可获得大量的细胞,但过度消化细胞会给细胞带来较大的伤害[9]。在实验中我们对组织块法培养的细胞在剪切过程中尽量剪切更细小,并向组织块滴加1~2滴DMEM高糖无血清培养液,以保持湿润以利于维持组织的活性。在铺瓶时用眼科剪将剪切好的 20~30块组织送入血清包被的培养瓶中,组织块间距约5 mm,保证更多的生长中心,且均匀分布。在酶消化法中,保证颌下腺剪切成糊状,并直接放于 CO2孵箱孵育,使其保持在37℃的环境中;孵育40 min,每间隔10 min震荡一次,振荡频率降低,使消化更充分。离心后未完全弃掉上清,留约1 mL上清液,避免过多细胞丢失。
本实验采用组织块法和酶消化法两种方法原代培养大鼠乳鼠颌下腺细胞。组织块法操作简单,用时短,成功率高,但经该法培养后发现,原代细胞贴壁能力差,生长周期长,且分布不均,经过1:3传代后,所获细胞少,需经较长时间才能覆盖培养瓶底,难以在短期内获得大量颌下腺细胞。酶消化法虽操作较复杂,但贴壁情况较好,细胞数量多,分布均匀,且增殖较快。原代培养3天后即可传代培养,经过1:3传代后,细胞数量依然较多,贴壁情况好,2天后细胞可覆盖培养瓶底,短期内可获得大量颌下腺细胞。
颌下腺细胞的鉴定主要通过免疫细胞化学染色法。上皮细胞用于鉴定的抗原一般为细胞角蛋白和波形丝蛋白,腺上皮细胞对细胞角蛋白表现出免疫反应性,而肌上皮细胞则对波形丝蛋白表现免疫反应性。本实验两种方法培养出的颌下腺细胞免疫细胞化学细胞角蛋白-8染色均呈阳性表达,提示为上皮细胞来源。
颌下腺细胞体外培养具有重要的生物学及临床意义。确定一种合理且高效的体外细胞分离与培养方法,对于涎腺疾病的研究及诸多与其相关的离体实验,如基因转染、药物作用等各方面的研究有着非常重要的价值。本实验研究发现,酶消化法和组织块法均可获得3种类型的细胞,传代后在细胞特征上也无特殊差异,但酶消化法短期内可获得大量颌下腺细胞。因此,酶消化法是一种较实用的培养大鼠乳鼠颌下腺细胞的方法。
[1]于世凤. 口腔组织病理学[M]. 北京: 人民卫生出版社,2007.
[2]Joraku A, Sullivan CA, Yoo JJ, et al. Tissue engineering of functional salivary gland tissue [J]. Laryngoscope, 2005, 115(2): 244-248.
[3]Tran SD, Wang J, Bandyopadhyay BC, et al. Primary culture of polarized human salivary epithelial cells for use in developing an artificial salivary gland [J]. Tissue Eng, 2005,11(1-2): 172-181.
[4]Taga R, Pardini LC. Growth of cell populations of the intralobular duct in the submandibular gland of the mouse during postnatal development [J]. Pesqui Odontol Bras, 2002,16(4): 285-291.
[5]Oliver C. Isolation and maintenance of differentiated exocrine acinar cells in vitro [J]. In Vitro, 1980, 16(4): 297-305.
[6]Burford-Mason AP, Cummins MM, Brown DH, et al.Immunohistochemical analysis of the proliferative capacity of duct and acinar cells during ligation-induced atrophy and subsequent regeneration of rat parotid gland [J]. J Oral Pathol Med, 1993, 22(10): 440-446.
[7]刘超, 苗雷英, 孙宏晨, 等. 大鼠颌下腺细胞培养方法建立及生物学特性研究[J]. 吉林大学学报: 医学版, 2009, 35(2): 218-221.
[8]罗小宁, 黄晓明, 孙伟, 等. SD大鼠颌下腺腺泡细胞培养及胶原海绵的细胞相容性[J]. 中山大学学报: 医学科学版,2009, 30(2): 160-164.
[9]张琦, 胡建石, 林玲, 等. 体外培养的神经干细胞球几种离散方法的探讨[J]. 中华神经医学杂志, 2004, 3(6):404-407.
