蓝藻素经Nrf 2/HO-1发挥对阿霉素心肌损伤大鼠的保护作用
2014-09-18罗湘玉罗卫民郑雪松张军
罗湘玉,罗卫民,郑雪松,张军
(湖北医药学院附属太和医院 胸心外科,湖北 十堰 442000)
蓝藻素经Nrf 2/HO-1发挥对阿霉素心肌损伤大鼠的保护作用
罗湘玉,罗卫民Δ,郑雪松,张军
(湖北医药学院附属太和医院 胸心外科,湖北 十堰 442000)
目的观察血红素氧合酶-1(heme oxygenase-1,HO-1)在藻蓝素(C-phycocyanin,CPC)对阿霉素(Doxorubicin,DOX)致大鼠心肌毒性的保护作用中的作用。方法60只SD大鼠随机分为空白对照组(n=15)、DOX组(n=15)和CPC干预组(n=15)及HO-1抑制剂锡原卟啉Ⅸ(tin protoporphyrin IX,SnPP)组(n=15)。空白对照组仅给予等体积生理盐水,模型组采用DOX腹腔注射,使其2周内累计剂量达15 mg/kg。CPC干预组在模型组基础上腹腔注射浓度为20、40、60 mg/kg 的CPC。处理结束后,比色法测定血清肌酸激酶(creatine kinase,CK)和乳酸脱氢酶(lactate dehydrogenase,LDH)的活性,同时测量心肌组织HO-1和caspase-3的活性;Western blot检测心肌组织中HO-1的表达以及Nrf2的激活。结果与对照组相比,DOX组小鼠血清中CK、LDH和caspase-3活性显著增高(P<0.05),而心肌组织中HO-1活性仅轻度增高。CPC处理可明显抑制阿霉素心肌损伤大鼠中CK、LDH和caspase-3活性,并显著上调HO-1活性及蛋白表达水平。而SnPP处理后,与CPC组相比,大鼠血清CK、LDH以及caspase-3活性显著降低。此外,CPC明显促进核转录因子Nrf2的激活。结论CPC对阿霉素心肌损伤大鼠的保护机制可能是通过激活Nrf2并诱导HO-1表达有关。
蓝藻素;阿霉素;血红素氧合酶1
1 材料与方法
1.1 主要实验试剂 DOX购自意大利Pharmacia公司(批号:8 NB 002-A),CPC为Sigma-Aldrich产品(纯度均98%)。血清乳酸脱氢酶(lactate dehydrogenase,LDH)和肌酸激酶(creatine kinase,CK)试剂盒为Stanbio产品。心肌caspase-3的比色测定试剂盒购自Quantikine。HO-1,Nrf2以及TATA盒结合蛋白(TATA binding protein,TBP)多克隆抗体购自Santa Cruz。SnPP和其他分析纯试剂主要购自Sigma-Aldrich公司。主要实验仪器:酶标仪(iMark,BIORAD),离心机(5418,Eppendorf),半干转印仪(Trans-Blot,Bio-Rad)
1.2 实验分组 成年雄性Wistar大鼠由湖北医药学院实验动物部提供(合格证号:13061015),体重(250±5)g,在 SPF环境下给予标准实验室的水和食物饲养2周。大鼠随机分成4组(每组15只),如下:组1为对照组,大鼠接受等体积的生理盐水作为阴性对照;组2为DOX组,大鼠连续2周每间隔48 h注射 DOX(2.5 mg/kg,ip.)共6次,使其累积剂量达15 mg/kg。组3为CPC治疗组,在组2的基础上,大鼠每日给予CPC(20,40,60 mg/kg)灌胃, DOX停止后,持续CPC灌胃4周。组4为SnPP干预组,在组3基础上,给予20 μmol/kg SnPP腹腔注射,每周3次,持续时间同组3。
1.3 血清CK和LDH活性的测定 采用分光光度计在波长340 nm处测量CK-MB的吸光度。LDH的测量按照Stanbio公司提供的诊断试剂盒进行,计算血清总LDH的活性(U/L)。
1.4 心肌HO-1活性测定 将获取的心肌组织匀浆18000×g 4℃离心10 min,获取400 μL上清加到反应混合物中(含0.8 mmol/L NADPH、2 mmol/L葡糖糖-6-磷酸盐、0.2 U葡糖糖6磷酸盐-1脱氢酶、2 mg大鼠肝脏胞浆、100 mmol/L PBS以及10 μmol/L氯化血红素)。反应在黑暗的环境中37℃孵育1 h后加入1mL氯仿终止反应。并在463 nm和530 nm双波长测吸光度值(胆红素吸光系数为40),以生成的胆红素量表示HO-1活性,单位为nmol/(mg protein·h),并计算其与对照组的相对值。
1.5 caspase-3活性测定 50 mg心肌组织加入0.8 mL pH 7.4的裂解缓冲液中制成匀浆。10000 g 4℃离心15 min。获取上清用于caspase-3测定。采用间接法测定caspase-3活性,基于caspase-3切除底物分子DEVD-pNA中的发光基团pNA,随后在405 nm处用测量其吸光度,从而间接反应其活性。
1.6 Western blot检测HO-1表达以及Nrf2核转位 根据试剂盒(Pierce)提供的步骤提取心肌组织中的总蛋白和核蛋白,并测定其浓度。获取100 μg蛋白用于SDS-PAGE。分离的总蛋白或核蛋白随后转印至PVDF膜上(Millipore),并利用含有质量分数为5%脱脂牛奶的TBST封闭1 h,随后加入-抗、抗 HO-1(1∶500)、β-actin(1∶5000)、抗 Nrf 2(1∶1000),抗TBP(1∶1000)的抗体4℃孵育过夜。多次洗涤之后,加入HRP标记的二抗(1∶10000稀释)孵育膜1 h。ECL法(Amersham)发光、显影。
1.7 统计学方法 应用SPSS 17.0软件进行统计学分析,正态计量数据用“±s”表示,并采用单因素方差分析数据,以P<0.05为差异具有统计学意义。
2 结果
2.1 CPC对血清CK-MB和LDH水平的影响 与正常组相比,DOX可导致血清LDH和CK-MB增高(P<0.01);与DOX处理组相比,CPC可导致血清LDH和CK-MB水平显著降低(见表1),而SnPP处理组中LDH和CK-MB水平显著高于CPC组(P<0.05),但与DOX组相比差异无统计学意义。

表1 CPC对血清CK和LDH水平的影响Tab.1 Effect of CPC on the concentration of CK and LDH
2.2 CPC对心肌HO-1活性的影响 DOX处理后,与对照组大鼠相比,心肌组织中HO-1酶活性轻微增高。而经60 mg/kg CPC处理后,HO-1酶活性显著增高。而同时用SnPP处理后,HO-1酶活性显著低于CPC组,但仍高于对照组(见图1)。
2.3 CPC对caspase-3活性的影响 DOX处理后,心肌组织中caspase-3活性增加了55%。同时经60 mg/kg CPC处理后,caspase-3活性有所降低,而SnPP处理能再次上调caspase-3的活性(见图2)。
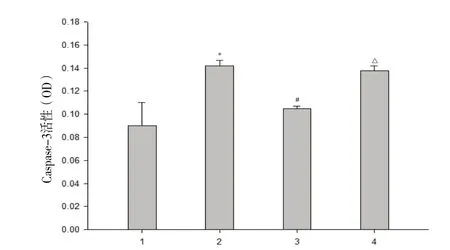
图2 CPC对caspase-3活性的影响1. 阴性对照组;2. DOX组;3. DOX+60 mg/kg CPC组;4. DOX+60 mg/kg CPC+SnPP组*P<0.05,与对照组相比;﹟P<0.05与DOX组相比;△P>0.05,与 DOX+60 mg/kg CPC 组相比Fig.2 Effect of CPC on caspase-3 activity in myocardial tissues1. Control group;2. DOX group;3. DOX+60 mg/kg CPC group;4. DOX+60 mg/kg CPC+SnPP group*P<0.05,compared with control group;﹟P<0.05,compared with DOX group group;△P<0.05,compared with DOX+60 mg/kg CPC group
2.4 CPC对心肌组织中HO-1表达的影响 与对照组相比,DOX大鼠心肌组织中HO-1蛋白表达水平有轻微增高,而经CPC处理后,HO-1表达进一步增强(见图3)。SnPP处理能再次降低HO-1的表达。而内参β-actin含量保持一致。

图3 CPC对DOX心肌毒性大鼠HO-1表达的影响1. 阴性对照组;2. DOX组;3. DOX+60 mg/kg CPC组;4. DOX+60 mg/kg CPC+SnPP组Fig.3 Effect of CPC on HO-1 expression in DOX-induced myocardial injury rats1. Control group;2. DOX group;3. DOX+60 mg/kg CPC group;4. DOX+60 mg/kg CPC+SnPP group
2.5 CPC对转录因子Nrf2活化的影响 Westernblot结果显示,DOX大鼠心肌组织内细胞核中Nrf2含量与对照组相比增高不明显,而CPC处理后,Nrf2转位水平显著增多,而核内参TBP含量始终维持不变。表明CPC能促进Nrf2从细胞浆转移至细胞核中(见图4)。

图4 CPC对DOX心肌毒性大鼠Nrf2核转位的影响1. 阴性对照组;2. DOX组;3. DOX+60 mg/kg CPC组;Fig.4 Effect of CPC on Nrf 2 translocation in DOX-induced myocardial injury rats1. Control group;2. DOX group;3. DOX+60 mg/kg CPC group
3 讨论
DOX是一种是作用于DNA的蒽环类抗生素,它能够对DNA发生嵌入作用,在临床中应用广泛。阿霉素的急性副作用包括恶心、呕吐和心律不整。长期使用后,在线粒体氧化磷酸化作用下,阿霉素和铁相互作用产生大量活性氧,可以破坏心肌,造成肌原纤维损伤或凋亡[6-7]。HO-1是催化血红素降解为CO、亚铁离子和胆红素的限速酶,并在机体的抗炎症、抗氧化损伤中发挥重要作用[8],本研究显示,DOX毒性大鼠经CPC处理后,可显著上调HO-1的酶活性以及其蛋白表达。HO-1基因的启动子区域含有转录因子Nrf2的结合位点,本研究也证实CPC能诱导Nrf2从细胞浆转位至细胞核,从而激活Nrf2诱导HO-1表达。
Nrf2是机体一种重要的获得性保护性核转录因子。在非激活情况下,Nrf2通过与抑制物keap1结合于细胞质内。当细胞受到外源性刺激时,Nrf2从keap1中分离出来,转移至细胞核内,从而与应激诱导性基因包括HO-1的启动子区域的抗氧化剂应答元件结合[9]。本研究发现CPC处理后,Nrf2转位增加,这与心肌组织中HO-1蛋白表达以及酶活性的趋势一致,表明CPC诱导HO-1的表达可能是由于Nrf2的活化所致。HO-1发挥对细胞保护作用,主要通过它的3种产物——CO、胆红素和Fe2+而实现的。CO是一种类似于NO的重要神经递质。它通过自分泌或旁分泌的方式作用于效应的效应细胞,催化GTP生成cGMP。cGMP通过激活相应的蛋白激酶、磷酸二酯酶(phosphodiesterase)或调节离子通道而发挥相应的生理功能[10]。胆红素也是一种比维生素E和维生素C还强的抗氧化剂,它不但可直接与自由基反应,同时也能结合单线态氧从而预防烃类的光氧化作用。Fe2+可以诱导铁蛋白的合成,后者可减少细胞内游离铁的蓄积而发挥保护作用,以此对抗ROS导致的细胞损伤[11-12]。为了进一步评价HO-1在CPC的保护效应中的作用,在干预过程中加入SnPP,对CPC的保护作用进行了分析。结果表明,DOX模型大鼠血清LDH和CK-MB显著增高,而经CPC处理后,这些心肌损伤指标显著降低。同时给予SnPP处理后,能显著逆转CPC的保护效应。这表明CPC是通过上调HO-1蛋白的表达并上调其酶活性,从而发挥对心肌细胞的保护作用。
DOX致心肌细胞损伤的机制很多,包括离子和自由基假说、代谢机制和凋亡机制。心肌细胞是终末分化细胞,多种抗肿瘤药物可引起其坏死或凋亡,从而引起心肌细胞减少而导致心脏收缩功能不足[13]。研究显示,DOX可通过内源性和外源性机制引起心肌细胞凋亡,最终激活下游caspase-3,6和7。一旦caspase被激活,细胞即进入凋亡执行阶段[14-15]。本研究发现,CPC可抑制DOX引发的caspase-3激活,而HO-1抑制剂SnPP处理后,caspase-3活性再次增高,这表明HO-1能在一定程度上削弱DOX的促凋亡效应,最终抑制DOX引起的心肌细胞凋亡、坏死及心肌纤维化。
综上所述,本研究认为CPC可以促进Nrf2核转位,从而诱导心肌组织内HO-1表达上调,增强其酶活性,进而通过HO-1对DOX导致的心肌细胞凋亡产生抑制作用。
[1] Gandhi H,Patel VB,Mistry N,et al.Doxorubicin mediated cardiotoxicity in rats:Protective role of felodipine on cardiac indices[J].Environ ToxicolPharmacol,2013,36(3):787-795.
[2] Gilliam LA,Moylan JS,Patterson EW,et al.Doxorubicin acts via mitochondrial ROS to stimulate catabolism in C2 C 12 myotubes[J].Am J Physiol Cell Physiol,2012,302(1):195-202.
[3] Uma MB,Shrivastava S,Kuncha M,et al.Ethanolic extract of Boswellia ovalifoliolata bark and leaf attenuates doxorubicin-induced cardiotoxicity in mice[J].Environ Toxicol Pharmacol,2013,36(3):840-849.
[4] Qu Y,Zheng S,Lin L,et al.Protective effect of C-phycocyanin against carbon tetrachloride-induced hepatocyte damage in vitro and in vivo[J].Chem Biol Interact,2010,185(2):94-100.
[5] Gupta M,Dwivedi UN,Khandelwal S.C-Phycocyanin:an effective protective agent against thymic atrophy by tributyltin[J].Toxicol Lett,2011,204(1):2-11.
[6] Bigotte L,Olsson Y.Distribution and toxic effects of intravenously injected epirubicin on the central nervous system of the mouse[J].Brain,1989,112(2):457-469.
[7] Wu W,Lee WL,Wu YY,et al.Expression of constitutively active phosphatidylinositol 3-kinase inhibits activation of caspase 3 and apoptosis of cardiac muscle cells[J].J Biol Chem,2000,275(51):40113-40119.
[8] Deshane J,Chen S,Caballero S,et al.Stromal cell-derived factor 1 promotes angiogenesis via a heme oxygenase 1-dependent mechanism[J].J Exp Med,2007,204(3):605-618.
[9] Zhang Z,Cui W,Li G,et al.Baicalein protects against 6-OHDA-induced neurotoxicity through activation of Keap1/Nrf2/HO-1 and involving PKCalpha and PI3K/AKT signaling pathways[J].J Agric Food Chem,2012,60(33):8171-8182.
[10] Kim SS,Lim J,Bang Y,et al.Licochalcone E activates Nrf 2/antioxidant response element signaling pathway in both neuronal and microglial cells: therapeutic relevance to neurodegenerative disease[J].J Nutr Biochem,2012,23(10):1314-1323.
[11] Frank RN,Amin RH,Puklin JE.Antioxidant enzymes in the macular retinal pigment epithelium of eyes with neovascular age-related macular degeneration[J].Am J Ophthalmol,1999,127(6):694-709.
[12] Sarady-Andrews JK,Liu F,Gallo D,et al.Biliverdin administration protects against endotoxin-induced acute lung injury in rats[J].Am J Physiol Lung Cell Mol Physiol,2005,289(6):1131-1137.
[13] Psaltis PJ,Carbone A,Nelson A,et al.An ovine model of toxic, nonischemic cardiomyopathy--assessment by cardiac magnetic resonance imaging[J].J Card Fail,2008,14(9):785-795.
[14] Pointon AV,Walker TM,Phillips KM,et al.Doxorubicin in vivo rapidly alters expression and translation of myocardial electron transport chain genes, leads to ATP loss and caspase 3 activation[J].PLoS One,2010,5(9):e 12733.
[15] Chang J,Xie M,Shah VR,et al.Activation of Rho-associated coiled-coil protein kinase 1 (ROCK-1) by caspase-3 cleavage plays an essential role in cardiac myocyte apoptosis[J].Proc Natl Acad Sci USA,2006,103(39):14495-14500.
C-phycocyanin protects doxorubicin-induced myocardial cells injury by Nrf 2/heme oxygenase-1 pathway
LUO Xiang-yu, LUO Wei-minΔ, ZENG Xue-song, ZHANG Jun
(Department of Cardiothoracic Surgery,Hubei University of Medicine Affiliated Taihe hospital of Shiyan, Shiyan, 442000 China)
Objective To observe the role of heme oxygenase (HO)-1 on the protective effect of C-phycocyanin (CPC) on doxorubicin (DOX)-induced myocardial cells injury by Nvf2/HO-1 pathway.Methods60 SD rats were randomly divided into control group, DOX group, CPC group and tin protoporphyrin IX (SnPP, an inhibitor of HO-1) group,each had 15 rats. The control group was injected with normal saline injection,while the DOX group was administrated with doxorubicin by intraperitoneal injection in a cumulative dose of 15 mg/kg for two weeks. For the CPC rats, 20, 40 and 60 mg/kg of CPC was administrated. The level of creatine kinase (CK) and lactate dehydrogenase (LDH) were detected, and the activity of HO-1 and caspase-3 were also examined. Expression of HO-1 and activation of Nrf 2 were detected by Western blot.ResultsCompared with control group, serum levels of CK, LDH and Caspase-3 activity in DOX group were significantly increased(P<0.05), but HO-1 in cardiac muscle was only increased slightly. upregulation. Treatment with CPC could significantly ameliorated the CK, LDH and Caspase-3 activity, and markedly induce HO-1 expression and its activity. The reduction of CK, LDH and Caspase-3 activity by CPC could be reversed by treatment of the HO-1 inhibitor, SnPP. Furthermore, CPC sould also induce Nrf 2 activation.ConclusionThe protective effect of CPC on doxorubicin-induced myocardial cells in jury via Nrf 2 induced HO-1 HO-1 expression.
C-phycocyanin;Doxorubicin;heme oxygenase-1
R 453.9
A
1005-1678(2014)02-0030-04
阿霉素(Doxorubicin,DOX)是一种广泛应用于肿瘤治疗的蒽环类抗生素,是临床上最有效的抗肿瘤药物之一。尽管其对包括白血病在内的多种恶性肿瘤具有抑制作用,但其蓄积性不可逆性心肌病以及充血性心衰限制了其使用[1]。DOX导致的毒性心肌病原因很多,其中活性氧(reactive oxygen species,ROS)、钙超载以及线粒体损伤介导的心肌细胞凋亡是其重要机制[2]。近年来,某些药用植物在DOX所致的心肌细胞损伤中发挥重要作用[3],如上调血红素氧合酶(Heme oxygenase-1,HO-1)的表达,从而发挥抗氧化、抗凋亡等作用。藻蓝素(C-phycocyanin,CPC)一种从螺旋藻提取、加工而成的天然食用色素,是一种营养价值极高的营养物质。并具有强大的抗氧化和清除自由基能力[4-5]。本课题组的前期研究结果显示,CPC对DOX诱发的心脏毒性具有一定的保护作用,但其机制尚未明了。本研究旨在观察HO-1在CPC心肌保护作用中的作用。
十堰市科技攻关项目(2009S48)
罗湘玉,女,副主任护师,研究方向:心肺疾病的防治研究,E-mail:xiangyu_luo@126.com;罗卫民,通信作者,男,硕士,主治医师,研究方向:胸心外科疾病的诊断与治疗,E-mail:weiminluo@163.com。
