戊四氮慢性致痫大鼠海马区PPARγmRNA的表达及神经细胞损伤的影响
2014-09-17陆晓红王国辉金玉玲
单 鹤,陆晓红,王国辉,刘 蕾,金玉玲
(佳木斯大学附属第一医院神经一科,黑龙江 佳木斯154003)
近年研究发现PPARγ受体与神经细胞的炎症和氧化应激有关,目前对其研究主要集中在急性脑缺血再灌注早期对神经系统的作用,本实验以戊四氮致痫大鼠为研究对象拟研究PPARγ受体表达变化在神经细胞损伤中的影响。
1.1 实验动物及分组
健康体重(180±10)g雄性SD大鼠,共40只(由大连医科大学动物实验中心提供动物质量合格证号:20131853P)。随机分为正常组,PTZ组(P)。
1.2 动物模型建立
上述5组动物除对照组外,均给予PTZ(35mg/kg,每日1次)腹腔注射,参照Morgan等的方法并略加改动[1]。PTZ用前以生理盐水新鲜配制成溶液(10g/L)。每天1次,持续28d;停药1周,再用相同剂量的PTZ腹腔注射测试。正常组给予等体积的生理盐水。
1.3 大鼠行为学观察
各组大鼠每日经上述处置后,均参考Racine[2]为观察行为变化的分级标准。癫痫大鼠发作的行为学变化的分级标准为:0级:正常行为状态;Ⅰ级:咀嚼、眨眼、立须等面部肌肉的抽搐,湿狗样颤动;Ⅱ级:以点头运动为主要表现的颈部肌肉的抽搐;Ⅲ级:前肢的阵挛、抽搐;Ⅳ级:双侧前肢伸直,伴有身体的立起;Ⅴ级:跌倒和全身惊厥。Ⅲ级以下为复杂部分发作,Ⅳ级和Ⅴ级为全身强直阵挛发作。注药后即进行行为学观察,凡出现连续5次Ⅱ级或Ⅱ级以上惊厥发作的大鼠为达到点燃标准的模型。3只未达上述标准淘汰,2只死亡。
实验结束后区全部大鼠给予10%水合氯醛深部麻醉于低温下迅速取脑,以备后续实验。
1.4 RT-PCR检测海马PPARγm RNA表达
海马50mg,TRIzol法抽提总RNA,逆转录合成cDNA,然后PCR扩增,引物序列在NCBI基因库中查找大鼠PPARγ序列,经同源比对后确定PPARγ及β-actin的引物序列(PPARγ上游引物:5'-CAGGAGCAGAGCAAAGAGGT-3';下游引物:5'GGCTCATATCTGTCTCCGTCT-3',长度 583bp;β-actin:上游 引物 5'-CATCCGTAAAGACCTCTATGCCAAC-3',下 游 引 物:5'-ATGGAGCCACCGATCCACA-3'长度173bp,引物由上海生工公司合成。扩增反应条件:95℃预变性3min;95℃30s,退火温度30s,60℃(PPARγ)/58℃(β-actin)30s,40个循环;72℃ 延伸10min。扩增产物经1%琼脂糖凝胶电泳,溴乙锭染色,凝胶成像仪成像。采用Quantity One凝胶图像分析软件分析结果,以PPARγ与,β-肌动蛋白(β-Actin)扩增产物光密度的比值反映表达水平。
1.5 尼氏染色海马神经元形态学观察
制作石蜡切片,对切片进行神经元尼氏染色观察各组大鼠海马神经元存活状态,神经元细胞的排列情况。
1.6 统计学处理
采用SPSS17.0统计软件进行统计分析,样本均数间比较用方差分析,实验结果以()表示,P<0.05为差异有统计学意义,P<0.01为差异有显著性意义。
2 结果
2.1 癫痫大鼠海马组织PPARγm RNA水平的变化
在mRNA水平,PPARγ在戊四氮致痫大鼠海马内表达显著低于正常组(P<0.01),在慢性癫痫形成24h(0.93±0.038)PPARγmRNA 表达下降 (P<0.05),并持续减少(48h:0.85±0.045,P<0.05),至72h(0.76±0.015)仅见微量表达,具有显著性(P<0.05)。见图1,表1。
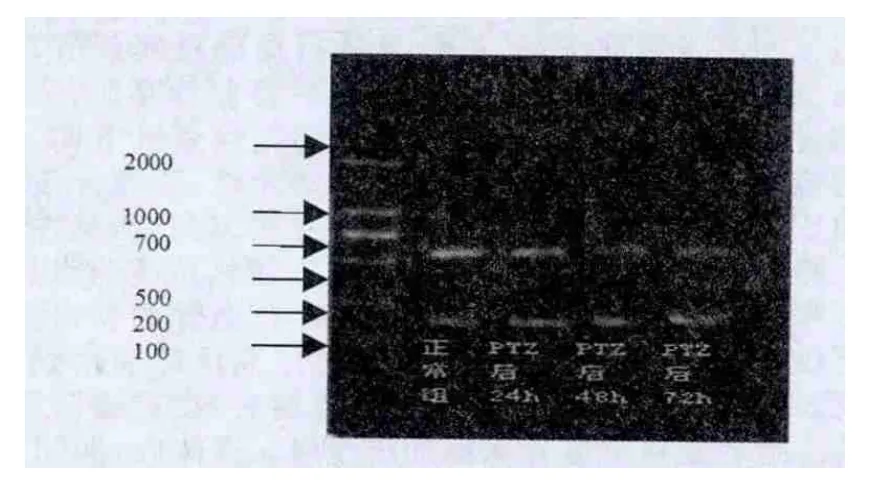
图1 不同组别大鼠视网膜PPARγm RNA表达
表1 不同组别大鼠海马PPARγ/β-actin相对灰度值比较()
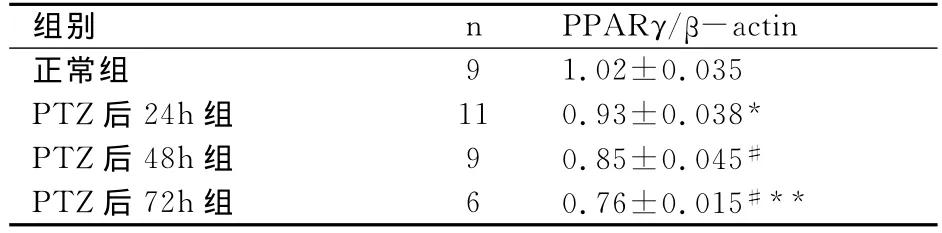
表1 不同组别大鼠海马PPARγ/β-actin相对灰度值比较()
注:*与正常组比较,P<0.01;# 与PTZ后48h组比较,P<0.05;** 与PTZ后72h组比较,P<0.05。
组别 n PPARγ/β-actin正常组9 1.02±0.035 PTZ后24h组 11 0.93±0.038*PTZ后48h组 9 0.85±0.045#PTZ后72h组 6 0.76±0.015#**
2.2 尼氏染色
在对照组大鼠海马区尼氏体清晰可见,排列整齐、规则,结构完整,体积较大,尼氏体核仁明显、胞浆丰富,轴突、树突清晰可辨,胶质细胞分散在海马神经元之间,呈星形或梭形,体积小、核圆形或卵圆形。癫痫各组大鼠海马区部分尼氏胞体减少,结构不清、胞浆减少,且着色浅,胶质细胞体积增大,数量增多。见如图2。

图2 正常组、PTZ后24h、PTZ后48h、PTZ后72h尼氏染色(×10)
3 讨论
癫痫至今尚无根治的办法,因此癫痫的治疗成为国内外研究的重点。目前的研究发现认为:①癫痫异常放电过程可以引起大脑广泛的神经病理生理学变化。②海马环路内的轴突出芽及突触重建是癫痫的主要的病理生理特征。近年来发现认为癫痫发作所引起的脑内炎性反应是导致癫痫发作后脑组织病理改变,特别是海马结构损伤(包括海马内神经元脱失、神经元凋亡、胶质细胞增生、纤维发芽、海马硬化等)的主要原因之一,各种癫痫模型的动物实验表明,癫痫的整个发病过程中都伴有免疫和炎症反应[3],癫痫发作后胶质增生,结构的紊乱,这一过程又进一步加重了兴奋性病灶的形成,癫痫脑损伤既是癫痫发作的结果,又是癫痫频发和难治的原因之一,有效控制癫痫发作、减少癫痫发作后神经元损伤,对癫痫发病机制的研究具有重要的理论和临床意义。
PPARγ(过氧化物酶体增殖物激活受体γ)在炎症、动脉粥样硬化、胰岛素抵抗、糖代谢、肿瘤中有重要的调节作用。PPARγ在中枢神经系统中也有表达,激活PPARγ后促进神经细胞的分化和成熟,并参与神经细胞程序性死亡,近年研究也发现中枢神经元变性的致病机制与胰岛素代谢及信号转导相关[4],既PPARγ的激活与神经细胞的损伤和氧化应激有相关性,PPARγ通过抑制NF+-κ引发的下游炎症级联反应,其作为介导炎症信号及相关细胞因子释放的中心环节,以放大炎症反应效应[5]。PARPγ可调节TNF-α、NOS等NF-kB依赖性的途径,抑制PARPγ可以降低NF-kB介导的炎症反应[6]。在大鼠脑缺血模型中使用PARPγ抑制剂可以降低由NF-k Bp65入核所介导的脑部炎症损伤,并且通过这一抑制作用来降低NF-kBp65介导的炎症相关因子的产生,最终减少梗死面积,改善卒中后炎性粒细胞的浸润[7,8]。将神经元和胶质细胞进行体外混合培养中发现PPARγ的配体能阻止脂多糖(LPS)诱发的神经元损伤,提示PPARγ参与神经保护作用,并且发现培养的小胶质细胞也能表达PPARγ,其在小胶质细胞上的表达受严格调节,并与小胶质细胞的功能状态有关,2006年有国外研究显示,脑缺血后小胶质细胞的激活抑制了PPARγ的表达,随着炎症的进一步发展,PPARγ的表达被激活的小胶质细胞及其炎性介质进一步下调。临床研究也证实,PPARγ激动剂对有炎症参与的神经系统疾患如多发性硬化、阿尔茨海默病等具有抑制炎性分子如iNOS的释放,抑制炎症反应,改善患者的预后,提高患者的认知力作用[9],另有研究表明在癫痫鼠模型中,PPARγ可抑制小胶质细胞的活性,阻止癫痫后的炎症反应,减少神经细胞凋亡,起到神经保护作用[10]。
本研究结果显示,癫痫发作组大鼠海马区中PPARγmRNA的表达较正常组减少,且随着发作时间的延长PPARγm RNA的表达量逐渐减少,与对照组比较差异具有显著性(P<0.05),且不同时间点尼氏染色见正常组中尼氏体结构完整、胞浆饱满,轴突、树突完整,而癫痫发作组尼氏体减少,结构紊乱,胶质细胞增多,这一过程可能与癫痫发作后NF-kb核移位所介导的一系列炎症因子如IL-2释放COX-2的表达[11],进一步加重胶质细胞增生,神经元凋亡有关,本研究结果表明,PPARγ低表达可能是癫痫发作后神经元炎症损伤的潜在机制之一。
[1]Morgan JI,Cohen DR,Hempstead JL,et al.Mapping pattern of c-fos expression in the central nervous system after seizure[J].Science,1987,237(4811):192-197
[2]Racine RJ,Steingart M,McIntyre DC.Development of kindlingprone and kindling-resistant rats:selective breeding and electrophysiological studies[J].Epilepsy Res,1999,35(3):183-195
[3]刘淑华.戊四氮慢性致痫大鼠海马区NF-k B、I-k BA动态表达及地塞米松的影响[J].黑龙江医药科学,2006,29(2):3-4
[4]De la Monte SM,Wands JR.Review of insulin and insulin-like growth factor expression,signaling,and malfunction in the central nervous system:relevance to Alzheimer's disease[J].Alzheimer Dis,2005,7(1):45-61
[5]聂晶,刘冬焱,李贞.LPS致早期新生大鼠脑白质损伤时NF-KB表达与细胞凋亡的关系[J].黑龙江医药科学,2011,34(1):18-19
[6]Kauppinen TM.Multiple roles forpoly(ADP-ribose)polymerase-1 in neurological disease[J].Neurochem,2007,50(7-8):954-958
[7]ChiarugiA,Moskowitz MA.Poly(ADP-ribose)polymerase-1 activity promotes NF-kappa B-driven tran-scription and microglial activation:implication for neurodegenerative disorders[J].Neurochem,2003,85(2):306-317
[8]Koh SH,ChangDI,Kim HT,et al.Effect of3-aminobenzamide,PARP inhibitor,on matrix metalloproteinase-9 level in plasma and brain of ischemic stroke model[J].Toxicology,2005,214(1-2):131-139
[9]Sastre M,Klockgether T,Heneka MT,et al.Contribution of inflammatory processes to Alzheimer's disease:molecular mechanisms[J].Dev Neurosci,2006,24(2-3):167-176
[10]Sun H,Huang Y,Yu X,et al.Peroxisome proliferator activated receptor gammaagonist, rosiglitazone, suppresses CD40expression and attenuates inflammato-ry responses after lithium pilocarpine-induced statusepilepticus in rats[J].Dev Neurosci,2008,26(5):505-15
[11]王胜军.PARP调节癫痫大鼠海马核转录因子kB及相关炎症因子的表达[J].中国病理生理杂志,2010,26(1):86-90
