血清HE4浓度区分恶性卵巢肿瘤和卵巢子宫内膜异位囊肿
2014-09-17孙盛梅KOUNLinka张丹凤赵岩岩RajinaSHRESTHA
孙盛梅,KOUN Linka,张丹凤,赵岩岩,Rajina SHRESTHA
(佳木斯大学附属第一医院妇产科,黑龙江佳木斯154003)
子宫内膜异位症是最常见的良性妇科疾病之一,它可能会影响10%育龄妇女。子宫内膜异位症的典型症状是疼痛和不孕。子宫内膜异位症的特点表现是由子宫内膜腺体和间质在子宫腔以外的异位。病变通常位于腹膜,在卵巢或浸润进入腹腔内的器官[1]。有几种理论对子宫内膜异位症的病因,已被认为腹膜,直肠阴道深部,卵巢子宫内膜异位囊肿,并称为子宫内膜异位,有所不同来源[2]。
虽然阴道超声检查是有价值的,特别是在女性卵巢子宫内膜异位囊肿,子宫内膜异位症的诊断通常需要腹腔镜确诊。超声不是腹膜植入物和粘连的诊断或疾病分期的有用工具。此外,肿瘤性卵巢囊肿与子宫内膜异位囊肿在超声表达相似,因此,需要在诊断慎重考虑。此外,子宫内膜异位症是增加发生卵巢癌的某些亚型的风险,如子宫内膜样和透明细胞癌[3]。有数据表明,40%的子宫内膜样卵巢癌和50%的透明细胞性卵巢癌的是与子宫内膜异位症相关联[4]。子宫内膜样卵巢癌和透明细胞癌被认为是出现,至少部分来自子宫内膜异位症。类似的病理生理机制可能参与了子宫内膜异位症的进展,以及在其转变为卵巢瘤样病变[5]。
目前,CA125是在卵巢癌诊断中最常用的生化标志物。然而,它涉及较高的假阳性率在良性妇科疾病,如子宫内膜异位症[6]。此外,CA125在识别早期卵巢癌具有非常低的敏感性[7]。因此,为了提高卵巢癌诊断的特异性和敏感性,采用新的生物标志物,如HE4(人附睾分泌蛋白E4;WAP四二硫化物核心域蛋白2,WFDC2)单独或与CA125的组合已被广泛研究[8,9]。
除了卵巢癌的诊断,CA125可用于评估治疗子宫内膜异位症的效力以及子宫内膜异位症的复发。然而,由于缺乏敏感性和特异性已经显著阻碍生物标记物作为诊断测试[10,11]。另一方面,标志物包括CA125已经被建议提出来预测子宫内膜异位症的患者的一个子集存在[12]。
人类附睾分泌蛋白E4是一种新的血清学标志物用于卵巢癌的诊断。与以前使用的标记物相比,它具有更高的敏感性用于检测卵巢癌,特别是Ⅰ期[9,13],而 HE4 编码基因WFDC2表达是特别在浆液性和子宫内膜样卵巢癌[14,15]。然而,研究证明它还表示在其他一些类型的肿瘤,例如肺腺癌[15]。其表达也很明显在正常子宫内膜腺体和子宫内膜癌[14,15],但在子宫内膜异位病灶包括卵巢子宫内膜异位表达是不知道。
在本研究中,我们测量血清HE4和CA125浓度在129例内膜异位症患者其中70个有卵巢子宫内膜异位囊肿。获得的结果的数据与17例子宫内膜癌患者,15例卵巢癌和67例健康对照患者进行比较。mRNA表达的编码基因HE4和CA125,即WFDC2和MUC16,分别在不同类型的子宫内膜异位、卵巢癌、子宫内膜癌和正常子宫内膜的组织标本进行了分析。
1 资料与方法
1.1 一般资料
在佳木斯大学附属第一医院2011-12~2013-10的住院患者被纳入研究。采样前所有病人的书面知情同意已同意,并符合研究方案经伦理。
妇女的血清样本确诊为子宫内膜异位症(Endo,n=130),卵巢癌(OvCa,n=15),或子宫内膜癌(EmCa,n=17)被纳入研究,以及健康对照67个样本(CTRL)。卵巢子宫内膜异位患者的血清样品(OvEndo中,n=70,ASRM临床分期3~4)被评价为在分析中一个单独的组。该疾病是在腹腔镜或剖腹探查确诊,并通过组织病理学评估证实。本研究患者的描述列于表1。子宫内膜异位症患者根据美国生殖医学协会(ASRM)标准进行了分期1~4期。卵巢癌和子宫内膜癌患者根据FIGO标准进行了分期[16]。在15例卵巢癌包括8例浆液性,3例黏液性,2例透明细胞,1例子宫内膜样和1例小细胞癌。四例卵巢癌是I期,其余11例为晚期Ⅱ~Ⅳ期。所有子宫内膜癌是子宫内膜样腺癌。15例子宫内膜癌症仅限于子宫(Ⅰ~Ⅱ期),而2例转移盆腔淋巴结(III期)。对照受试者(n=67)进行了输卵管绝育期间以确定排除子宫内膜异位症,子宫内膜活检排除子宫内膜癌,腹腔镜排除卵巢癌的可能。子宫内膜异位症,卵巢癌,子宫内膜癌,和健康对照的平均年龄分别是31.6,63.5,60.2和38.6岁。

表1 患者描述包含在血清HE4和CA125的分析
WFDC2和MUC16的基因表达,分别编码HE4和CA125蛋白,被评估于148例非卵巢子宫内膜异位病灶,29例卵巢子宫内膜异位囊肿,16例卵巢癌和15例子宫内膜癌,64例子宫内膜异位症患者的子宫内膜组织标本,和42例健康对照组的子宫内膜组织标本。13例卵巢癌为浆液性,一个是子宫内膜样癌和一个为未分化。所有子宫内膜癌是子宫内膜样腺癌。组织样本采集在腹腔镜或开腹手术。子宫内膜活检使用无菌Pipelle采样器收集。所有组织样品被快速冷冻并储存在液氮中。
1.2 血清HE4和CA125分析
收集血清样品于进入手术前,血清放置约非肝素化试管,保持30min后在室温下,以3000rpm速度离心15min(800g)中。这些血清保存在-20℃或-80℃。人类附睾分泌蛋白E4和CA125的浓度,在血清样品中通过ELISA分析(Fujirebio公司诊断公司,美国)根据制造商的指示进行分析。
1.3 表达分析
WFDC2和MUC16的基因表达水平作为我们研究的全基因组微阵列分析的一部分。总RNA分离用Trizol试剂(Invitrogen公司,美国),其应用 RNeasy柱(Qiagen,美国)和DNA酶(无RNA酶的DNA酶组(Qiagen公司)或DNA酶I(Invitrogen)的)进一步纯化处理。将RNA浓度测定用Nano-Drop ND-1000(赛默飞世尔科技,美国)和RNA质量通过的Experion分析(Bio-Rad实验室,美国)进行控制。所有微阵列分析的后续步骤均在Finnish的DNA微阵列中心利用Sentrix Human Illumina 6 V2 Expression BeadChips,其中包含了超过47000个已知基因,候选基因,和剪接变种。RNA样品(300ng每件)用作模板用于制备双链cDNA,然后生物素化cRNA使用Illumina RNA全预备扩增试剂盒(Ambion公司,美国)。将标记的cRNA纯化和杂交到BeadChip芯片在55℃下保持16h,接着全基因组基因表达。杂交是与Cyanine3-链霉(GE Healthcare,Little Chalfont,UK)检测和阵列进行扫描与Illumina BeadArray阅读器。正常化和微阵列数据的统计分析采用统计软件研发套件SPSS19进行。使用探针ILMN_1706612和ILMN_1799120为WFDC2的表达水平进行分析;使用探针ILMN_1736316为MUC16的表达水平进行分析。
1.4 统计学分析
采用Tukey多重比较,进行了血清HE4和CA125浓度的单独和组合的统计分析,以95%为明智的置信水平。HE4和CA125标记的分类能力,单独和共同,使用二进制和多分类Logistic回归模型交叉验证进行了评估。在交叉验证反过来每个样品,而其他被保留用于测试模型。在95%特异性的敏感性和正确的概率(诊断符合率)被交叉计算验证回归模型。
2 结果
2.1 血清HE4和CA125的浓度
血清HE4平均浓度相似,低于70pM的限制值对于升高[9]在子宫内膜异位症患者(平均46.2pM)和健康对照组(39.5pM),而不论该疾病分类或存在的卵巢子宫内膜异位囊肿的分期(ASRM:Ⅰ期:46.6pM;Ⅱ期:45.9pM;Ⅲ期:43.5pM;Ⅳ期:46.6pM;OvEndo:47.0pM)。然而,在卵巢癌患者明显增加的血清HE4浓度(1135.1pM),子宫内膜癌患者血清HE4浓度也显著升高(98.3pM,P<0.01)。HE4浓度在不同类型的卵巢癌的水平是最高的是浆液性(2022.5pM,n=8),而在透明细胞癌也显然升高(387.5 pM,n=2)和黏液癌也显著升高(212.3pM,n=3)。不同患者群体血清浓度见表2。

表2 血清HE4和CA125的浓度在患者的子宫内膜异位症,子宫内膜癌和卵巢癌
CA125血清水平在卵巢癌患者最高(平均1127.3umol/L,P<0.01),但也显著(P<0.01)升高在卵巢子宫内膜异位囊肿患者(45.3umol/L)和高级非卵巢子宫内膜异位症(ASRM第Ⅳ期,41.2umol/L)与健康对照组(8.7umol/L)进行比较。这些CA125浓度也高于正常界线值(35umol/L)。浓度的增加随着子宫内膜异位症的增加ASRM分期而升高,见表2。然而,子宫内膜异位症患者 CA125中位数浓度(33.7umol/L)是低于CA125正常界线值。子宫内膜癌患者血清CA125水平(21.0umol/L)也显著(P<0.05)明显高于健康对照组,即使偏低于正常界线值。
HE4,CA125,或它们联合应用两两比较计算95%特异性的敏感性。区分卵巢癌患者与健康对照,CA125和HE4联合相对于CA125或HE4单独的诊断符合率最高(96.4%)和敏感性最高(93.9%),见表3。此外,该联合具有最高的诊断符合率(93.8%)和敏感性(79.6%)也用于卵巢子宫内膜异位症和卵巢癌的鉴别诊断。该联合也区分卵巢子宫内膜异位症与健康对照,并几乎尽与单独CA125准确,即使HE4单独是一个不太好对于宫内膜异位症。最后,HE4和CA125的联合具有最高的准确度(82.9%)对于卵巢癌,卵巢子宫内膜异位症,和健康对照组之间的比较。
2.2 HE4和CA125编码基因的表达
WFDC2(编码HE4)和MUC16(编码CA125)的组织样品中的mRNA表达水平见表4。卵巢癌的表达与卵巢子宫内膜异位比较,而子宫内膜癌和非卵巢子宫内膜异位病灶的表达与健康对照组正常子宫内膜进行比较。WFDC2的表达显著(P<0.05)在卵巢癌(中位数的LOG2强度值9.25)比在卵巢子宫内膜异位囊肿(6.63)与5.8倍的变化(FC)。然而,当与健康的子宫内膜(7.87)相比,子宫内膜癌(8.72)的1.9倍的高表达没有达到统计学意义。因此,表达数据在用在不同的病人组和对照观察HE4差分血清浓度线。与此相反,MUC16的mRNA表达水平在各样品相对稳定的,而所有的比较之间的FC是0.7~1.3。
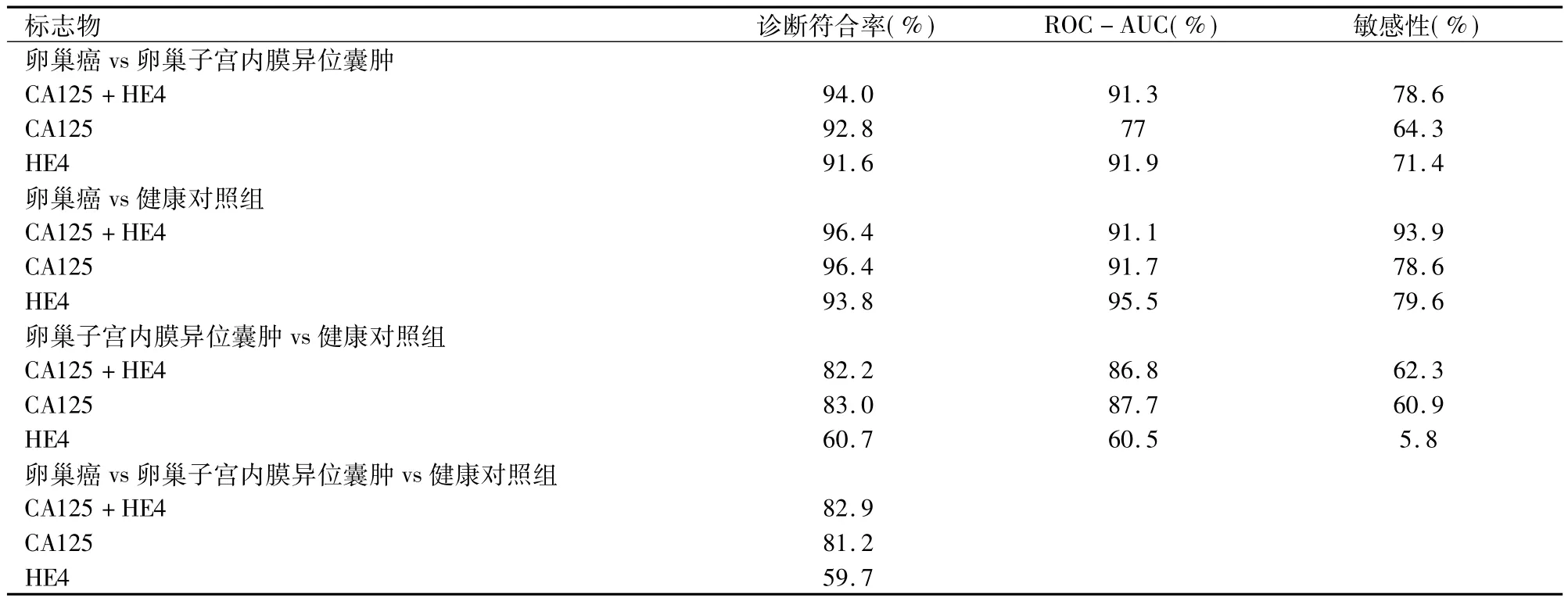
表3 肿瘤标志物准确度和敏感性在95%的特异性对于卵巢癌和卵巢子宫内膜异位症

表4 WFDC2(HE4)和MUC16(CA125)的mRNA表达在子宫内膜,非卵巢和卵巢子宫内膜异位症,子宫内膜癌和卵巢癌的组织标本为log2强度值
3 讨论
HE4是一种新的血清学标志物尤其是卵巢癌诊断中使用了[8,9,17]。因为它的高敏感性,它也有用对于检测 I期卵巢癌[9,13]。此外,HE4已被建议作为一种生物标志物为子宫内膜癌的诊断[18]。目前,几种生物标志物板被评估,以增加卵巢癌诊断的敏感性和特异性。CA125和HE4联或不联合其他生物标志物如 Glycodelin,Plau-R,MUC-1,PAI-1[13],SMRP[9,17],CA72-4,和骨桥蛋白[9]进行了评估,以改善卵巢癌的诊断。该数据表明,通过组合这些标志物的预测准确性在卵巢恶性肿瘤是比单独应用任何标志物的更好。生物标志物包括HE4的板已经评价也用于监测卵巢癌的复发[13,19]。
在女性组织,HE4免疫反应已经被证明是表达最高在生殖道,包括宫颈腺体,子宫内膜腺体,输卵管和前庭大腺腺上皮[14,15]。相反,正常卵巢表面上皮,其不表达 HE4,由化生苗勒管上皮内衬皮质包涵囊肿已显示大量表达的蛋白质[14]。HE4蛋白在卵巢肿瘤中的表达最高的是浆液性癌,但免疫组化检测到在绝大多数的卵巢子宫内膜样和透明细胞癌[14,15]。除了卵巢癌,一些肺、子宫内膜和乳腺腺癌已经显示出表达HE4[15]。虽然蛋白质已经在正常和恶性子宫内膜被检测到,HE4在子宫内膜异位病灶的表达只是表面上已知的。近日,分析HE4在166例卵巢癌与其他几种盆腔肿块,其中29例有子宫内膜异位症[9]。它们表明,HE4和CA125的联合是其他生物标记物中区分卵巢癌患者从那些与其他盆腔肿块的最佳组合。然而,子宫内膜异位病变的种类并没有说明。
与其他最近的研究结果相一致[8,9,18,20],我们发现 HE4浓度升高在卵巢癌和子宫内膜癌的患者。本数据表明,不论HE4编码基因在子宫内膜异位病灶或是血清HE4浓度在子宫内膜异位症患者的任何类型的子宫内膜异位症不表达增加。而HE4甚至没有在患者的卵巢子宫内膜异位症增加。相反,CA125血清水平在晚期子宫内膜异位症和卵巢子宫内膜异位囊肿增加,符合预期。应当指出的是子宫内膜异位症诊断通常是在年轻成年(25~35岁)和常在绝经后消失,而卵巢癌的发生率增加于老年妇女(在50~60岁的年龄发病率最高)。有趣的是,已经报道,HE4的浓度随着年龄的增大在健康的绝经后妇女,而CA125不是[21]。因此,同时测量HE4和CA125,而不是单独的其中之一,给予卵巢癌患者和健康人卵巢子宫内膜异位囊肿的鉴别诊断更准确的工具。它也可以帮助临床医生在随访的患者晚期患子宫内膜异位考虑到病变恶变的可能性。在超声检测卵巢肿块的患者,血清HE4与CA125同时升高提示卵巢癌的存在,而CA125升高但HE4不升高将认为晚期卵巢子宫内膜异位或其他良性疾病。此外,升高的血清HE4浓度与正常的CA125浓度认为卵巢癌或可能其它类型癌症的存在,例如子宫内膜癌。
卵巢癌和子宫内膜异位症之间的高度特异性分化的最大好处可能在发现在早期非症状期的卵巢癌。卵巢癌大部分被确诊在晚期,并具有非常低的生存率。与此相反,I期疾病局限于卵巢的患者5年存活率为90%以上。这强调了检测卵巢癌在早期阶段以降低死亡率的重要性。
总之,HE4血清浓度是一种新型的生物标志物用于卵巢癌,在患者的卵巢子宫内膜异位或任何其他类型的子宫内膜异位症没有升高,而血清CA125浓度在晚期子宫内膜异位症增加。因此,血清HE4浓度是一个有价值的指标,以更好地鉴别卵巢恶性肿瘤与那些来自良性卵巢子宫内膜异位囊肿患者。
[1]Giudice L,Kao L.Endometriosis[J].Lancet,2004,364:1789 1799
[2]Nisolle M,Donnez J.Peritoneal endometriosis,ovarian endometrio-sis,and adenomyotic nodulesof the rectovaginal septum are three different entities[J].Fertil Steril,1997,68:585 596
[3]Nagle C,Olsen C,Webb P,et al.Endometrioid and clear cell ovarian cancers:a comparative analysis of risk factors[J].Eur JCancer,2008,44:2477 2484
[4]Sato N,Tsunoda H,Nishida M,et al.Loss of heterozygosity on 10q23.3 and mutation of the tumor suppressor gene PTEN in benign endometrial cyst of the ovary:possible sequence progression from benign endometrial cyst to endometrioid carcinoma and clear cell carcinoma of the ovary[J].Cancer Res,2000,60:7052 7056
[5]Ness R.Endometriosis and ovarian cancer:thoughtson shared pathophysiology[J].Am JObstet Gynecol,2003,189:280 294
[6]Markman M.The role of CA-125 in the management of ovarian cancer[J].Oncologist,1997,2:6 9
[7]Terry K,Sluss P,Skates S,et al.Blood and urinemarkers for ovarian cancer:a comprehensive review[J].Dis Markers,2004,20:53 70
[8]Hellstrom I,Raycraft J,Hayden-Ledbetter M,et al.The HE4(WFDC2)protein is a biomarker for ovarian carcinoma[J].Cancer Res,2003,63:3695 3700
[9]Moore R,Brown A,Miller M,etal.The use ofmultiple novel tumor biomarkers for the detection of ovarian carcinoma in patients with a pelvicmass[J].Gynecol Oncol,2008,108:402 408
[10]Mol B,Bayram N,Lijmer J,et al.The performance of CA-125 measurement in the detection of endometriosis:a meta-analysis[J].Fertil Steril,1998,70:1101 1108
[11]Kitawaki J,Ishihara H,Koshiba H,et al.Usefulness and limits of CA-125 in diagnosis of endometriosis without associated ovarian endometriomas[J].Hum Reprod,2005,20:1999 2003
[12]Seeber B,SammelM,Fan X,etal.Panel ofmarkers can accurately predict endometriosis in a subset of patients[J].Fertil Steril,2008,89:1073 1081
[13]Havrilesky L,Whitehead C,Rubatt J,et al.Evaluation of biomarker panels for early stage ovarian cancer detection and monitoring for disease recurrence[J].Gynecol Oncol,2008,110:374 382
[14]Drapkin R,Von Horsten H,Lin Y,etal.Human epididymis protein 4(HE4)is a secreted glycoprotein that is overexpressed by serous and endometrioid ovarian carcinomas[J].Cancer Res,2005,65:2162 2169
[15]Galgano M,Hampton G,Frierson HJ.Comprehensive analysis of HE4 expression in normal and malignant human tissues[J].Mod Pathol,2006,19:847 853
[16]Benedet JL,Bender H,Jones H,et al.FIGO staging classifications and clinical practice guidelines in the management of gynecologic cancers,FIGO Committee on Gynecologic Oncology[J].Int J Gynaecol Obstet,2000,70:209 262
[17]Hellstrm I,Hellstrom K.SMRP and HE4 as biomarkers for ovarian carcinoma when used alone and in combination with CA125 and/or each other[J].Adv Exp Med Biol,2008,622:15 21
[18]Moore R,Brown A,Miller M,et al.Utility of a novel serum tumor biomarker HE4 in patients with endometrioid adenocarcinoma of the uterus[J].Gynecol Oncol,2008,110:196 201
[19]Moore R,McMeekin D,Brown A,et al.A novelmultiple marker bioassay utilizing HE4 and CA125 for the prediction of ovarian cancer in patientswith a pelvicmass[J].Gynecol Oncol,2009,112:40 46
[20]Gagnon A,Ye B.Discovery and application of protein biomarkers for ovarian cancer[J].Curr Opin Obstet Gynecol,2008,20:9 13
[21]Lowe KA,Shah C,Wallace E,etal.Effectsof personal characteristics on serum CA125,mesothelin,and HE4 levels in healthy postmenopausal women at high-risk for ovarian cancer[J].Cancer Epidemiol Biomarkers Prev,2008,17:2480 2487
