灵芝酸对痫样放电海马神经元ERK1/2磷酸化水平的影响
2014-09-17刘君星马小茹王芳芳梁衍锋吴佳梅王淑秋
栾 倩,刘 蕾,刘君星,马小茹,王芳芳,梁衍锋,吴佳梅,王淑秋
(佳木斯大学基础医学院病理生理教研室,黑龙江佳木斯154007)
大鼠丝裂原活化蛋白激酶1/2(ERK1/2),在脑内含量丰富,可被激活磷酸化参与一系列神经系统疾病,灵芝孢子粉已证实有抗癫痫作用,灵芝酸作为灵芝孢子粉的一种有效成分,其作用机制与ERK1/2磷酸化水平是否有关有待进一步探讨。本实验拟观察灵芝酸对ERK1/2磷酸化水平的影响,探讨灵芝酸抗癫痫的作用机制。
1 材料与方法
1.1 主要材料
1.1.1 动物与试剂:24h内新生Wistar大鼠,购自大连医科大学动物中心。种植培养液:NB培养基(Cat.No.21103049,Gibco),2%B-27(Cat.No.17504044,Gibco),0.5mmol/L的L-谷氨酰胺,10%的FBS,青霉素-链霉素溶液;维持培养液:NB培养基,2%的B-27,0.5mmol/L的L-谷氨酰胺,青霉素-链霉素溶液;D-Hanks液;胰蛋白酶;大鼠丝裂原活化蛋白激酶1/2酶联免疫分析试剂盒;NSE抗体(Cat.No-BA0535,Wuhan Boster Bio-Engineering Ltd,China);山羊抗兔FITC荧光二抗(Cat.No.BA1105,Wuhan Boster Bio-Engineering Ltd,China)。
1.1.2 仪器:37℃恒温箱;酶联免疫检测仪(BioTek公司),激光共聚焦显微镜FV1000(Olympus公司)。
1.2 方法
1.2.1 海马神经元的原代培养与鉴定
取24h新生大鼠,迅速端头取脑,分离出海马组织放入冷的D-Hanks液中漂洗3次,将组织块剪成1mm3的碎块,加入500μL的0.125%胰蛋白酶,37℃培养箱内消化3~4min后取出,迅速加入等量种植液终止消化,轻轻吹打成悬液,加入离心管1000r/min离心5min,弃上清,加种植液,巴氏滴管反复轻轻吹打,200目筛网过滤,去少量细胞计数,放入37℃、5%CO2培养箱内培养,24h后全量换成维持液,以后每2~3天半两换液。取出培养9d的神经细胞,吸掉培养液用0.01molPBS洗2遍,然后加入兔抗鼠NSE抗体孵育一抗,放在4℃冰箱过夜,取出在避光条件下,加上山羊抗兔FITC荧光二抗,在荧光显微镜下对原代培养的神经元进行鉴定。
1.2.2 海马神经元模型建立
将培养至第9d的海马神经元,全液更换成无镁细胞外液(124 mmol NaCl,3.3 mmol KCl,26mmol NaHCO3,1.2mmol KH2PO4,2.5mmol CaCl2,10mmol Glucose,pH7.2 ~ 7.4,290+10mOsm)处理3h,即得海马神经元的癫痫样放电模型,再恢复正常培养。
1.2.3 MTT法测定灵芝酸对海马神经元最大无毒浓度
将浓度约为1×105/mL细胞悬液加入到96孔板中培养至第9d,加入不同浓度的无菌灵芝酸培养液混悬液,终浓度为 5,10,20,40,80,160,320,640μg/mL,每组设 8 个复孔,同时设立正常细胞对照,置于37℃、5%CO2培养箱内培养,连续观察24h。每孔加入20μL 0.5%MTT溶液,继续培养4h后终止培养,吸去孔内培养液。然后每孔加入200μL二甲基亚砜(DMSO)后在酶联免疫检测仪检测每个孔的吸光度值,OD490nm。经测算取灵芝酸最适无毒浓度20μg/mL,80μg/mL,320μg/mL。
1.2.4 灵芝酸最适无毒浓度分组
将海马神经元接种于35mm培养皿内,培养至第9天时,随机选取培养的细胞进行分组:(1)正常对照组:将维持培养液全液换成正常细胞外液处理3h,然后恢复正常培养3h后取材;(2)模型组:将维持培养液全液换成无镁细胞外液处理3h,然后恢复正常培养3h后取材[1];(3)治疗组:将维持培养液全液换成无镁细胞外液处理3h,全液再换成维持培养液配制的灵芝孢子粉混悬液(浓度为20mg/m L,80mg/mL,320mg/mL)处理3h后取材。
1.2.5 ELISA分析
用PBS稀释细胞悬液,通过反复冻融,以使细胞破坏,离心收集细胞内成分。在酶标包被板上加样、温育、洗涤、终止,每组样品重复3个复孔,并设置空白对照组,450nm波长依序测量各孔的吸光度(OD值)。制作标准曲线,计算出标准曲线的直线回归方程式,将样品OD值代入方程式,计算出查出样品浓度,再乘以稀释倍数,即样品的实际浓度。
1.3 统计学分析
采用平均数士标准差()表示,应用IBM SPSS 21统计软件进行数据统计学处理,P<0.05为差异有统计学意义。
2 结果
2.1 海马神经元NSE鉴定
经NSE免疫荧光染色显示,第9天神经元发育成熟,神经元胞体饱满,突起增大,成团状聚集、交织成网。
2.2 MTT检测灵芝酸对海马神经元最大无毒浓度
随着灵芝酸浓度的不断增加,灵芝酸对海马神经元细胞的最适无毒浓度为80μg/m L,因此本实验采用20μg/m L,80μg/mL,320μg/mL 进行后续试验。
2.3 酶联免疫分析ERK1/2磷酸化水平的表达
结果显示各实验组中均有ERK1/2的表达,模型组ERK1/2的表达高于正常对照组(P<0.05);并且各治疗组均能降低ERK1/2磷酸化水平,差异都有统计学意义;各浓灵芝酸组之间比较,差异都有统计学意义(P<0.05),见图1。
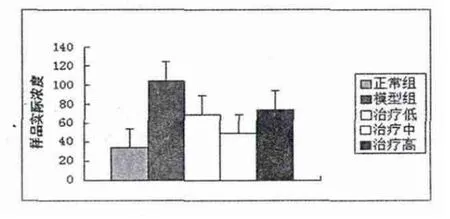
图1 各实验组中均有ERK1/2的表达
3 讨论
我们采用NB培养基联合B27添加剂离体培养海马神经元,培养第4天加入阿糖胞苷,这种培养方式获得了相对纯度较高的海马神经元,培养至第9天,神经元生长更加旺盛,胞体增大,突起增多伸长,粗大,交织成网状,此时所培养的神经元是生长的最旺盛阶段[2]。NSE免疫荧光技术对离体培养神经元进行鉴定,利用无镁细胞外液培养得到离体海马神经元的永久性癫痫样放电模型,可用于细胞水平上神经系统功能、结构的研究。通过 MTT方法结果的观察,得出灵芝酸的最适高中低无毒浓度(20μg/m L,80μg/m L,320μg/m L)。
ERK1/2是MAPK家族中研究最早最为透彻的一个激酶,通过大量体内和体外研究,ERK1/2在多种癫痫模型实验中已证实参与了癫痫的发生和发展。癫痫是神经科常见疾患,尽管目前临床有多种治疗方法,但主要的治疗手段仍是抗癫痫药物治疗控制其发作[3]。近年来,中药在抗癫痫方面研究不断加深,本研究通过离体培养海马神经元,观察灵芝酸对无镁细胞外液致痫性细胞模型中ERK1/2磷酸化的表达情况,表明灵芝酸能抑制海马神经元中ERK1/2通路的激活,为研究灵芝酸对抗癫痫作用提供了实验依据,但目前对苔藓纤维的负向调节机制还有待研究,可能与其上游激活因子脑源性神经营养因子(BDNF)和神经营养因子-3(NT-3)有关[4,5]。
[1]赵春霞,王淑秋,丛岭,等.灵芝孢子粉对无镁活化海马神经元NGF的影响[J].黑龙江医药科学,2010,33(4):8-15
[2]张金波,王淑秋,朱金玲,等.大鼠海马神经细胞原代培养技术的优化[J].黑龙江医药科学,2009,32(4):20-21
[3]赵秀鹤,迟兆富,王胜军,等.ERK信号转导通路在癫痫大鼠脑部作用的研究[J].神经损伤与功能重建,2006,1(1):14-16
[4]夏杰,陈阳美.MAPKERK1/2信号转导途径在实验性癫痫大鼠海马结构的激活[J].重庆医科大学学报,2005,30(3):363-365
[5]刘华.丙戊酸对癫痫后ERK1/2介导的苔藓纤维出芽干预的实验研究[D].[硕士学位论文].重庆医科大学,2008
