灯盏细辛离体叶片再生植株的研究1)
2014-09-15董志渊杨丽英王馨李林玉杨斌马维思严世武李绍平
董志渊,杨丽英,王馨,李林玉,杨斌,马维思,严世武,李绍平
(云南省农业科学院药用植物研究所,云南昆明650200)
灯盏细辛(Erigeronbreviscapus)为菊科(Compositae)飞蓬属多年生草本植物,又名灯盏花。以全草入药,是云南重要的药用植物和道地药材,被云南省列为重点发展的五大系列药品之一[1]。
灯盏细辛主要有效成分为黄酮类化合物灯盏乙素,其具有扩张脑血管,增加脑血流量,改善微循环作用,可用于治疗缺血性脑血管疾病[2]。
灯盏细辛主要通过异花授粉[3]进行种子繁殖[4],种质保存和品种选育难度较大。采用植物离体组织快繁技术,可对灯盏细辛优良单株进行保存和扩繁,获得基因型一致的无性系群体,对育种工作具有重要意义。本研究主要采用灯盏细辛基生叶片为外植体,开展不同培养基配方对灯盏细辛离体培养过程中愈伤组织、不定芽形成,壮苗培养和离体植株生根等方面的影响,进一步优化灯盏细辛离体再生植株的技术方法,为灯盏细辛种质资源保存和育种应用提供技术支持。
1 材料与方法
1.1 材料
灯盏细辛(Erigeronbreviscapus)植株。
1.2 方法
1.2.1 接种
取生长正常健康的叶片,超菌工作台上用70%的乙醇浸泡30s,2.00%NaOCl消毒约8min,无菌水清洗3次,切成宽约0.50cm的方块,接种到不同激素配比的MS培养基上,诱导愈伤组织产生;培养20d后切取诱导产生的愈伤组织,接种到不同激素配比的不定芽诱导培养基上,诱导不定芽产生;培养30d后,将产生不定芽的愈伤组织转接入壮苗培养基中,促进不定芽的生长;壮苗培养约60d后,植株高1~3cm,具4~8片叶片时,转入不同激素配比的生根培养基中,诱导植株形成根系。
愈伤组织诱导率、不定芽诱导率和不定芽诱导系数的计算公式如下:
愈伤组织诱导率 = 产生愈伤组织叶片数 / 叶片总数
不定芽诱导率 = 产生不定芽的愈伤组织数 / 愈伤组织总数
不定芽诱导系数 = 不定芽总个数 / 愈伤组织总数
1.2.2 培养基配制
基本培养基为MS培养基,添加不同浓度的激素2,4-D (2,4-二氯苯氧乙酸)、BA (6-苄基腺嘌呤)、IBA (吲哚丁酸)、NAA (萘乙酸)、KT (激动素)、GA(赤霉素),附加物水解酪蛋白、PVP(聚乙烯吡咯烷酮)、活性炭,3.00%蔗糖,0.60%琼脂,pH值5.80~6.00,121 ℃高压灭菌20 min。
1.2.3 不定芽发生显微观察
以经过愈伤组织诱导、不定芽诱导和壮苗培养的愈伤组织块为材料,采用FAA固定液进行固定,常规石蜡切片法切片,切片厚度10μm,铁矾-苏木精染色,脱水透明后在Phenix PH100显微镜下观察不定芽发生过程,并用MICRO IMAGE MC-D310U(E)显微摄影装置进行摄影。
2 结果与分析
2.1 愈伤组织诱导
研究结果表明,采用MS + BA 1.00mg/L + NAA (0.50 mg/L 或 0.25 mg/L)培养基,愈伤组织外部颜色为绿色,颗粒大,质地疏松,愈伤组织生长量较多;MS + BA 1.00mg/L + 2,4-D (0.50mg/L或0.25 mg/L),愈伤组织为嫩绿色,颗粒状小且紧密,愈伤组织生长量较少。上述4个培养基配方的愈伤组织诱导率均较高(89.36%~99.22%),其中MS + BA 1.00mg/L + NAA 0.50 mg/L 培养基诱导率最高,达到99.22%(表1)。
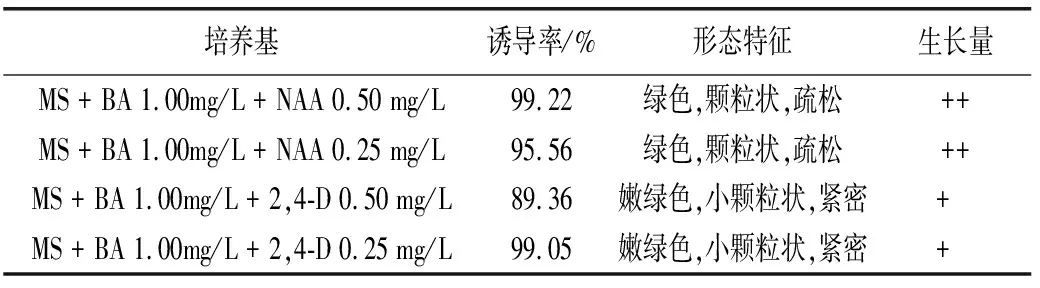
表1 不同激素配比对愈伤组织诱导的影响
2.2 不定芽诱导
不同浓度的细胞分裂素BA对灯盏细辛不定芽诱导影响较大。较高浓度的细胞分裂素有利不定芽的形成,其中BA浓度为5.00mg/L,NAA浓度为1.00mg/L时,不定芽诱导率和诱导系数均较高,分别为30.84%和0.49(表2)。

表2 不同浓度的细胞分裂素BA对灯盏细辛不定芽诱导的影响
细胞分裂素BA、KT与生长素NAA、IBA不同激素配比的培养基对不定芽诱导影响明显,其中MS + KT 4.00mg/L + IBA 0.50mg/L培养基有利不定芽的形成,不定芽芽诱导率和诱导系数均较高,分别为38.51%和0.49(表3)。

表3 不同激素配比对灯盏细辛不定芽诱导的影响
2.3 壮苗培养
在MS + BA 0.50mg/L + NAA 0.50 mg/L+水解酪蛋白1000.00 mg/L +PVP 1000.00 mg/L培养基中分别加入GA 0.00mg/L、0.50 mg/L、1.00 mg/L,培养诱导获得的不定芽。结果表明,GA 0.00mg/L时,不定芽在该培养基上能够继续生长,未发生明显褐化现象,但生长较缓慢;添加赤霉素0.50mg/L时,不定芽生长较快,离体植株形态建成较好,部分发生玻璃花现象,添加1.00 mg/L的培养基中不定芽生长最快,离体植株形态建成较好,但玻璃花现象较严重(图4:1)。
采用经过MS + BA 1.00mg/L + NAA 0.50 mg/L、MS + BA5.00mg/L + NAA1.00mg/L和MS + BA 0.50mg/L + NAA 0.50 mg/L+水解酪蛋白1000.00 mg/L +PVP1000.00 mg/L培养的愈伤组织块,进行石蜡切片和显微观察。结果表明,通过不定芽培养,在愈伤组织块的表层下或表层的部分细胞染色较深,细胞质浓密,细胞核明显,形成分生组织,并发育形成不定芽原基(图3:1~2);通过壮苗培养,不定芽原基进一步分化,形成芽的明显结构(图3:3~4)。
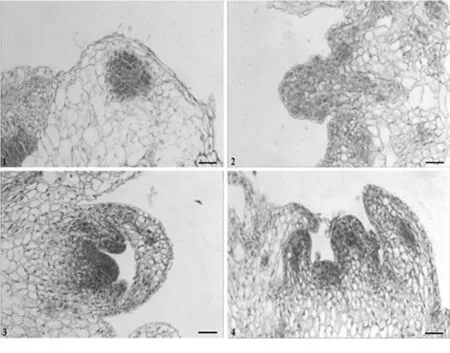
图3 愈伤组织不定芽形成
2.4 生根培养
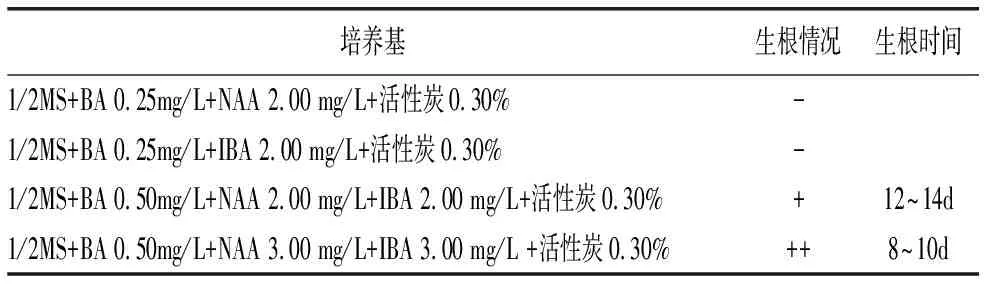
表4 不同激素配比对灯盏细辛离体植株生根的影响
1/2MS + BA 0.25mg/L + NAA 2.00 mg/L + 活性炭0.30%、1/2MS + BA 0.25mg/L + IBA 2.00 mg/L + 活性炭0.30%等含较低浓度生长素的培养基不能诱导离体植株生根;1/2MS + BA 0.50mg/L + NAA 2.00 mg/L + IBA 2.00 mg/L + 活性炭0.30%、1/2MS + BA 0.50mg/L + NAA 3.00 mg/L + IBA 3.00 mg/L + 活性炭0.30%等含较高浓度生长素的培养基可诱导离体植株生根(表4;图4:2)。

图4 灯盏细辛离体叶片再生植株
3 讨论
灯盏细辛组织培养中采用的外植体主要有花葶、花盘、叶片、叶柄等[5-6]。其中,叶片易获得,数量多,是灯盏细辛组织培养较好的外植体来源。目前,以叶片为外植体,通过愈伤组织诱导、不定芽诱导和生根培养等步骤组成的灯盏细辛组织培养技术方法已初步形成。但不同研究者关于灯盏细辛组织培养中激素配比使用,及其对培养效果影响报道差异较大。
林丽飞等[7]采用KT、NAA和2,4-D配比的MS 培养基诱导灯盏细辛愈伤组织产生,其中KT 0.5 mg/L + 2,4-D 10 mg/L、MS + 2,4-D 0.5 mg/L + 6 -BA 0.5 mg/L 等培养基配方均能高效诱导愈伤组织产生。马玉芳等[5]采用MS + 6-BA 1mg/ L + NAA 0.5mg/L培养基诱导愈伤组织产生,培养60d后才开始形成愈伤组织。本研究发现较低浓度激素BA、NAA和2,4-D配比的MS培养基可较好的诱导叶片愈伤组织产生,培养20d后大部分叶片可产生愈伤组织,诱导率达到89.36%以上。
关于灯盏细辛不定芽诱导,林丽飞等[7]采用MS +6-BA 0.5 mg/L +IBA (0、0.1、0.3、0.5 mg/L) + 10%香蕉汁的培养基可产生一定数量的不定芽;吴毅歆等[8]采用MS、MS+6-BA0.5 mg/L +NAA0.1 mg/L等较低激素配比培养基,不定芽诱导率均达到100%;黄衡宇等[6]研究表明不定芽诱导的适宜激素配比是BA 2.0 mg/L +IAA 1.0 m g/L 或 KT 3.0 mg/L +IAA 0.5 mg/L。本研究发现灯盏细辛愈伤组织不定芽诱导较困难,采用较高浓度的细胞分裂素,才能诱导不定芽的产生,MS + BA 5.00mg/L + NAA 1.00mg/L培养基不定芽诱导率为30.84%;不同激素配比对不定芽的诱导影响明显,其中MS + KT 4.00mg/L + IBA 0.50mg/L培养基有利不定芽的形成,不定芽诱导率为38.51%。本研究还发现,愈伤组织诱导形成的不定芽呈芽点状,在不定芽诱导培养基上较难继续分化生长形成离体植株,并且容易发生褐化现象。因此本研究将诱导形成的不定芽转接入含不同浓度赤霉素的MS + BA 0.50mg/L + NAA 0.5 mg/L+水解酪蛋白1000 mg/L +PVP1000 mg/L培养基,防止褐化,促进不定芽的生长,结果发现通过壮苗培养,特别是添加低浓度的赤霉素,不定芽生长明显。
本研究还发现,灯盏花离体植株生根也需较高浓度生长素,如1/2MS + BA 0.50mg/L+NAA 2.00 mg/L + IBA 2.00 mg/L+活性炭0.30%、1/2MS+BA 0.50mg/L+NAA 3.00 mg/L+IBA 3.00 mg/L+活性炭0.30%等配方。含较高浓度生长素的培养基诱导灯盏细辛离体植株生根效果较好。该结果与黄衡宇等[7]、吴毅歆等[8],关于灯盏细辛离体植株生根适宜培养基配方差别较大,还有待进一步研究。
[1] 邱璐,瞿礼嘉,虞泓,等.灯盏花的研究进展[J].中草药,2005,36(1):141-144.
[2] 国家药典委员会.中国药典(2005版,-部)[M].北京:化学工业出版社,2005:100.
[3] 李鹏,党承林.短葶飞蓬(Erigeronbreviscapus)的花部综合特征与繁育系统[J].生态学报,2007,27(2):571-578.
[4] 俞宏渊,陈宗莲.灯盏细辛的家化栽培[J].云南植物研究,2002,24:115-120.
[5] 马玉芳,许继宏,梅慧.灯盏菊(Erigeronbreviscapus(vant. ) Hand - mazz)单株组培工厂化生产种苗技术研究[J].云南大学学报(自然科学版),2001,23 (植物学专辑):113-116.
[6] 黄衡宇,李鹏,党承林.药用植物灯盏花的组织培养[J].广西植物,2008,28(5):685-689.
[7] 林丽飞,陶发清,胡先奇,等.灯盏花组培快繁与植株再生[J].安徽农业科学,2009,37(4):1580-1581.
[8] 吴毅歆,谢庆华,桑林,等.灯盏细辛的组织培养与快速繁殖[J].植物学通报,2005,22(1): 54-57.
