析因设计评价盲肠结扎穿孔(CLP)脓毒症大鼠模型严重程度的影响因素*
2014-09-14宋现青何振华蔡彬廖凯张森
宋现青 何振华 蔡彬 廖凯 张森△
(1广西医科大学第一附属医院结直肠肛门外科 广西南宁 530021;2贺州市人民医院普通外科 广西贺州 542800)
脓毒症是严重感染引起的有潜在致死风险的全身性炎症反应综合症(SystemicInflammatoryResponse Syndrome,SIRS)[1]。在美国,脓毒症的年发生率大约为千分之三[2],其中重症脓毒症(Severe sepsis)年死亡人数大约20万例。盲肠结扎穿孔(Cecal Ligation and Puncture,CLP)模型是脓毒症实验研究中的“金标准”[3],但是在CLP模型建立过程中,多种因素影响到动物模型的稳定性,而关于严重程度的影响因素研究尚少。本研究通过析因方差分析方法探索盲肠结扎穿孔(CLP)脓毒症大鼠模型严重程度的影响因素,以期为后续深入研究提供参考。
1 材料与方法
1.1 材料与分组 Wistar大鼠,雄性,清洁级,出生后7~12周,体重250~300g。购于广西医科大学实验动物中心。合格证号:SCXK桂2009-0005。广西医科大学动物伦理委员会核准实验方案,实验动物采用office软件包Excel表格随机数字编号。选取的影响因素及水平分别为:盲肠结扎比例25%、50%、75%;抗生素使用情况包括使用、未使用;穿刺针型号为12号和16号,按3×2×2水平,建立12个脓毒症组,具体分组为:A组:盲肠结扎比例25%+12号穿刺针头+术后予以抗生素;B组:盲肠结扎比例25%+12号穿刺针头+术后不予以抗生素;C组:盲肠结扎比例25%+16号穿刺针头+术后予以抗生素;D组:盲肠结扎比例25%+16号穿刺针头+术后不予以抗生素;E组:盲肠结扎比例50%+12号穿刺针头+术后予以抗生素;F组:盲肠结扎比例50%+12号穿刺针头+术后不予以抗生素;G组:盲肠结扎比例50%+16号穿刺针头+术后予以抗生素;H组:盲肠结扎比例50%+16号穿刺针头+术后不予以抗生素;I组:盲肠结扎比例75%+12号穿刺针头+术后予以抗生素;J组:盲肠结扎比例75%+12号穿刺针头+术后不予以抗生素;K组:盲肠结扎比例75%+16号穿刺针头+术后予以抗生素;L组:盲肠结扎比例75%+16号穿刺针头+术后不予以抗生素,另外建立正常对照组和假手术组,共分14组,每组6只。同时按相同分组方案建立脓毒症大鼠生存观察组,每组24只,观察大鼠生长情况至72h,记录大鼠一般表现及死亡情况。
1.2 CLP模型建立 制作过程参照 Wen,H[4]等以及Cuenca,A.G等[5]的操作流程。主要为:术前8h禁食,自由饮水;10%水合氯醛0.35mL/100g体积质量比腹腔麻醉至适宜状态,备皮、消毒、铺巾,于腹白线处作1.5~2.0cm切口,分离腹肌及腹膜至腹腔,取出盲肠,手术丝线确定相应结扎比例,盲肠结扎,相应穿刺针贯穿结扎盲肠一次,挤压盲肠使肠内容物溢出,回纳盲肠,关腹;其中抗生素组术毕予以头孢曲松钠25mg/kg每12h皮下注射,未使用组以等量生理盐水做对照。假手术组未行盲肠结扎及穿刺针穿孔处理,其余操作参照CLP模型组。正常对照组无额外处理。
1.3 大鼠模型取材检测 ①实验组大鼠建模24h后,麻醉放血处死大鼠,主动脉温生理盐水灌注后,切取约1.0g肝右副叶组织-80℃冻存;②取出冻存肝脏组织,冰面融化,PBS溶液洗涤2次,吸干水分,液氮条件下研至粉末状,转移至离心管中,记录粉末质量。③冰面条件下,加入100mg/1mL RIPA裂解液及1mM的pmsf液,旋涡震荡静置30 min后,4℃条件下14000r/m离心10分钟,微量移液器上清至另一灭菌EP管中保存;③取适量组织蛋白提取液用BCA法检测总蛋白浓度;剩余组织蛋白提取液使用悬液芯片技术定量检测IL-1α、TNF-α、IL-6表达水平。
1.4 统计分析 方法所有计量数据资料采用均数±标准差()表示,统计方法采用t检验、单因素方差分析和析因方差分析,生存时间曲线分析使用Log-rank检验,检验统计量P<0.05为有显著统计学意义。统计学分析采用SPSS 21.0软件包进行。
2 结 果
2.1 大鼠术后一般情况 CLP模型大鼠12h后开始出现明显细菌感染征象,主要有竖毛、蜷缩、少动、精神倦怠、少食、体重减轻、呼吸急促,脓尿、腹泻、眼角渗出物等。假手术组及正常组未见明显异常表现。24h后存活大鼠解剖腹腔内可见血性渗液,盲肠肿胀、粘连,严重的发生坏疽,色泽暗红或发黑。
2.2 各脓毒症大鼠生存率变化 模型组术后72h观察期内,假手术组大鼠死亡数为0。CLP模型组术后12h开始出现死亡且死亡高峰主要出现在24~48h内。CLP模型组的生存率均低于假手术组(P<0.05)。随着盲肠结扎比例增加,大鼠的生存率逐渐降低,经log-rank检验比较差异有统计学意义(A、E和I组;B、F和J组;C、G和 K组;D、H 和L组分别比较)(P<0.05)。12号和16号穿刺针头亚组大鼠生存率比较未表现显著统计学差异(P>0.05),但12号穿刺针头组的生存率均值低于16号组。比较头孢曲松钠使用情况对CLP脓毒症模型大鼠的生存率影响发现,术后予以抗生素组的大鼠生存率高于未予抗生素者(除了E/F,K/L组生存率相同外),但两者相较无显著统计学差异(P>0.05)。

表1 各组不同时间点的大鼠死亡数
2.3 细胞因子表达析因方差分析结果 统计结果分析显示大鼠肝脏组织IL-1α、TNF-α、IL-6在脓毒症组的表达水平均高于正常组和假手术组(P<0.05)(见表2),析因方差分析结果显示:固定因子盲肠结扎比例对IL-1α、TNF-α、IL-6的表达水平的作用具有显著统计学意义(P<0.05),而头孢曲松钠使用情况与盲肠结扎比例在IL-1α、TNF-α、IL-6的表达水平具有交互作用(P<0.05)(见表3)。

表2 各脓毒症组细胞因子表达水平均值差(Sham组-脓毒症组)(pg/mg)(n=84)
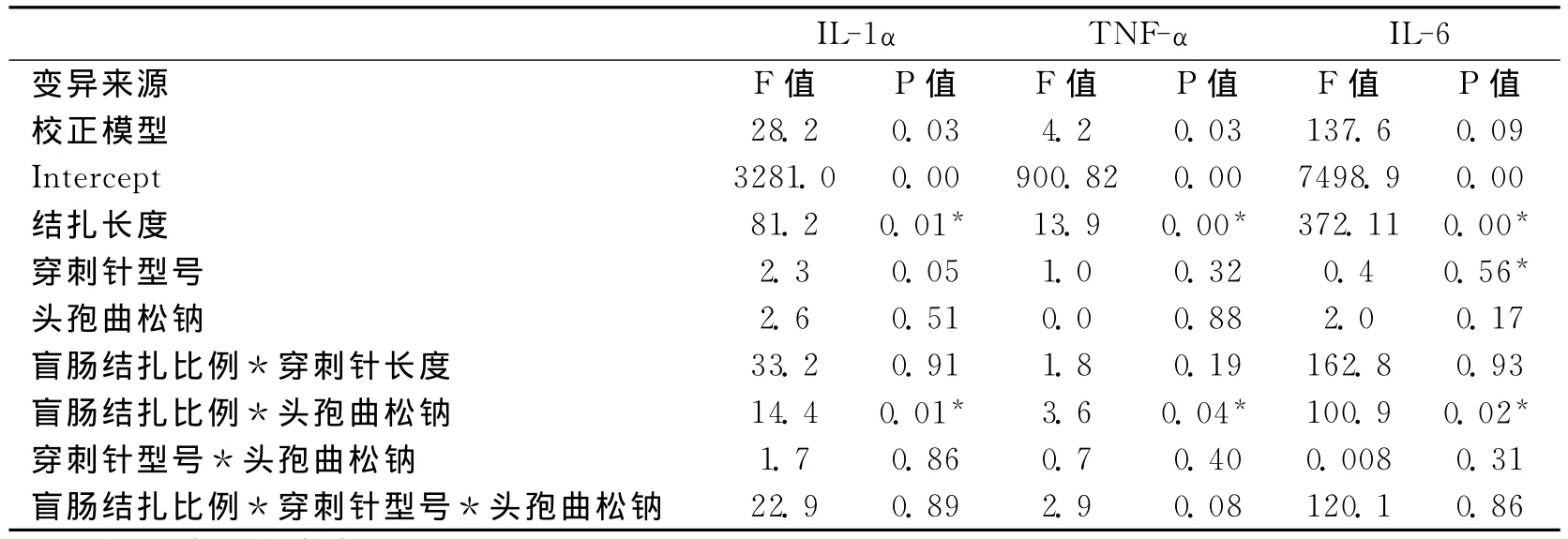
表3 wistar大鼠CLP脓毒症模型严重程度影响因素析因方差分析结果
3 讨 论
CLP模型动物在脓毒症的研究中得到广泛的应用,但是如何控制模型严重程度以得到满足不同研究目的脓毒症模型仍然是个难题。
根据本实验分组析因方差分析统计结果显示,盲肠结扎比例与CLP大鼠脓毒症严重程度存在相关性,即盲肠结扎比例越大,脓毒症病情越重,且更严重脓毒症的细胞因子水平变化速度快于较轻微的脓毒症,细胞因子的变化与脓毒症严重程度表现为非直线相关关系,盲肠结扎长度是脓毒症严重程度的独立决定因素,该结论与 Singleton KD 等[6~8]报告相似,盲肠末端的结扎提供了坏死组织源作为感染灶促进脓毒症进展,这点在临床脓毒症患者尤其是严重组织创伤者中经常见到[9]。结扎的比例越长则坏死感染组织越多,并且挤出的肠内容物量也随结扎比例的增加而逐渐增大,同时伴随死亡率的增加。
在动物模型中,由于动物的个体化差异,动物在对疾病的反应方面有很大的变异,因此严格控制盲肠结扎比例对复制可重复性的脓毒症模型至关重要。我们的研究结果表明盲肠结扎比例决定了脓毒症的进展速度以及病情严重程度,严格利用盲肠结扎比例条件可以获得研究周期内生存率0~100%脓毒症模型动物。模型死亡率的调整可随不同的实验研究目而不同;此外盲肠结扎比例的标准化可以简化脓毒症诱导的程序,从而使后续研究者更易掌握,但具体相关机制尚未明确。我们认为IL-1α、IL-6、TNFα表达水平上升协同坏死组织及病原菌持续释放入血的综合作用可能在整个过程中起到关键作用。
实验结果表明盲肠结扎比例与头孢曲松钠使用情况在细胞因子表达水平的交互作用表现为显著统计学差异(P<0.05),但是章德文等的研究认为脓毒症期间抗感染治疗未影响脓毒症预后转归。
相应机理[10]可能为头孢曲松钠与病原菌表面青霉素结合蛋白(Penicillin Binding Proteins,PBPs)共价结合从而抑制PBPs酶活性,进而菌体胞壁肽聚糖合成受抑,最终胞壁缺损,菌体裂解,但是同时细菌碎片被释放,如LPS或脂蛋白(Lipoprotein,LP),从而加剧脓毒症期间的抗炎级联反应。也因如此,针对脓毒症的治疗方案现在更多地倾向于早期液体复苏及使用针对细胞因子的抗体或抑制物疗法[11]。
此外不同穿刺针型号对IL-1α、IL-6、TNFα细胞因子的表达水平的主效应统计量P值均大于0.05,没有显著统计学差异,即12号和16号穿刺针造成的细胞因子表达量的总体均数相同,从而表明穿刺针型号与脓毒症严重程度没有显著性统计学相关关系,该结论与前期文献报告不同[5,12]。理论上讲,结扎盲肠穿刺针的大小决定了盲肠内容物流向腹腔中的量,该指标同脓毒症的严重程度密切相关[13]。可能的原因是所使用穿刺针直径的差异过小,从而使由穿刺针直径大小不同造成的腹腔肠内容物的量的差异不显著从而导致脓毒症大鼠细胞因子表达水平没有显著性改变,因此CLP模型的制作仍然需要进一步地完善。此外更深入的研究应该进行以探寻两者间的关联。
总之,盲肠结扎比例是决定CLP模型死亡率和炎症反应程度的重要决定因素,CLP模型的缺陷在于难于精确控制流入腹腔肠内容物的量或体积,并且致感染病灶易被网膜或周围组织包裹局限,无法达到脓毒症标准,从而影响后续分析研究。而通过引入不同穿刺针型号及抗生素使用情况等多种因素以完善CLP脓毒症模型的稳定性和标准化研究,更有利于CLP模型贴近于临床实际。
[1]Angus DC,van der Poll,T.Severe sepsis and septic shock.N Engl J Med[J].2013,369,840-851.
[2]Soong J,Soni N.Sepsis:recognition and treatment.Clin Med[J].2012,12,276-280.
[3]Fink MP.Animal models of sepsis.Virulence[J].2014,5,143-153.
[4]Wen H.Sepsis induced by cecal ligation and puncture.Methods in molecular biology[J].2013,1031,117-124.
[5]Cuenca AG,Delano MJ,Kelly-Scumpia KM,et al.Cecal ligation and puncture.Current protocols in immunology/edited by John E.Coligan...[et al.][J].2010,Chapter 19,Unit 1913.
[6]Rittirsch D,Huber-Lang MS,Flierl MA,et al.Immunodesign of experimental sepsis by cecal ligation and puncture.Nature protocols[J].2009,4,31-36.
[7]Toscano MG,Ganea D,Gamero AM.Cecal ligation puncture procedure.Journal of visualized experiments:JoVE[J].2011,
[8]Singleton KD,Wischmeyer PE.Distance of Cecum Ligated Influences Mortality,Tumor Necrosis Factor-Alpha and Interleukin-6 Expression following Cecal Ligation and Puncture in the Rat.European Surgical Research[J].2003,35,486-491.
[9]van der Poll,T.Preclinical sepsis models.Surgical infections[J].2012,13,287-292.
[10]Kong KF,Schneper L,Mathee K.Beta-lactam antibiotics:from antibiosis to resistance and bacteriology.APMIS:acta pathologica,microbiologica,et immunologica Scandinavica[J].2010,118,1-36.
[11]Iba T,Yamada A,Hashiguchi N,et al.New therapeutic options for patients with sepsis and disseminated intravascular coagulation.Pol Arch Med Wewn[J].2014,[12]Zanotti-Cavazzoni SL,Goldfarb RD.Animal models of sepsis.Critical care clinics[J].2009,25,703-719,viiviii.
[13]Dejager L,Pinheiro I,Dejonckheere E,et al.Cecal ligation and puncture:the gold standard model for polymicrobial sepsis?Trends in microbiology[J].2011,19,198-208.
