紫杉醇和微小RNA对非小细胞肺癌的协同抑制作用
2014-09-13郭威早严之红刘会臣
郭威早 纪 红 严之红 刘会臣
(航天中心医院高干二科,北京 100049)
根据流行病学调研,肺癌是我国男性中发病率最高的恶性肿瘤,在女性中的发病率也高居第二位〔1〕。紫杉醇是由红豆杉科植物中提取的化合物,1992年获得美国食品药品管理局(FDA)批准用于肿瘤治疗〔2〕,在非小细胞肺癌治疗中的应用也在逐步推广〔3〕。然而,由于抗药性的不断出现,如何在紫杉醇的抗肿瘤治疗中实现增敏增效业已成为迫切的临床需求〔4〕。在已经试验的临床化疗策略中,采用表皮生长因子(EGFR)抑制剂与紫杉醇配合的疗法展示了良好的临床运用前景〔5〕。微小RNA (miRNA)是基因调控的核心途径之一,在细胞的生长、发育、分化以及对环境的适应中发挥着非常重要的作用〔6,7〕,通过选择特定的miRNA实现对EGFR的特异性抑制,将抗EGFR的miRNA和紫杉醇联合运用,可以发挥化药给药途径简便而生物药特异性高等优势。本研究观察EGFR特异性调控miRNA与紫杉醇对肺癌细胞的协同抑制效应。
1 材料与方法
1.1肺癌细胞株体外培养 人非小细胞肺癌细胞株A549和HCC827来源于美国ATCC公司,A549的培养基为F-12K,HCC827的培养基为RPMI-1640,使用前均加入10%胎牛血清。培养基及胎牛血清购自Invitrogen公司。培养条件为Forma-3110型二氧化碳温箱,5% CO2,37℃。初期培养采用200 ml培养瓶,结束后采用0.25% 胰蛋白酶合并0.53 mmol/L EDTA溶液处理10 min,细胞脱壁收集后以10 ml相应无血清培养基清洗3遍,转入12孔板进行分盘培养,每孔加入细胞数约5×104, 加入含血清培养基1 ml。
1.2紫杉醇处理 紫杉醇(Sigma-Aldrich公司)以二甲基亚砜(DMSO)制成1 μmol/L储存液,以相应无血清培养基进行梯度稀释,处理细胞的终浓度分别为0.01、0.1、1、2.5、5、10、15、30、50、100 nmol/L,处理时间为72 h。每个浓度下,有3个培养孔同时处理,检测结果取均值。
1.3调控表皮生长因子miRNA的选择 以微小RNA“种子区”(seed)完全匹配为首轮筛选标准,从TargetScan和miRDB两个微小RNA数据库中筛选。次轮筛选标准:候选微小RNA必须被上述两个数据库预测为人EGFR的调节miRNA。依据上述标准,最终选择了hsa-miR-545-3p(简称miR-545)。
1.4miR-545的细胞转染 miR-545前体增强剂购自Ambion公司,用于对肿瘤细胞内EGFR表达的mRNA发挥特异性抑制作用。miRNA转染采用Neuromics公司iFect转染试剂盒,以miR-545紊乱序列作为阴性对照。转染在肿瘤细胞分盘培养前进行。miRNA转染剂量在前期预实验的基础上,正式实验剂量选择为20 nmol/L。细胞在转染状态下继续培养48 h后进入后续实验。
1.5MTT法细胞生长抑制实验 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(噻唑蓝,MTT)购自Sigma-Aldrich。药物处理结束后,清洗培养孔,然后加入200 μl 无血清培养基,再加入10 mmol/L MTT至终浓度1.0 mmol/L。37℃孵育3小时后加入200 μl 10% HCl-SDS混匀,37℃孵育3 h后于570 nm波长进行吸光度分析。
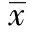
2 结 果
2.1紫杉醇对肺癌细胞的抑制具有显著剂效关系 紫杉醇对A549和HCC827非小细胞肺癌细胞的生长均表现出强烈的抑制作用。生长抑制作用随剂量的增加而增强。在0.1~5.0 nmol/L的剂量区间内,抑制效应随剂量的增加表现出接近于线性的同步增加。剂量超过15 nmol/L后,抑制效应渐趋饱和 (图1)。
2.2miR-545对紫杉醇的抑癌作用具有增强效应 肺癌细胞在进行紫杉醇处理之前如果增加miR-545前体的细胞转染,则总体抑癌作用较单纯紫杉醇明显增强(图1)。 2株肺癌细胞相比较,以半抑制浓度(IC50)为指标对于A549细胞,miR-45未转染组IC50值为6.30 nmol/L,转染组IC50值为4.58 nmol/L,对于HCC827细胞,miR-45未转染组IC50值为4.36 nmol/L,转染组IC50值为2.55 nmol/L,miR-545对HCC827抑制作用的强化(IC50减少41.6%)高于对A549抑制作用的强化(IC50减少27.3%) (P<0.05)。
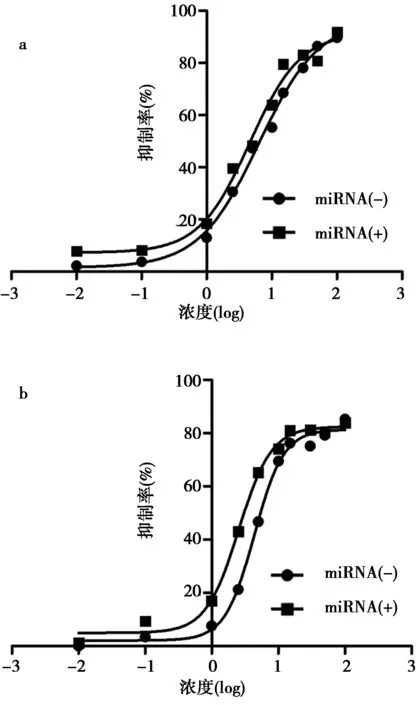
a.A549肺癌细胞株,b.HCC827肺癌细胞株;曲线为非线性回归拟合,miRNA指miR-545前体
3 讨 论
耐药性在肺癌的临床治疗中已构成一个重要的挑战,一些肺癌的治疗在初期表现出临床疗效之后出现抗药,从而导致癌组织重新进展〔8,9〕。作为临床应对策略,抗肿瘤治疗领域内开展了多种手段的探索,包括采用新技术建立新的给药途径,以及利用分子生物学技术对药物进行增效等〔10〕。在抗肺癌药耐药的机制中,药物代谢以及分子信号传导的改变是其中重要因素〔11,12〕,而miRNA在代谢调节和分子信号传导中均具有关键的调节作用,因此在化疗耐药性方面必然引起关注。事实上,基于临床观察和实验研究,miRNA与肺癌耐药性的密切联系已形成一定的共识〔13〕,正在逐步向临床应用拓展。
紫杉醇作为一种从植物提取的具有抗癌活性的天然化合物,是抗肿瘤药物研究的热点,其运用范围也在逐步扩大,在非小细胞肺癌中主要是以联合用药的方式促进提高化疗的疗效。以紫杉醇在非小细胞肺癌的化疗中与血管表皮生长因子(VEGFR)抑制剂联合运用为例,虽然增加了药效,但生存率并没有明显改善,一种可能的解释是毒性的增加〔14〕。化疗药的联合运用,虽然在很多情况下可以增加药效,但毒性的增加成为一个较大的负面因素。miRNA属于内源性成分,同时具有高度的特异性,因此其毒性可控性较好。抑制表皮生长因子(EGFR)是非小细胞肺癌临床治疗的重要手段〔8〕,所以本研究采用针对EGFR的miRNA与紫杉醇进行协同。在2株代表性的非小细胞肺癌中均表现出增加药效作用,在细胞水平上验证了化药和生物制剂的协同抗癌作用。
在本次实验观察中,2株非小细胞肺癌细胞A549和HCC827在紫杉醇生长抑制和miR-545与紫杉醇的协同抑制中的表现不尽相同。以IC50观察,HCC827在本研究中表现出对紫杉醇更高的敏感性,因此提示非小细胞肺癌在细胞水平上也存在药效的差异。此外,miR-545在HCC827细胞中对紫杉醇的增效作用无论在幅度,还是在显著性方面都高于A549细胞。HCC827细胞在EGFR酪氨酸激酶区域有一个获得性突变(E746-A750缺失), 这个突变有可能增加了该细胞对于EGFR抑制的敏感性〔15〕。
本研究以分子生物学手段,通过选择性的miRNA调节,在非小细胞肺癌中观察到miR-545对紫杉醇生长抑制作用的协同效应,实验结果符合理论预期。这一结果对改善非小细胞肺癌的化疗抗药性问题提供了具有实用价值的分子药理学依据,这种结合化疗药物和生物制剂的抗癌治疗手段值得深入探讨。
4 参考文献
1陈万清, 张思维, 郑 荣,等. 中国肿瘤登记地区2007年肿瘤发病和死亡分析 〔J〕. 中国肿瘤, 2011;20(3):162-9.
2Nightingale SL. From the food and drug administration 〔J〕. JAMA, 1992;268(11):1390.
3Ramalingam S,Belani CP.Paclitaxel for non-small cell lung cancer 〔J〕. Expert Opin Pharmacother,2004;5(8):1771-80.
4Patel N, Chatterjee SK, Vrbanac V,etal.Rescue of paclitaxel sensitivity by repression of prohibitin1 in drug-resistant cancer cells 〔J〕. Proc Natl Acad Sci USA,2010;107(6):2503-8.
5Brugger W, Thomas M. EGFR-TKI resistant non-small cell lung cancer (NSCLC): new developments and implications for future treatment 〔J〕. Lung Cancer,2012;77(1):2-8.
6Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function 〔J〕. Cell,2004;116(2):281-97.
7Hatfield SD, Shcherbata HR, Fischer KA,etal. Stem cell division is regulated by the microRNA pathway 〔J〕. Nature,2005;435(7044):974-8.
8Paez JG, Janne PA, Lee JC,etal. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy 〔J〕. Science,2004;304(5676):1497-500.
9Thomas RK. Overcoming drug resistance in ALK-rearranged lung cancer 〔J〕. N Engl J Med,2014;370(13):1250-1.
10Taratula O, Garbuzenko OB, Chen AM,etal. Innovative strategy for treatment of lung cancer: targeted nanotechnology-based inhalation co-delivery of anticancer drugs and siRNA 〔J〕. J Drug Target,2011;19(10):900-14.
11Molina-Pinelo S,Gutierrez G,Pastor MD,etal. MicroRNA-dependent regulation of transcription in non-small cell lung cancer 〔J〕. PLoS One,2014;9(3):e90524.
12Ochi N, Takigawa N, Harada D,etal. Src mediates ERK reactivation in gefitinib resistance in non-small cell lung cancer 〔J〕. Exp Cell Res,2014;322(1):168-77.
13Cherni I, Weiss GJ. miRNAs in lung cancer: large roles for small players 〔J〕. Future Oncol,2011;7(9):1045-55.
14Laurie SA, Solomon BJ, Seymour L,etal. Randomised, double-blind trial of carboplatin and paclitaxel with daily oral cediranib or placebo in patients with advanced non-small cell lung cancer: NCIC Clinical Trials Group study BR29 〔J〕. Eur J Cancer,2014;50(4):706-12.
15Sakuma Y, Yamazaki Y, Nakamura Y,etal. WZ4002, a third-generation EGFR inhibitor, can overcome anoikis resistance in EGFR-mutant lung adenocarcinomas more efficiently than Src inhibitors 〔J〕. Lab Invest,2012;92(3):371-83.
