人参皂苷Rg1通过下调TGFβ1及βigh3表达延缓拟衰老小鼠肾脏纤维化
2014-09-13金建生陈晓春
叶 洪 金建生 陈晓春 张 静
(福建医科大学附属协和医院肾内科,福建 福州 350001)
与衰老相关的研究一直是生命科学领域的研究热点。肾脏衰老的主要组织学特征是肾小球基底膜增厚、系膜基质增生、节段性肾小球硬化、肾小管萎缩及肾小管间质纤维化等〔1〕。中药人参在我国应用已有几千年的历史,人参皂苷Rg1作为人参的主要活性成分之一,具有肯定的促智、抗衰老、抗氧化和提高免疫力等作用。研究表明,人参皂苷具有抗肾炎、保护肾功能的作用〔2〕。但该药物对于肾脏衰老的机制研究较少。本研究通过建立大剂量D-半乳糖所致的小鼠亚急性衰老模型,观察人参皂苷Rg1对减轻肾脏衰老的病理变化,并探讨其对拟衰老小鼠肾组织纤连蛋白(FN)、转化生长因子(TGF)β1及β诱导蛋白IG-H3(βigh3)等水平表达的影响。
1 材料和方法
1.1实验动物与分组 清洁级雄性昆明种小鼠78只,均为三月龄,体重30~40 g(购自上海斯莱克公司,合格证号SCXK 沪 2003-0003)。SPF环境下饲养。随机分成六组,每组13只:青年组不进行任何处理,造模开始即留取肾组织;模型组以400 mg·kg-1·d-1的D-半乳糖(上海试剂二厂)进行腹腔注射,而Rg1预防组1~3及科素亚对照组予以D-半乳糖注射的同时另分别给予5、10、20 mg·kg-1·d-1的Rg1(吉林大学基础医学院有机化学教研室提供,纯度>98%)腹腔注射,或10 mg·kg-1·d-1的科素亚(杭州默沙东制药有限公司)灌胃。12 w后,10%水合氯醛0.1 ml/20 g腹腔注射麻醉小鼠后,腹正中切开,原位灌洗,剥离双肾,取一侧肾脏置于新鲜配制的4%多聚甲醛固定24 h(置于4℃冰箱),用于制备石蜡切片;另一侧肾脏分成数块,部分置于4%多聚甲醛/0.1 mol/L PBS(pH 7.0~7.6)固定2~4 h,20%蔗糖溶液4℃浸泡过夜后,进行冰冻切片,进行SA-β-gal的组织化学染色,其余置于干燥EP管中,液氮冷冻后-80℃冻存,用于超氧化物歧化酶(SOD)检测及Western印迹。
1.2药品和试剂 SOD试剂盒购自日本同仁化学研究所。X-gal为Sigma公司产品。兔抗小鼠FN多克隆抗体购自LAB VISION公司,兔抗小鼠βigh3单克隆抗体购自R&D Systems公司。兔抗小鼠TGFβ1多克隆抗体购自abCAM公司。二抗为羊抗兔试剂,均购自相应公司。
1.3SA-β-gal染色〔3〕SA-β-gal染色按常规方法操作,染色后的衰老细胞为靛蓝色,显微镜下每张切片按顺时针方向随机选取20个视野(×100),结果采用半定量评分:0分:无阳性染色出现;1分:偶见小管内有微弱染色;2分:部分小管节段出现阳性染色;3分:大部分小管出现弥漫性阳性染色,计算每张切片得分的平均值。
1.4肾组织SOD活力测定 按SOD Assay Kit-WST试剂手册进行。
1.5过碘酸雪夫(PAS)染色和肾脏病理分析〔4〕PAS染色按常规方法操作,光镜下每张切片按顺时针方向随机选取20个肾小管-间质视野(400倍),行小管-间质损伤评分:0分:肾小管间质无明显病变;0.5分:小的局灶性的小管间质损伤;1分:皮质区<10%的小管间质损伤;2分:皮质区存在10%~25%的小管间质损伤;3分:皮质区存在25%~75%的小管间质损伤;4分:皮质区存在≥75%的小管间质损伤,计算每张切片平均值。同时选取20个肾小球(400倍),计算每个小球PAS染色阳性面积和肾小球总面积,求两者的比值;20个小球此比值的均数即为每张切片的系膜增生指数(MMEI)。
1.6免疫组化方法检测FN、TGFβ1及βigh3 2 μm石蜡组织切片黏附于多聚赖氨酸黏片剂处理后的载玻片上,经60℃烤片,常规脱蜡至水,3%过氧化氢室温孵育10 min以阻断内源性过氧化物酶,FN、TGFβ1及βigh3 分别以0.01 M柠檬酸盐缓冲液(pH6.0)高压抗原修复,分别滴加一抗(FN 1∶250、TGFβ1 1∶100、βigh3 1∶100)4℃孵育过夜后,以二抗(羊抗兔)37℃孵育30 min,二氨基联苯胺(DAB)显色,苏木素染核,分化、返蓝、脱水、透明、封片。每组染色均设以PBS代替一抗作阴性对照。取染色后的切片,在高倍镜(200~400倍) 下随机选择20个肾小球视野或20个肾小管-间质视野,根据染色强度和面积,按下列方法进行半定量评分,染色强度标准: 基本不着色者0分,着色淡者(低倍镜下可疑阳性,高倍镜下明确阳性)1分,适中者(低倍镜下明确阳性)2分,深者(低倍镜下强阳性)3分;染色面积标准:0分:无染色或微弱染色,1分:染色面积<25%,2分:染色面积在25%~50%之间,3分::染色面积在50%~75%之间,4分:染色面积> 75%。将染色强度与染色面积得分相乘,所得分数为该例的阳性积分。每组阳性总积分除例数等于各组的平均阳性积分。
1.7Western印迹检测TGFβ1及βigh3 取肾组织加裂解液后匀浆,离心,取上清,测蛋白浓度。加蛋白上样液于10%+十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳分离,电转移蛋白至聚偏氟乙烯(PVDF)膜上,5%无脂奶粉封闭,加一抗TGFβ1(1∶2 000)、βigh3(1∶2 000)孵育4℃过夜。含0.1%吐温PBS洗膜,辣根过氧化物酶标记的抗兔IgG中孵育1 h,洗膜,以化学发光法显示结果。采用Alpha EmagerTM 2200凝胶成像及分析系统,于可见光下采集底片上的蛋白条带图像,通过与相应β-actin条带密度比较,计算各条带密度相对值。
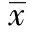
2 结 果
2.1一般情况 青年组的小鼠毛色白,其富含光泽,行动和反应情况灵敏。实施造模的1个月之后,各组小鼠均出现程度各异的皮毛粗糙和发黄,且精神萎靡,相关行动较为迟缓,且不喜活动,以模型组情况最为显著。而以Rg1实施预防的各组整体情况均优于模型组,其中Rg1 剂量为20 mg·kg-1·d-1时最优。
2.2衰老相关β-半乳糖苷酶染色 各组SA-β-gal染色阳性的细胞均定位于肾小管,肾小球中鲜有表达。与青年组相比,模型组及各预防组染色阳性细胞均显著增加(均P<0.01)。与模型组相比,Rg1 20 mg·kg-1·d-1组与科素压组衰老细胞均显著减少(均P<0.01)。见图1,表1。
2.3肾组织SOD活力测定 与青年组相比,模型组及各预防组肾脏SOD活力均显著下降(P<0.01)。与模型组比较,各预防组SOD活力均有不同程度回升(均P<0.01),以Rg1 20 mg·kg-1·d-1预防组效果最明显。后者与Rg1 10 mg·kg-1·d-1组及科素亚组相比,有显著性差异(P<0.01)。见表1。

表1 各组小鼠衰老相关性指标的情况对比±s,n=13)
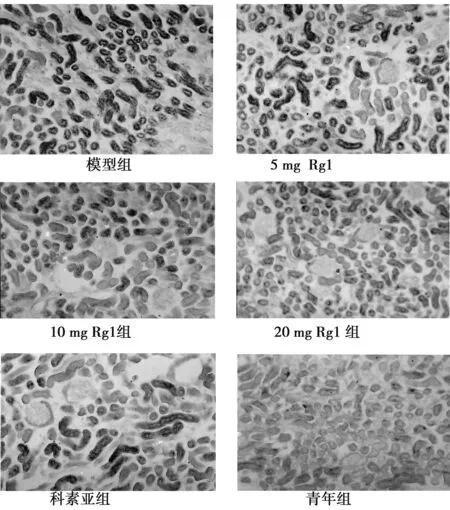
图1 各组小鼠SA-β-gal染色(×100)
2.4PAS染色镜下观察 建模12 w,模型组可见肾小球肥大,系膜增生,节段性肾小球硬化,基底膜增厚以及局灶性小管间质损伤,炎性细胞浸润,小管扩张、萎缩、坏死等。Rg1 20 mg·kg-1·d-1预防组与科素亚组能显著减轻肾小管间质病变及小球系膜增生(均P<0.01)。在改善肾小管间质损伤方面,Rg1 20 mg·kg-1·d-1预防组与科素亚组相比差异无统计学差异(P>0.05);在减轻小球系膜基质增生程度上,Rg1 20 mg·kg-1·d-1预防组不如科素亚组(P<0.05)。见表2,图2。

表2 各组小鼠肾脏病理改变状况±s,n=8)
2.5肾组织FN、TGFβ1以及βigh3的表达 FN主要定位于肾小球系膜基质,肾小管间质亦有少量表达。TGFβ1、βigh3主要分布于肾小管上皮细胞和基底膜,而肾小球中仅有微量表达。模型组肾小球及肾小管阳性染色显著增多。各预防组可见不同程度的表达降低。见图3~图5,表3。
2.6Western印迹法检测肾皮质TGFβ1、β igh3蛋白相对表达量 单次检测后,青年组中TGFβ1、β igh3仅有微量表达,模型组TGFβ1、β igh3蛋白水平明显升高。科素亚组和Rg1干预组TGFβ1、β igh3蛋白水平显著下降,见图6。

表3 各组小鼠的肾组织FN和TGFβ1以及βigh3染色平均阳性积分比较±s,n=13)
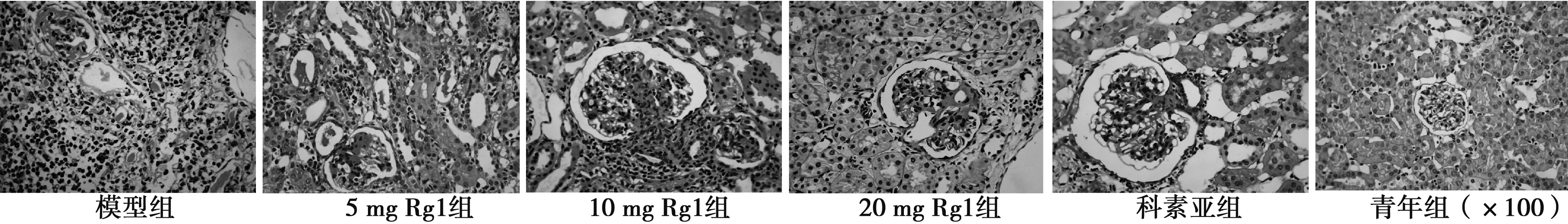
图2 各组小鼠肾脏PAS染色(×400)
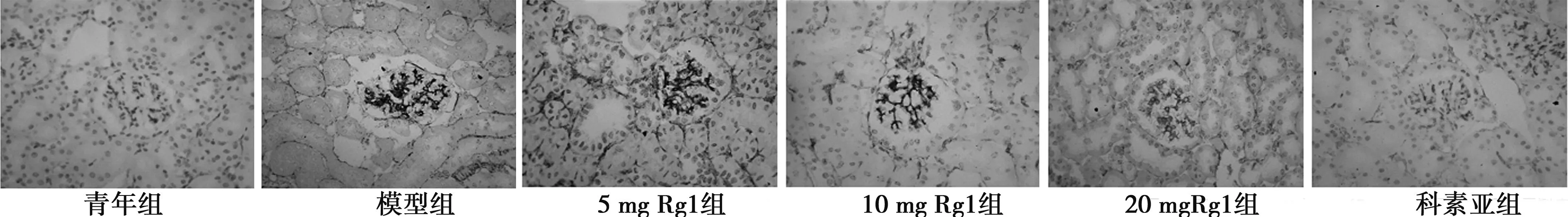
图3 各组大鼠肾脏FN表达及部位(×400)
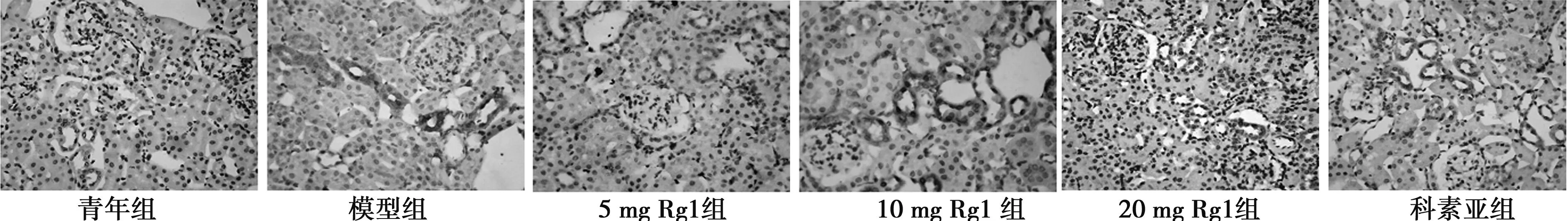
图4 各组大鼠肾脏TGFβ1表达及部位(×400)
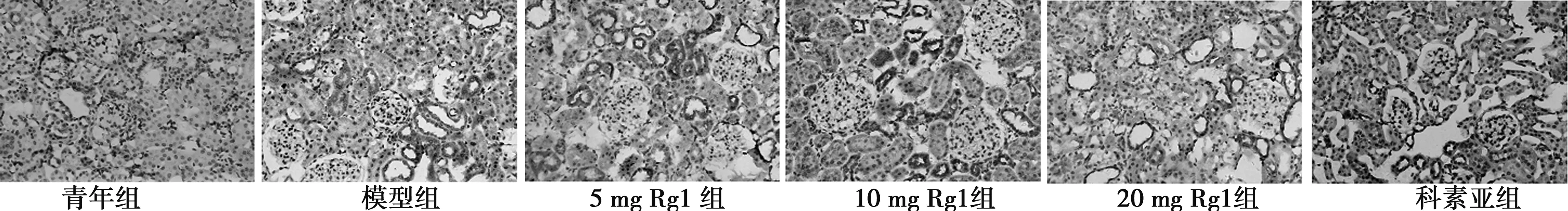
图5 各组大鼠肾脏βigh3表达及部位(×200)
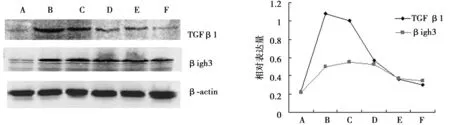
A:青年组;B:模型组;C:Rg1 5mg/kg/d组;D:Rg1 10mg/kg/d组;E:Rg1 20mg/kg/d组 F:科素亚组
2.7相关性分析 肾小管上皮细胞TGFβ1阳性信号与SA-β-gal染色阳性信号呈显著正相关(r=0.756,P<0.01)。βigh3与TGFβ1染色阳性积分呈显著正相关(r=0.927,P<0.01)。
3 讨 论
现代药理学认为,人参中富含多类化学成分,如皂苷和多肽以及有机酸和脂溶性成分等,尤以人参皂苷的作用显著〔5〕。在多类实验型肾病模型中,均可表明人参皂苷具有较好的肾保护效果,其可不同程度上缓解膜性肾病模型中的肾小管间质性损伤和细胞中线粒体肿胀,以及足突融合和基底膜增厚〔6〕。有学者在研究中还发现〔7〕,人参皂苷能够启动机体近曲小管的上皮细胞有关DNA复制从而修复由庆大霉素导致的肾小管组织坏死而达到治疗效果。
本研究结果提示人参皂苷Rg1可能通过抗氧化机制来发挥其对抗肾脏衰老的作用。究其原因,认为这可能是因为Rg1抗氧化作用可能是肾脏保护相关作用的主要机制〔8〕。Rg1通过提升机体的抗氧化能力,同时可清除已形成的氧自由基,抑制有关细胞的凋亡,以及调控血管活性类物质达到延缓衰老的目的〔9〕。应用不同剂量人参皂苷Rg1可缓解肾小球FN的沉积,同时下调小鼠肾小管上皮细胞TGFβ1和βigh3等蛋白的表达,以20 mg Rg1预防组最为明显。此外,20 mg Rg1预防组虽可显著缓解对于肾小管间质的损伤,但在减少肾小球系膜基质的增生程度上,不如科素亚组。人参皂苷Rg1可能对于拟衰老过程肾脏损伤具有一定的保护作用。FN和TGFβ1以及βigh3水平下调亦有可能是人参皂苷Rg1减缓肾脏的衰老机制之一〔10〕。其中的TGFβ主要是一种对细胞的生长分化进行调节的重要因子,其过度形成能导致不可逆的机体组织纤维化,其中以TGFβ1和组织纤维化拥有最为紧密的联系〔11〕。有报道称〔12〕,TGFβ1对于机体成纤维细胞以及单核细胞均有一定趋化作用,其在肾脏的衰老过程内,通常随着年龄增加而表达水平上升。TGFβ1通常定位在肾小管细胞及间质细胞,同时,SA-β-gal染色呈阳性的细胞亦主要定位在肾小管,少见于肾小球,相关分析发现,SA-β-gal染色与TGFβ1表达呈明显的正相关,这表明衰老小管细胞有可能为TGFβ1蛋白表达的一个主要来源。FN作为TGFβ1效应分子,其在模型组的肾小球中沉积显著增大,但其他各Rg1预防组均可减少FN表达,以Rg1 20 mg·kg-1·d-1的效果最佳,这可能是因为Rg1通过下调机体TGFβ1表达水平来纠正发生于细胞外基质的非正常代谢,从而缓解肾脏纤维化程度〔13〕。近年来研究认为βigh3为TGFβ1下游分子,能够作为TGFβ1的一种活性指标。Li等〔14〕报道,βigh3可参与到细胞间黏附和迁移及增殖分化和信息传递过程,在正常肾组织内,其表达部位常局限在肾脏近端的肾小管基底膜,但在肾小球旁器血管成分细胞中亦有βigh3的表达,这亦提示βigh3可能在所介导的肾小球硬化及间质纤维化等过程内发挥出重要作用,符合本文的报道结果。
4 参考文献
1Epstein M.Aging and the kidney〔J〕.J Am Soc Nephrol,1996;7(8):1106-22.
2Zhan S,Guo W,Shao Q,etal.A pharmacokinetic and pharmacodynamic study of drug-drug interaction between ginsenoside Rg1, ginsenoside Rb1 and schizandrin after intravenous administration to rats〔J〕.J Ethnopharmacol,2014;152(2):333-9.
3李 琼,左红波,张 眠,等.小鼠脂肪间充质干细胞体外培养时间与细胞衰老关系初探〔J〕.中国免疫学杂志, 2013;29(10):1028-32.
4田 晓,史国辉,孙淑丰,等.流式细胞仪在检测系膜细胞衰老特征中的应用〔J〕.中国老年学杂志,2013;33(19): 4775-7.
5王小勇,毕志刚,王云贵,等.人参皂苷和枸杞多糖对UVB诱导培养的成纤维细胞提早衰老的影响〔J〕.中华皮肤科杂志,2010;43(3):184-7.
6陆海芬,陈兆耀.人参皂苷 Rb1对谷氨酸导致海马神经元损伤的保护作用〔J〕.中华临床医师杂志(电子版),2013;7(8):3467-70.
7Wang Y,Kan H,Yin Y,etal.Protective effects of ginsenoside Rg1 on chronic restraint stress induced learning and memory impairments in male mice 〔J〕.Pharmacol Biochem Behav,2014;120:73-81.
8He Q,Sun J,Wang Q,etal.Neuroprotective effects of ginsenoside Rg1 against oxygen-glucose deprivation in cultured hippocampal neurons〔J〕.J Chin Med Assoc,2014;77(3):142-9.
9殷胜骏,彭桂英,顾立刚,等.人参皂苷对DC2.4吞噬抗原和表达CD40分子的影响〔J〕.中华中医药学刊,2012;30(7):1487-9.
10Gao QG,Chan HY,Man CW,etal.Differential ERα-mediated rapid estrogenic actions of ginsenoside Rg1 and estren in human breast cancer MCF-7 cells〔J〕.J Steroid Biochem Mol Biol,2014;141:104-12.
11宫志华,孙 龙,赵晓娟,等.人参皂苷Rg2抗拟缺血再灌注损伤大鼠海马神经细胞β1-40淀粉样蛋白聚集研究〔J〕.中华老年心脑血管病杂志,2014;16(1):78-80.
12Zhou Y,Li HQ,Lu L,etal.Ginsenoside Rg1 provides neuroprotection against blood brain barrier disruption and neurological injury in a rat model of cerebral ischemia/reperfusion through downregulation of aquaporin 4 expression 〔J〕.Phytomedicine,2014;21(7):998-1003.
13He Y,Zhao H,Su G.Ginsenoside Rg1 decreases neurofibrillary tangles accumulation in retina by regulating activities of neprilysin and PKA in retinal cells of AD mice model 〔J〕.J Mol Neurosci,2014;52(1):101-6.
14Li H,Xu J,Wang X,etal.Protective effect of ginsenoside Rg1 on lidocaine-induced apoptosis〔J〕.Mol Med Rep,2014;9(2):395-400.
