体外BMSCs对MBP68-86刺激淋巴细胞增殖的免疫调节作用
2014-09-13何展文李栋方刘木金李平甘罗向阳梁立阳李文益
何展文 李栋方 刘木金 孟 哲 李平甘 罗向阳 梁立阳 李文益
(中山大学孙逸仙纪念医院,广东 广州 510120)
炎症性脱髓鞘疾病是一种基因、病毒感染、环境等多因素相互作用引起的神经系统自身免疫性疾病,外源的病毒感染后可激活淋巴细胞引起特异性免疫应答,病毒的抗原决定簇与髓鞘抗原相似,导致交叉免疫反应,从而攻击自身的髓鞘组织。目前应用于炎症性脱髓鞘疾病的自身免疫性脑脊髓炎(EAE)动物模型主要以髓鞘碱性蛋白(MBP)、豚鼠脑脊髓组织匀浆(BSCH)、蛋白脂质蛋白(PLP)或其多肽片段、髓鞘素(myelin)等作为免疫抗原。研究骨髓间充质干细胞(BMSCs)对EAE特异性致敏抗原刺激后淋巴细胞增殖的免疫调节作用,国内外文献报道并不多见〔1〕。本实验拟了解体外异种大鼠BMSCs对MBP68-86抗原刺激后淋巴细胞免疫调节作用,为BMSCs对EAE的免疫调节治疗提供依据。
1 材料与方法
1.1主要实验材料 胎牛血清、DMEM培养基购自美国HyClone公司,胰蛋白酶购置上海吉泰科技有限公司。FITC小鼠IgG1购自BD pharmingen公司;小鼠抗大鼠CD44、PE抗大鼠CD3、PE小鼠IgG1、PE抗大鼠CD4、PE抗大鼠CD8、PE抗小鼠或大鼠CD25购自Serotec公司;FITC抗大鼠CD90、PE抗大鼠CD106、PE抗大鼠CD45、PE小鼠IgG2a、PE抗大鼠CD11b/c、PE Armenlan Hamster和PE抗小鼠或大鼠CD29购自 Biolegend公司;CD34 PE购自Santa Cruz Biotechnology公司。ConA购自 sigma公司,MBP68-86(bs-0380p)购自北京博奥森生物技术有限公司。完全佐剂购自广州捷倍斯生物科技有限公司。绿色荧光染料羟基荧光素二醋酸盐琥珀酰亚胺脂(CFSE)购自美国Molecular Probes公司。IFN-γ、TGF-β1和 IL-10ELISA试剂盒购自上海麦约尔生物科技有限公司。
1.2实验动物 健康Wistar大鼠,180~220 g左右,购自广东省南方医科大学动物实验中心,合格证号:广东省实验动物检测所合格证2006-0015号。健康SD大鼠,200 g左右,购自广东省医学动物实验中心,合格证号:广东省实验动物检测所合格证2008-0002号。
1.3BMSCs的分离培养和表型鉴定 断颈处死Wistar大鼠,放置超净台上,剪开大鼠后肢皮肤,充分暴露剥离腿部肌肉,取出股骨和胫骨。剪去其两端骨骺,于10 cm2培养皿内使用含10%胎牛血清的DMEM培养液冲洗骨髓。用BMSCs完全培养基反复吹打使之形成单细胞悬液,加入含10%胎牛血清的DMEM培养液,接种于培养瓶中,37℃,5%CO2培养。贴壁3 d后换液,每隔3 d换液直至传代,待细胞80%~90%融合的时候传代,第4代(P4)用于实验。用0.25%胰蛋白酶消化收集细胞移入离心管中,1 100 r/min离心4 min,弃去上清。加磷酸盐缓冲液(PBS)溶液重悬细胞,吸取100 μl细胞悬液(约3.0×105个细胞)加入EP管内。按量加入与PE或FITC标记的IgG1、CD34 、CD44、CD45、CD11b/c、CD29、CD90、CD105单克隆抗体,避光孵育30 min,上机检测。
1.4脾脏单个核细胞(MNCs)的制备和标记 (1)无菌条件下取出SD大鼠脾脏,PBS洗涤,剪碎,放入研磨器研磨,收集细胞悬液,过200目尼龙网过滤,制成细胞悬液。(2)经Tris-NH4Cl缓冲液裂解红细胞,PBS后涤2次后收获单个核细胞,台盼蓝计数备用。(3)用含15%胎牛血清DMEM培养液调整单个核细胞混悬浓度至1×107个/ml,每毫升细胞悬液加入5 μl CFSE,终浓度为5 μmol/L,37℃孵育 15 min。(4)用等体积小牛血清终止10 min,PBS洗涤3次后用完全培养基将染色后的细胞稀释到1×106个/ml备用,洗涤及离心过程中注意避光。
1.5方法
1.5.1分组 (1)将MNCs细胞混悬液加入96孔板中,细胞数每孔2×105个/孔。(2)加入不同浓度BMSCs和空白对照,使BMSCs与MNCs细胞的比例分别为1∶10、1∶20和1∶40。每孔分别加入终浓度为ConA 5 μg/ml,MBP 68~865 μg/ml和无抗原刺激。(3)每组实验做3复孔,37℃,5%CO2培养孵育96 h。
1.5.2淋巴细胞增殖能力检测 收集培养细胞,用抗CD4-PE作细胞表面分子染色,以CFSE为第一荧光(FL1),PE标记抗体为第二荧光(FL2),用CellQuest PRO软件获取数据,Modfit软件分析淋巴细胞的增殖能力。细胞分裂指数(CDI)采用刺激后CFSE荧光强度减弱的细胞百分比与未采用刺激后培养荧光强度减弱细胞百分比的比例。
1.5.3细胞上清血细胞因子检测 细胞与抗原刺激剂共孵育后,收集细胞培养上清液。通过ELISA 方法检测干扰素(IFN)-γ、转化生长因子(TGF)-β1和白介素(IL)-10的含量。操作按说明书(上海麦约尔生物科技有限公司) 进行。
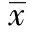
2 结 果
2.1BMSCs分离与培养 原代培养的骨髓细胞接种第3天,部分贴壁生长,多呈长梭形、三角形和多角形,即为BMSCs;第7~12天开始增长明显加快,具有一定的方向性,呈束状或放射状排列;第14天左右,单种细胞数量多,细胞贴壁率达90%。传代培养的BMSCs形态多为长梭形,较原代细胞体积增大,增殖速度加快,贴壁能力增强,约7 d左右贴壁率达80%~90%。见图1。
2.2流式细胞仪检测大鼠BMSCs的表型情况 流式细胞仪检测第4代Wistar大鼠的BMSCs表型,强表达CD29、CD44和CD90,少量表达CD34和 CD106,几乎不表达CD11b和CD45。
2.3淋巴细胞增殖能力情况
2.3.1ConA刺激后淋巴细胞增殖情况 ConA刺激后MNCs和不同数量BMSCs共培养96 h后,无BMSCs的情况下ConA作用下MNCs细胞在直方图上出现多个子峰,荧光强度依次减半,可见分裂2代和3代的细胞;而未刺激对照组荧光强度保持不变仍为单峰。BMSCs共培养的情况下ConA作用下MNCs细胞在直方图上出现也可见多个子峰,荧光强度依次减半,可见分裂2代和3代的细胞。进一步分析MNCs各子代细胞所占百分率,发现BMSCs与MNCs共培养后的细胞亲代百分率较无BMSCs存在的情况下的细胞亲代百分率明显增多,且随着BMSCs数量增多,细胞亲代百分率越高,表明其淋巴细胞增殖分裂受到抑制,且有剂量依赖性。见表1。
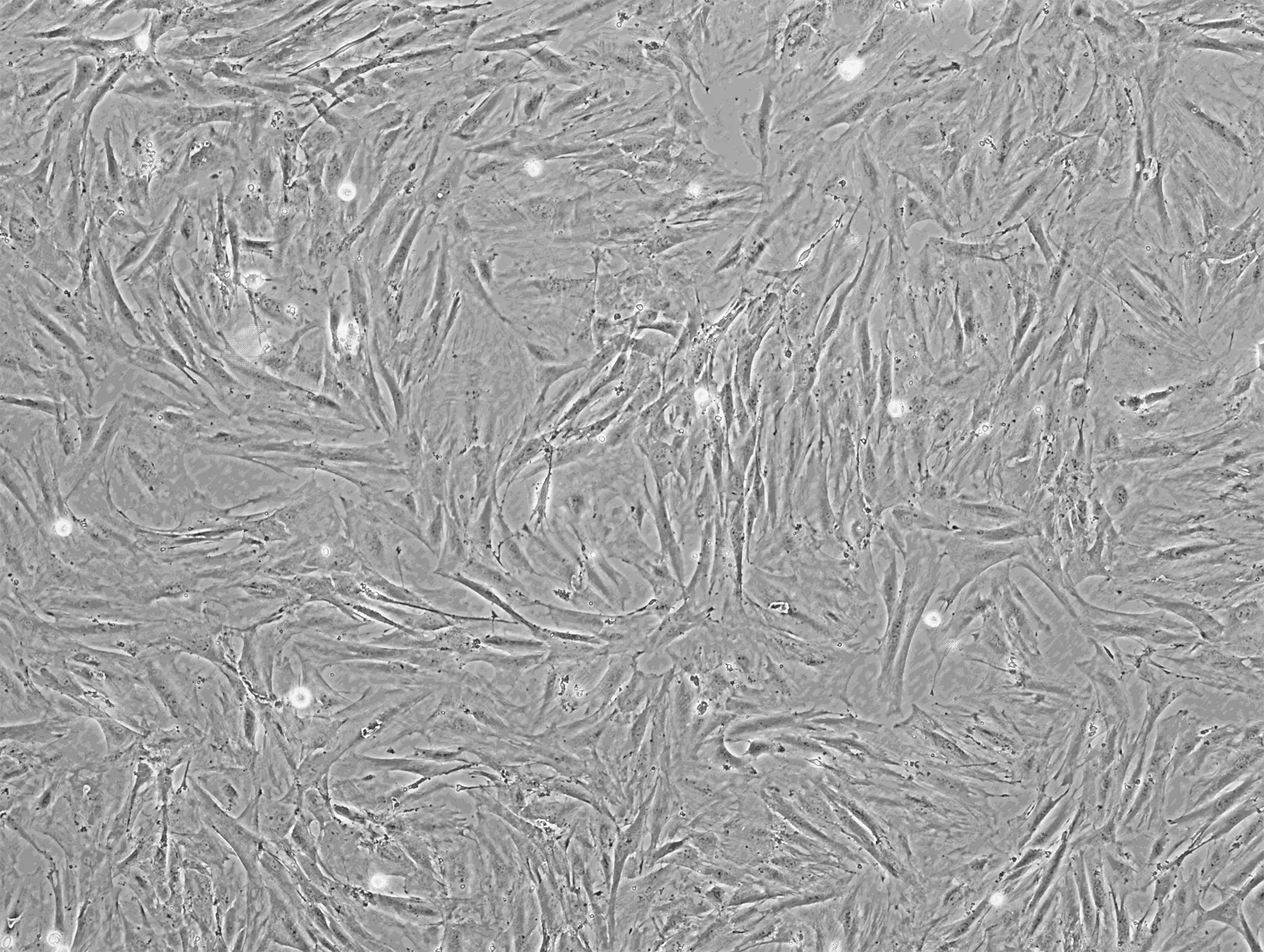
×100

表1 MNCs亲代细胞和子代细胞百分率变化±s,n=3,%)
2.3.2MBP68-86刺激后淋巴细胞增殖情况 MBP68-86刺激后MNCs和不同数量BMSCs共培养96 h后,无BMSCs的情况下MBP68-86作用下MNCs细胞在直方图上出现多个子峰,荧光强度依次减半,可见分裂2代和3代的细胞;而未刺激对照组荧光强度保持不变仍为单峰。BMSCs共培养的情况下MBP68-86作用下MNCs细胞在直方图上同样出现也可见多个子峰,荧光强度依次减半,可见分裂2代和3代的细胞。进一步分析MNCs各子代细胞所占百分率,发现BMSCs与MNCs共培养后的细胞亲代百分率较无BMSCs存在的情况下的细胞亲代百分率明显增多,且随着BMSCs数量增多,细胞亲代百分率越高,表明BMSCs能抑制MBP68-86刺激的淋巴细胞增殖,且有剂量依赖性。见表2。

表2 MNCs亲代细胞和子代细胞百分率变化±s,n=3)
2.4各组细胞上清中IFN-γ、TGF-β1和IL-10的表达情况
2.4.1细胞上清IFN-γ表达分析 ConA刺激MNCs细胞后,IFN-γ表达明显上升(P<0.05);BMSCs共培养的情况下,IFN-γ表达明显下降(P<0.05),而且随着BMSCs剂量增加,IFN-γ下降越明显(P<0.05)。MBP68-86刺激MNCs细胞后,IFN-γ表达明显上升(P<0.05);BMSCs共培养的情况下,IFN-γ表达明显下降(P<0.05),而且随着BMSCs剂量增加,IFN-γ下降越明显(P<0.05)。见表3。

表3 各组细胞上清中IFN-γ表达情况±s,n=3)
2.4.2细胞上清TGF-β1表达分析 ConA刺激MNCs细胞后,TGF-β1表达有所下降,但无统计学差异(P>0.05);BMSCs共培养的情况下,TGF-β1表达升高,但无显著性差异(P>0.05)。MBP68-86刺激MNCs细胞后,TGF-β1有所下降,但无统计学差异(P>0.05);BMSCs共培养的情况下,TGF-β1的表达升高,但无显著性差异(P>0.05)。见表4。

表4 各组细胞上清中TGF-β1表达情况±s,n=3)
2.4.3细胞上清IL-10表达分析 ConA刺激MNCs细胞后,IL-10表达明显下降(P<0.05);BMSCs共培养的情况下,IL-10表达升高,且MNCs与BMSCs的比值为1∶20和1∶40时IL-10的升高有显著性差异(P<0.05)。MBP68-86刺激MNCs细胞后,IL-10表达明显下降(P<0.05);BMSCs共培养的情况下,IL-10表达升高,当MNCs与BMSCs的比值为1∶20和1∶40时IL-10的升高有显著性差异(P<0.05)。见表5。

表5 各组细胞上清中IL-10表达情况±s,n=3)
3 讨 论
炎症性脱髓鞘疾病的确切发病机制尚不清楚,目前被普遍接受的观点认为,炎症性脱髓鞘疾病等是在易感基因的基础上,受环境因素的触发由T细胞介导的中枢神经系统的自身免疫性疾病〔2〕。证据显示在炎症性脱髓鞘疾病动物模型EAE中,自身反应性T细胞通过对MBP或PLP的攻击产生中枢神经系统炎症,同时髓鞘特异性自身反应性T细胞的活化和克隆增殖是诱导EAE的必要条件〔3〕。既往研究发现,BMSCs免疫原性很弱,在体外不但不能诱发免疫应答,而且还具有抑制免疫反应的作用〔4,5〕。
传统的检测淋巴细胞增殖能力的方法有同位素3H 标记胸腺嘧啶(3H2TdR) 法、四甲基偶氮唑盐 (MTT) 法等。但该些检测方法存在许多不足之处,如敏感性不高、有放射性危害、所用仪器昂贵,而且这些方法提供的信息非常有限,不能反映不同淋巴细胞亚群的增殖状态。Lyons等〔5〕利用CFSE标记细胞与流式细胞仪相结合技术来检测淋巴细胞的增殖反应,建立了一种功能强大的细胞增殖检测技术。本实验结果发现BMSCs不仅对非特异性抗原ConA刺激MNCs增殖有抑制作用,而且对特异性抗原MBP68-86刺激MNCs同样有抑制作用。进一步研究结果显示BMSCs对淋巴细胞增殖抑制作用有一定的剂量效应关系,随着剂量增加,BMSCs对淋巴细胞细胞增殖的抑制作用则增强,与Aggarwal等〔6〕的研究结果相似。不少研究证实BMSCs在体外实验的混合淋巴细胞反应、丝裂原刺激的淋巴母细胞转化实验以及应用CD3或CD28抗体刺激的淋巴细胞反应体系中均能抑制淋巴细胞的增殖,其中对CD3+、CD4+、CD8+T细胞的增殖抑制作用最显著〔7~9〕。而且Sun等〔10〕研究发现同种、异种或第三者小鼠BMSCs均能够抑制异体T细胞刺激的淋巴细胞的增殖,并且发现第三者BMSCs比自体BMSCs具有更强的抑制效果。本研究表明体外异种大鼠BMSCs能抑制MBP抗原刺激后MNCs增殖,为BMSCs对EAE的免疫调节作用奠定一定实验基础。
BMSCs免疫调节作用机制复杂,目前认为可能通过与免疫细胞直接接触或通过改变细胞因子分泌网络间接影响免疫细胞来发挥效应,但确切机制仍不清楚。研究显示IFN-γ、IL-10和TGF-β1在BMSCs抑制细胞增殖、分化、凋亡、免疫调节等方面发挥着重要的作用〔11〕。本研究结果表明BMSCs对细胞因子表达的抑制和促进作用与BMSCs呈一定剂量依赖关系。BMSCs可能通过下调IFN-γ的表达,上调IL-10和TGF-β1的表达,在体外抑制非特异性抗原ConA和特异性抗原MBP刺激下淋巴细胞的增殖反应,提示BMSCs可能通过自分泌或调控细胞因子表达,从而抑制特异性抗原所致的淋巴细胞增殖反应,因而推测BMSCs对EAE大鼠模型中的免疫损伤可能具有免疫抑制作用。
4 参考文献
1Zappia E,Casazza S,Pedemonte E,etal.Mesenchymal stem cells ameliorate experimental autoimmune encephalomyelitis inducing T-cell energy〔J〕.Blood,2005;106(5):1755-61.
2Chabas D,Green AJ,Waubant E.Pediatric multiple sclerosis 〔J〕.Curr Neurol Neurosci Rep,2008;8(5):434-41.
3Ben-Nen A,Cohen IR.Experimental autoimmune encephalomyelitis media-ted by T cells lines:process of selection of lines and characterization of the cells 〔J〕.J Immunol,1982;129(1):303-8.
4Reddy BY,Xu DS,Hantash BM.Mesenchymal stem cells as immunomodulator therapies for immune-mediated systemic dermatoses 〔J〕.Stem Cells Dev,2012;21(3):352-62.
5Lyons AB,Parish CR.Determination of lymphocyte division by flow cytometry〔J〕.J Immunol Methods,1994;171(1):131-7.
6Aggarwal S,Pittenger MF.Human mesenchymal stem cells modulate allogeneic immune cell responses 〔J〕.Blood,2005;105(14):1815-22.
7Maccario R,Podestà M,Moretta A,etal.Interaction of human mesenchymal stem cells with cells involved in alloantigen-specific immune response favors the differentiation of CD4+ T-cell subsets expressing a regulatory/suppressive phenotype〔J〕.Haematologica,2005;90(4):516-25.
8Le Blanc K,Tammik L,Sundberg B,etal.Mesenchymal stem cells inhibit and stimulate mixed lymphocyte cultures and mitogenic responses independently of the major histocompatibility complex〔J〕.Scand J Immunol,2003;57(1):11-20.
9Le Blanc K,Rasmusson I,Götherström C,etal. Mesenchymal stem cells inhibit the expression of CD25(interleukin-2 receptor)and CD38 on phytohaemagglutinin-activated lymphocytes〔J〕.Scand J Immunol,2004;60(3):307-15.
10Sun S,Guo Z,Xiao X,etal.Isolation of mouse marrow mesenchymal progenitors by a novel and reliable method〔J〕.Stem Cell,2003;21(5):527-35.
11Herrero C,Pérez-Simón JA.Immunomodulatory effect of mesenchymal stem cells 〔J〕.Braz J Med Biol Res,2010;43(5):425-30.
