ABCG2、MDR1基因表达水平与5-氟尿嘧啶耐药的CD44+SGC-7901/5-Fu多药耐药关系
2014-09-13李跃军卓德斌
李跃军 卓德斌
(湖南中医药高等专科学校第一附属医院肿瘤科,湖南 株洲 412000)
胃癌是我国高发病率、高死亡率的恶性肿瘤。5-氟尿嘧啶(5-Fu)是临床治疗胃癌常用的化疗药物,但有效率低,容易产生耐药性,如何克服其耐药是目前胃癌治疗的难点。肿瘤细胞高表达ABC转运蛋白家族(乳腺癌耐药蛋白ABCG2、P-糖蛋白MDR1)使肿瘤具有原发性多药耐药性,使肿瘤细胞能逃离多种化疗药物的毒性和杀伤作用。本实验通过体外观察5-Fu耐药的CD44+ SGC-7901/5-Fu细胞株ABCG2、MDR1基因表达水平,初步探讨其获得性耐药机制。
1 材料和方法
1.1细胞株及主要试剂 胃癌细胞株(SGC-7901)购自中科院上海生物研究;5-Fu(Sigma,美国);鼠抗人CD44抗体(Biolegend,美国);MTT(Sigma,美国);胰蛋白酶 (Amreseo,美国);新生牛血清(Sigma,美国)。RPMI-1640 (Gibco,美国)。AnnexinⅤ-FITC 凋亡检测试剂盒(北京宝赛公司)。
1.2实验设备 生物安全柜(THERMO,美国);CO2培养箱(德国);倒置显微镜 (OLYMPUS,日本);酶标仪(Biorad,美国);FACSAria流式细胞仪(Biolegend,美国)。
1.3实验方法
1.3.1细胞培养 用含10%灭活小牛血清(FBS)和青、链霉素(100 U/ml)的RPMI-1640培养液体外培养SGC-7901。37℃、5%CO2,根据细胞生长情况,每1~2 d换液。
1.3.25-Fu耐药的SGC-7901/5-Fu胃癌细胞模型建立 采用反复大剂量冲击结合逐步递增药物浓度法,取对数生长期的SGC7901细胞,加入5 mg/L 5-Fu,于37e、5% CO2、全湿度培养箱内孵育24 h,用不含Ca2+、P3-的磷酸盐缓冲液 D-Hanks洗1次,将细胞培养于无药RPMI-1640完全培养液中,待细胞恢复生长后(7~10 d),反复用5-Fu冲击处理,同时逐渐增加药物浓度(5、10、15、20、25、35、40),经过8次冲击至5-Fu药物浓度达40 mg/L,建立其耐药细胞株 SGC7901/5-Fu。待细胞恢复生长后将其维持培养于含5-Fu 10 mg/L的RPMI-1640完全培养液中,每 2~3 d传代1次。撤药2 w后进行细胞实验。
1.3.3流式细胞仪检测分选CD44+SGC-7901/5-Fu细胞 取对数生长期SGC-7901/5-Fu细胞,胰酶消化后用10%FBS DMEM/F12终止消化,2 500 r/min离心5 min后弃上清。磷酸盐缓冲液(PBS)洗涤2次后,重悬于含2%BSA的4℃预冷PBS中,调整细胞密度为1×109/L。取300 μl SGC-7901/5-Fu细胞,每100 μl细胞悬液加入CD44-FITC均匀混合,4℃避光孵育30 min后,PBS洗涤2次,2 500 r/min离心5 min后弃上清,将细胞沉淀悬浮于500 μl PBS中。使用FACSAria流式细胞仪进行检测和分选。
1.3.4MTT比色法测定耐药指数及交叉耐药性 分别收集对数生长期的SGC-7901、SGC-7901/5-Fu、CD44+SGC-7901/5-Fu 、CD44-SGC-7901/5-Fu细胞,调整细胞浓度至2×108cells/L。取各组细胞悬液接种于96孔板内,100 μl/孔孵育24 h后再加入8个倍比浓度梯度稀释的5-Fu、ADM、MMC和DDP,调整每孔终体积至200 μl。以不加化疗药物的组作为对照组;仅加入200 μl RPMI-1640完全培养液为空白组。96孔培养板于细胞培养箱中孵育72 h后,每孔加入四甲基偶氮唑蓝(MTT)(5 g/L)20 μl,继续孵育4 h后,2 000 r/min离心10 min,弃上清。每孔加入150 μl二甲基亚砜(DMSO),酶标仪上以570 nm波长测定各孔吸光度(A)值。细胞生存率(%)=(实验组A平均组/对照组A平均值)×100%;以药物浓度对数为横轴,生存率为纵轴,做出量-效曲线,求得半数抑制率(IC50),计算耐药指数。耐药指数(RF)=耐药细胞IC50/敏感细胞IC50。
1.3.5RT-PCR检测ABCG2、MDR1 mRNA表达水平 分别取对数生长期SGC-7901、SGC-7901/5-Fu、CD44+SGC-7901/5-Fu 、CD44-SGC-7901/5-Fu细胞,用Trizol提取总RNA,采用逆转录试剂盒将mRNA逆转录合成eDNA,取反转录产物2 μl进行PCR反应。引物设计,采用Premier 5.0软件设计,ABCG2、MDR1与β-actin mRNA的扩增产物分别为342 bp、237 bp与500 bp。ABCG2:正义5′-GCGACCTGCCAATTTCAAAT-3′,反义5′-AGCCAGTTGTAGGCTCATCCA-3′。MDR1:正义5′-CGCCAATGATGCTGCTCAAG-3′,反义5′-ACCAAGTAGGCTCCAAACCC-3′。β-actin正义5′-CAGGGTGTGATGGTGGG-3′,反义5′-GGAAGAGGATGCGGCAG-3′。PCR反应体系(25 μl):模板cDNA1 μl,正、反义引物各0.5 μl,Taq DNA聚合酶0.3 μl、dNTPs(2 mmol/L)2.5 μl、MgCl2(25 mmol/L)3 μl、10×PCR Buffer 2.5 μl,ddH2O 14.7 μl。反应条件:94℃预变性5 min,94℃变性30 s,62℃复性30 s,72℃延伸60 s。40个循环,72℃延伸10 min,4℃保存。1.5%琼脂糖凝胶电泳检测扩增结果,Quantity One 图像分析处理系统进行灰度扫描。ABCG2、MDR1 mRNA表达水平以各目的基因片段OD值/内参照β-actin密度值表示。
1.4统计学处理 采用 SPSS16.0软件进行t检验。
2 结 果
2.1各组细胞耐药指数及交叉耐药性比较 MTT法检测CD44+SGC-7901/5-Fu相对于SGC-7901细胞的RF为12.5(P<0.05),但CD44-SGC-7901/5-Fu相对于SGC-7901细胞的RF为1.2(P>0.05)。CD44+SGC-7901/5-Fu对ADM、MMC和DDP也有交叉耐药性,CD44-SGC-7901/5-Fu对ADM、MMC和DDP无交叉耐药性。见表1。
2.2各组细胞ABCG2、MDR1 mRNA表达水平 见表2。与对照组(正常SGC-790)细胞比较,ABCG2、MDR1在5-Fu耐药的SGC-7901细胞株中表达明显增强(P<0.05)。与5-Fu耐药的SGC-7901细胞株比较,CD44+SGC-7901/5-Fu细胞株ABCG2、MDR1表达继续增加(P<0.05)。与5-Fu耐药的SGC-7901细胞株比较,CD44-SGC-7901/5-Fu细胞ABCG2、MDR1表达差别无统计学意义(P>0.05)。
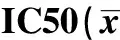
表1 各组细胞±s,mg/L)及交叉耐药性

表2 各组ABCG2、MDR1 mRNA表达水平±s)
3 讨 论
各研究表明,肿瘤耐药细胞系中肿瘤干细胞比例增加是肿瘤耐药的主要原因,其机制与肿瘤干细胞高表达ABCG2和MDR1密切相关〔1~5〕。近年的许多研究结果认为CD44+胃癌细胞具有自我更新和分化能力,该亚群细胞是胃癌肿瘤干细胞,并且可能是肿瘤耐药的主要原因〔6,7〕。 本研究表明,CD44+细胞较正常SGC7901细胞和CD44-细胞耐药指数明显增加,并呈现明显多药耐药性,是SGC7901细胞中主要的耐药细胞亚群。
ABCG2 能主动转运多种化疗药物,将药物从细胞内转运至细胞外。表达特征与恶性肿瘤化疗效果有密切关系,高表达者化疗效果不佳;低表达疗效较好。研究发现ABCG2主要通过结合和水解并利用能量将细胞内的药物泵出,降低胞内药物浓度和减轻细胞毒作用,从而可使机体对抗肿瘤药物产生耐药〔8,9〕。
MDR1基因编码的P-g(P-糖蛋白)是一种三磷酸腺苷(ATP)依赖性转运排出泵,有与ATP结合的位点。当肿瘤细胞与抗肿瘤药物接触,脂溶性药物随浓度梯度进入细胞,P-gp即与药物分子结合并连接ATP位点,形成1个磷酸化和糖基化ATP-结合盒蛋白的药物大分子。当ATP水解,释放的能量将已进入细胞内的药物从胞内泵出胞外,使肿瘤细胞内药物浓度降低。肿瘤细胞耐药程度、胞内药物浓度与胞膜表面的MDR1表达密切相关,抑制MDR1基因表达可逆转细胞的耐药性,提高肿瘤细胞对化疗药物的敏感性〔8,10〕。
Zhou等〔4〕发现胰腺癌细胞系PANC1中肿瘤干细胞高表达MDR1和ABCG2,推测是PANC1肿瘤干细胞耐药的主要原因。Zheng等〔5〕发现甲状腺癌多柔比星耐药细胞系中肿瘤干细胞比例及MDR1、ABCG2表达明显升高,抑制肿瘤干细胞MDR1、ABCG2可增加其对多柔比星的敏感性。CD44+SGC-7901/5-Fu细胞株ABCG2、MDR1 mRNA表达较正常SGC-7901细胞株及5-Fu耐药的SGC-7901/5-Fu细胞株明显增强,可能是其获得性耐药的原因,值得进一步研究。
4 参考文献
1Rizzo S,Hersey JM,Mellor P,etal. Ovarian cancer stem cell-like side populations are enriched following chemotherapy and overexpress EZH2〔J〕.Mol Cancer Ther, 2011;10(2):325-35.
2Tsai LL,Yu CC,Chang YC,etal. Markedly increased Oct4 and Nanog expression correlates with cisplatin resistance in oral squamous cell carcinoma〔J〕. J Oral Pathol Med,2011;40(8):621-8.
3Du Z,Qin R,Wei C,etal. Pancreatic cancer cells resistant to chemoradiotherapy rich in “stem-cell-like” tumor cells〔J〕. Dig Dis Sci, 2011;56(3):741-50.
4Zhou J,Wang CY,Liu T,etal. Persistence of side population cells with high drug efflux capacity in pancreatic cancer〔J〕. World J Gastroenterol,2008;14(6):925-30.
5Zheng X,Cui D,Xu S,etal. Doxorubicin fails to eradicate cancer stem cells derived from anaplastic thyroid carcinoma cells:characterization of resistant cells〔J〕. Int J Oncol,2010;37(2):307-15.
6Hung JY,Yang CJ,Tsai YM,etal. Antiproliferative activity of paeoniflorin is through cell cycle arrest and the Fas /Fas ligand-mediated apoptotic pathway in human non-small cell lung cancer A549 cells〔J〕. Clin Exp Pharmacol Physiol,2008;35(2):141-7.
7Sun M,Zhou W,Zhang YY,etal. CD44+ gastric cancer cells with stemness properties are chemoradioresistant and highly invasive〔J〕. Oncol Lett,2013;5(6):1793-8.
8Moitra K,Lou H,Dean M. Multidrug efflux pumps and cancer stem cells:insights into multidrug resistance and therapeutic development〔J〕. Clin Pharmacol Ther,2011;89(4):491-502.
9Nakanishi T,Ross DD. Breast cancer resistance protein(BCRP/ABCG2):its role in multidrug resistance and regulation of its gene expression〔J〕. Chin J Cancer,2012;31(2):73-99.
10许景峰. 肿瘤细胞MDR1基因多药耐药的研究进展〔J〕. 解放军药学学报,2010;26(5):453-5.
