关于腰椎间盘退变过程中基质金属蛋白酶-13的来源
2014-09-13胡宝山许喜筠郭元利
胡宝山 许喜筠 郭元利 芮 钢
(厦门大学附属第一医院骨科,福建 厦门 361003)
椎间盘退变的病因和发病机制是近年来的研究热点,目前发现退变椎间盘中,均有细胞因子和炎症介质等物质存在,但细胞因子和炎症介质在椎间盘内的来源未见相关报道。本实验旨在观察椎间盘细胞受到诱导刺激能否自分泌产生基质金属蛋白酶(MMP)-13,进一步揭示退变椎间盘中MMPs的来源。
1 材料与方法
1.1材料 新西兰大白兔40只,平均体质量2.6 kg,雌雄不限,由厦门大学实验动物部提供。主要试剂:120 kD纤维黏连蛋白(Fn,美国Chemicon公司),TRIzol 试剂(美国MRC公司),M-MLV逆转录酶(美国Promega公司),5×M-MLV 缓冲液、RNA酶抑制剂、100 bp DNA Marker、5 mmol/L dNTP Mixture、TaqTMDNA聚合酶(TaKaRa中国大连公司)。主要仪器:OLYMPUS CX-40显微镜(日本Olympus光学工业株式公司),Gyroscan intera T 1.5磁共振仪(德国Philip公司),高速离心机(德国Philip公司)。
1.2椎间盘细胞的分离和培养 新西兰大白兔,空气栓塞处死。无菌取椎间盘,刮除髓核并削除纤维环,显露软骨终板并用小刀片及剪刀小心削剪软骨终板,将软骨终板和纤维环组织分别放入盛有无血清培养基的培养皿中,离心得到软骨终板细胞和纤维环细胞,加入10 ml DMEM/F12培养基吹打均匀后转移到75 cm2培养瓶中在37℃、5% CO2的培养箱中培养。原代软骨终板细胞大概10 d左右融合,原代纤维环细胞大约8 d融合,之后每3天换液1次,按时用倒置显微镜观察、拍照。细胞增殖融合为单层几乎覆盖瓶底时用0.25%胰蛋白酶消化并进行细胞传代。两种细胞一般均为8 d左右传代。因椎间盘髓核细胞经多次培养只能原代成活,无法进行传代,未进入实验。
1.3施加120 kD Fn-f处理因素 将软骨终板细胞接种到放有6孔培养板内,以5×105/ml密度接种,每孔加入含10%的胎牛血清 DMEM-F12培养基1.5 ml,在5% CO2、37℃的孵育箱中培养。细胞贴壁80%融合后,吸出培养基,加入无血清DMEM-F12培养基后分成两组:第1组加Fn终浓度为1 μmol/L作试验组,第2组加入等量PBS作为对照,在6孔板内培养36 h,用于提取总RNA半定量分析MMP-13的表达,同时对两组细胞行MMP-13的免疫荧光检测。纤维环细胞处理方法同上。
1.4RT-PCR检测mRNA的表达 分别收集实验组和对照组6孔板内细胞,将细胞进行裂解后按前述方法提取总RNA,逆转录后得到cDNA。获得cDNA后按下面引物和反应条件进行PCR反应,电泳后观察相应条带的表达情况,操作方法同前。MMP-13引物:上游 5’-TCTGGAAGCAGGACCAGA-3’;下游:5’-CATAAATATGCTGAGGTC-3’。
1.5MMP-13的免疫荧光显色 取两组第2代细胞爬片,用冷PBS液冲洗3次,3 min/次。新鲜配制的4%多聚甲醛固定30 min,3% H2O2甲醇溶液室温浸泡10 min,以灭火内源性过氧化物酶。用0.01 mol/L PBS洗3次,3 min/次。0.5%Triton×100(PBS配制),孵育2次,10 min/次,PBS液冲洗3次,3 min/次。滴加正常山羊血清封闭液,室温封闭20 min,以消除非特异性着色。甩去多余的封闭液,不冲洗。试验组滴加1∶20稀释的MMP-13单克隆抗体,对照组滴加等量PBS,湿盒内4℃孵育过夜,37℃复温45 min,0.01 mol/L PBS液洗3次,3 min/次。滴加1∶64稀释的FITC二抗,37℃孵育30 min~1 h,绿色荧光镜下观测显色,拍摄图片。
2 结 果
2.1细胞的形态学观察 椎间盘细胞经过计数,以5×105个/ml密度接种,细胞活力95%左右。接种的细胞为圆形,核明亮而清楚,悬浮于培养基中。细胞大小略有差异。24 h后细胞开始贴壁,圆形增大,伸展形成突起,变得扁平透亮;48 h后贴壁细胞逐渐增多;第5天,大部分细胞已经贴壁,软骨细胞呈小三角形、多角形或短梭形。纤维环细胞于第3天大部分完成贴壁,呈梭型,并呈现旋涡样同向生长趋势(图2)。髓核细胞集落样生长,高倍镜下如涂布样,见图1。由于细胞数量很少,无法完成传代。8~10 d左右,原代细胞基本融合,形成单层,连接成片。传代后的细胞一般36 h内即可完全贴壁,7 d左右细胞形成单层融合。随着传代的次数增加,软骨终板细胞逐渐增大,胞质内出现空泡,胞质/核比例增大,细胞形态不规则。传至第5代,细胞生长变慢。
2.2120 kD Fn-f对MMP-13 mRNA表达的影响 软骨终板两组内参GAPDH均在理论条带位置出现相应条带,有所表达。试验组出现100~200 bp条带,符合MMP-13 mRNA表达的理论值,说明在120 kD Fn-f的作用下终板软骨细胞能够表达MMP-13 mRNA。对照组没有相应条带产生,说明终板软骨细胞自身无刺激条件下不会表达MMP-13。纤维环细胞实验组同样得到MMP-13 mRNA的表达条带,但是和软骨终板细胞相比,表达量很少,而PBS对照组没有相应条带的表达(图2)。

终板软骨细胞

纤维环细胞
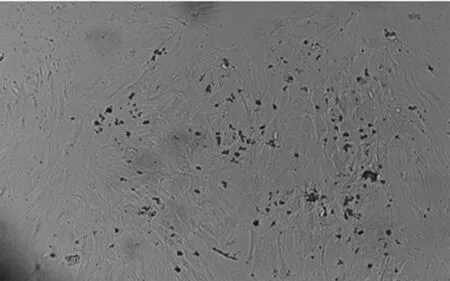
原代髓核细胞

EP:终板软骨细胞;AF:纤维环细胞
2.3荧光免疫显色 试验组软骨终板细胞产生绿色荧光,说明在120 kD Fn-f诱导下软骨终板细胞能产生MMP-13,纤维环组荧光表达量非常少,甚至不表达。对照组软骨终板细胞和纤维环细胞没有绿色荧光产生,没有MMP-13的表达(图3)。

终板软骨细胞
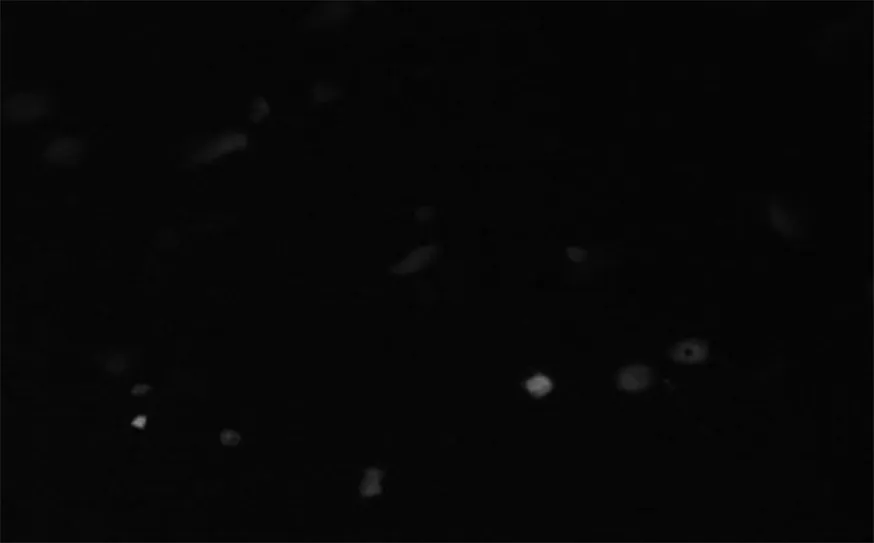
纤维环细胞
3 讨 论
终板软骨细胞由于软骨终板细胞为透明软骨,故其细胞外基质主要由Ⅱ型胶原和蛋白多糖组成,通过番红-0对基质中的蛋白多糖和甲苯胺兰对糖胺多糖特异性染色,以及对Ⅱ型胶原进行免疫细胞化学染色,再结合取材的部位,即可鉴定是否是软骨终板细胞。本实验通过上述染色证实,所培养的细胞具有软骨细胞的表型特征,即可以合成分泌蛋白多糖和Ⅱ型胶原,因此,可以证明所培养的细胞为软骨终板细胞。
纤维环细胞目前为止还没有特异的鉴定方法,一般来说根据取材的部位和细胞形态的描述。由于椎间盘组织为三明治结构,和其他组织分界清楚,而且终板软骨和纤维环虽然连接紧密,但是细胞形态截然不同,因此根据这两点可以进行纤维环细胞的鉴定。一般来说当细胞贴壁融合后,细胞形态成梭形,而且细胞呈现一种同向性生长趋势,也就是细胞长轴方向相同,为旋涡样或水流样生长。本实验所得细胞和上述描述基本相同。因此认为是纤维环细胞。其细胞类型应该属于成纤维细胞。兔细胞传代过4代后,细胞形态会发生变化,多数细胞会变圆,同时细胞同向性生长趋势消失。
髓核细胞由于数量稀少,细胞活力低下,本实验只成功培养了兔椎间盘的原代髓核细胞。没能成功进行传代,可能其方法学还须进一步改进。其鉴定目前为止亦没有标准方法,同样需通过取材位置和细胞形态进行。细胞形态和软骨终板细胞较为相似,亦呈现多角形,但是不同之处在于细胞伪足长、较多,胞质向外突起,呈“涂布样”。可能由于原代的关系,细胞呈集落样聚集,一般不能长满瓶壁。
椎间盘退变主要表现在终板、髓核、纤维环中细胞和细胞外基质的变化,其中基质成分的病理改变在椎间盘退变的发生发展过程中起着及其重要的作用,退变间盘基质的变化主要表现在蛋白多糖的降解,非聚合性蛋白多糖成分增多,降解产物聚积;Ⅱ型胶原降解,浓度降低,Ⅰ型Ⅱ型胶原比例失调,研究表明在此过程中许多与基质成分改变相关的蛋白酶类均参与了这一病理过程,其中以MMPs尤为重要。
MMPs主要有两方面的功能,①几乎能够降解多糖以外的所有细胞外基质成分。②激活其他酶类产生连锁放大效应。按MMPs的作用底物可分为四大类,即胶原酶包括MMP-1、MMP-8、MMP-13;明胶酶包括MMP-2、MMP-9;基质溶解酶包括MMP-3、MMP-7、MMP-10、MMP-11、MMP-12;模型MMPs包括MMP-14、MMP-15、MMP-16、MMP-17。胶原酶为水解活动中最重要、最基本的酶类,只有胶原酶才能够作用于胶原的螺旋区,胶原酶是基质降解的关键酶〔1〕。目前为止发现与椎间盘退变相关的MMPs主要包括:MMP-1、2、3、7、8、9、13七种,其家族中其他成员在椎间盘中的表达鲜见报道。1982年,Sedowofia等首先在人类腰椎间盘纤维环和髓核组织提取物中发现了中性胶原酶、明胶酶和弹性蛋白酶,有研究发现突出的颈、腰椎间盘中MMP-3、明胶酶及白细胞介素(IL)-6的含量高于正常椎间盘。退变、突出椎间盘中MMP-3、IL-1的含量和表达阳性率高于正常椎间盘组〔2〕。Gaetani等〔3〕发现紧邻神经根的突出椎间盘组织中MMP-3含量高于椎体软骨终板表面的椎间盘组织。
MMP-13属于胶原酶的一种,主要降解Ⅱ型胶原,它在椎间盘退变之间存在密切的关系。Anderson等〔4〕损伤兔的椎间盘制作椎间盘退变模型后检测MMP-13等多种炎症介质和相关酶类的mRNA的表达发现MMP-13表达明显升高,而对照组没有MMP-13的表达。Maitre等〔5〕将人的腰椎间盘退变标本行免疫组化发现包括MMP-13在内的多种MMPs均有表达,或者表达较正常椎间盘明显增多,并随退变程度而有所增加。同时发现,正常椎间盘内没有MMP-13的表达,退变椎间盘内表达较多。LeMaitre等〔6〕对IL-1和MMPs的表达之间的关系发现IL-1β能够诱导人椎间盘细胞产生MMP-13,而对照组没有MMP-13的产生。Yurube等〔7〕对兔椎间盘施加机械压力制作的椎间盘退变模型后检测蛋白酶类的基因表达时发现,MMP-13有所表达,而对照组没有表达。以上研究均表明MMP-13参与了椎间盘退变的过程,而且多数学者认为炎症介质和基质酶类似乎有一种因果关系,炎症介质产生后就会导致基质酶类的产生。本实验的第二部分已经证实120 kD Fn-f诱导退变的椎间盘内有MMP-13的表达。但是对于椎间盘内MMP-13的来源仍不清楚,因此本部分实验对椎间盘细胞在120 kD Fn-f的诱导下能否产生MMP-13进行了检测。结果显示软骨终板细胞在120 kD Fn-f的诱导下,大量表达MMP-13 mRNA和MMP-13蛋白,表现为较亮电泳条带和荧光显色,说明软骨细胞能够表达MMP-13。纤维环细胞则表达量极少,几乎不表达,说明纤维环细胞对120 kD Fn-f的刺激不敏感,或者说纤维环细胞本身不会大量表达MMP-13。由于髓核细胞和软骨终板细胞更具有相似性,因此推测在120 kD Fn-f能够诱导髓核细胞产生MMP-13,由于髓核细胞传代没有成功,因此只能推测。
4 参考文献
1Erwin WM,Islam D,Inman RD,etal.Notochordal cells protect nucleus pulposus cells from degradation and apoptosis:implications for the mechanisms of intervertebral disc degeneration〔J〕.Arthritis Res Ther,2011;13(6):R215.
2Gruber HE,Hoelscher GL,Ingram JA,etal.Matrix metalloproteinase-26,a novel MMP,is constitutively expressed in the human intervertebral disc in vivo and in vitro〔J〕.Exp Mol Pathol,2012;92(1):59-63.
3Gaetani P,Rodriguez Y,Baena R,etal.Collagenase-1 and stromelysin distribution in fresh human herniated intervertebral disc:a possible link to the in vivo inflammatory reactions〔J〕.Neurol Res,1999;21(7):677-81.
4Anderson DG,Izzo MW,Hall DJ,etal.Comparative gene expression profiling of normal and degenerative discs:analysis of a rabbit annular laceration model〔J〕.Spine,2002;27(12):1291-6.
5Le Maitre CL,Freemont AJ,Hoyland JA.Localization of degradative enzymes and their inhibitors in the degenerate human intervertebral disc〔J〕.J Pathol,2004;204(1):47-54.
6Le Maitre CL,Freemont AJ,Hoyland JA.The role of interleukin-1 in the pathogenesis of human intervertebral disc degeneration〔J〕.Arthritis Res Ther,2005;7(4):R732-45.
7Yurube T,Takada T,Suzuki T,etal.Rat tail static compression model mimics extracellular matrix metabolic imbalances of matrix metalloproteinases,aggrecanases,and tissue inhibitors of metalloproteinases in intervertebral disc degeneration〔J〕.Arthritis Res Ther,2012;14(2):R51.
