瑞芬太尼对小鼠脑缺血再灌注损伤的神经保护作用
2014-09-13杨剑云李翠林
杨剑云 吴 娅 臧 晖 李翠林 金 华
(昆明市妇幼保健院麻醉科,云南 昆明 650031)
瑞芬太尼是一种新型的μ阿片受体激动剂,因其药效强,起效快,安全可靠,被广泛应用于围术期患者的镇痛、镇静和术后止痛。近年的动物实验研究表明,瑞芬太尼对全脑和局灶性的缺血再灌注损伤具有神经保护作用〔1,2〕。瑞芬太尼能通过抵抗脑缺血再灌注损伤所致的氧化应激和细胞凋亡发挥保护作用,但瑞芬太尼能否通过影响脑缺血再灌注后的炎症应答过程而起到脑保护作用,目前还不清楚。本实验观察瑞芬太尼对小鼠脑缺血再灌注后白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α、IL-10、转化生长因子(TGF)-β1和核转录因子(NF)-κB表达变化的影响,以探讨其可能机制。
1 材料与方法
1.1主要试剂 瑞芬太尼购于湖北宜昌人福药业公司(批号:090910);MCAO栓线购于北京沙东生物技术有限公司;2,3,5-氯化三苯基四氮唑(TTC)购于美国Sigma公司;NF-κB p65和Lamin B抗体购于美国Santa Cruz公司。其余药品和试剂均为国产,分析纯。
1.2实验动物分组及给药 雄性C57BL/6小鼠72只,随机分为假手术组、模型组和瑞芬太尼预处理组,每组24只。各组根据不同时间点又分为缺血2 h后再灌注0 h、6 h、12 h、24 h组,每组6只。脑缺血再灌注损伤模型制作之前,瑞芬太尼预处理组通过静脉输入瑞芬太尼,每次输注5 min,连续3次,输注速率为0.7 μg·kg-1·min-1,容积1 ml/5 min,预处理过程共30 min。模型组小鼠接受生理盐水灌注,速率、容积及方案与瑞芬太尼预处理组相同,假手术组不进行脑缺血再灌注损伤,其余过程与模型组相同。
1.3动物模型的制作 本实验采用线栓法制备大脑中动脉阻塞模型,术中以肛温计监测体温,并用白炽灯加热维持肛温在36 ℃~37 ℃。根据Longa线栓法加以改进〔3〕。采用直径0.32的栓线,戊巴比妥钠(50 mg/kg)腹腔注射麻醉,钝性分离右侧颈总动脉、颈外动脉和颈内动脉后,结扎颈外动脉,在颈外动脉近分叉处剪一切口,从中把栓线送入大脑中动脉起始处,固定栓线,2 h后抽出栓线制备再灌注损伤模型。假手术组只分离右侧颈总动脉、颈外动脉和颈内动脉,不闭塞大脑中动脉。
1.4神经功能缺损评分 脑缺血再灌注24 h后,采用Longa评分法对各组小鼠进行行为学评分〔3〕。该评分法分为5个等级:0分,正常,无神经功能缺损;1分,不能完全伸展对侧前爪;2分,行走时,向对侧转圈,中度神经功能缺损;3分,行走时,向对侧倾倒,重度神经功能缺损;4分,不能自发行走,意识丧失。
1.5梗死体积的计算 小鼠脑缺血再灌注24 h后,断头、取脑,将脑组织置于-20 ℃中冷冻20 min后,置于脑切片模具内,从额极开始由前向后间隔2 mm冠状切取脑组织,置于37 ℃的2%TTC溶液中染色30 min。脑切片排序、拍照并输入计算机,通过图像分析系统对切片梗死体积和全脑梗死体积计算,各样本以脑梗死体积/全脑体积比作为统计数据。
1.6脑组织IL-1β、TNF-α、IL-10和TGF-β1的检测 小鼠脑缺血再灌注0 h、6 h、12 h和24 h后,断头开颅取脑,分离缺血侧大脑皮层组织。将皮层组织用4 ℃生理盐水迅速制成1∶9匀浆液,3 000 r/min离心15 min,取上清液,采用ELISA法用于IL-1β、TNF-α、IL-10和TGF-β1含量的检测,操作过程严格按照试剂盒说明书(博士德生物工程有限公司,武汉)的要求进行。
1.7蛋白免疫印迹 小鼠脑缺血再灌注24 h后,断头开颅取闹,分离缺血侧大脑皮层组织。采用核蛋白与胞质蛋白提取试剂盒(博士德生物工程有限公司,武汉)制备核蛋白提取液,用于NF-κB活性的检测。具体过程如下:BCA法行蛋白定量分析;配制10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行电泳分离后,将蛋白质电转至PVDF膜中;用10%的脱脂奶4℃封闭过夜。然后分别加入NF-κB p65(1∶500)和Lamin B(1∶1 000)的一抗封闭1 h,TTBS洗膜3次,每次5 min,加入辣根过氧化物酶耦联的IgG抗体,于室温轻摇1 h杂交反应,TTBS洗膜6次,每次5 min;加入化学发光底物反应5 min后保鲜膜包裹,暗室内进行X线胶片曝光、显影和定影。
1.8统计学处理 采用SPSS15.0统计软件进行方差分析、配对t检验。
2 结 果
2.1瑞芬太尼改善脑缺血再灌注损伤所致的神经功能障碍 与假手术组(0分)比较,脑缺血再灌注24 h后,模型组〔(3.10±0.45)分〕小鼠的神经功能缺损严重(P>0.05);瑞芬太尼预处理组〔(2.71±0.44)分〕可以显著地改善脑缺血再灌注损伤所致的神经功能障碍(P<0.05)。
2.2瑞芬太尼减少脑梗死灶体积 与假手术组(0)相比,脑缺血再灌注24 h后,模型组(30.9%±1.8%)小鼠梗死灶体积显著地增加(P<0.05);而与模型组比较,瑞芬太尼预处理组(19.8%±2.0%)可以显著地缩小脑缺血再灌注所致的梗死灶体积(P<0.05)。
2.3瑞芬太尼阻止NF-κB的活化 与假手术组相比,模型组小鼠脑缺血再灌注24 h后,NF-κB的活性增强。而瑞芬太尼预处理组可以抑制NF-κB的活性。见图1。
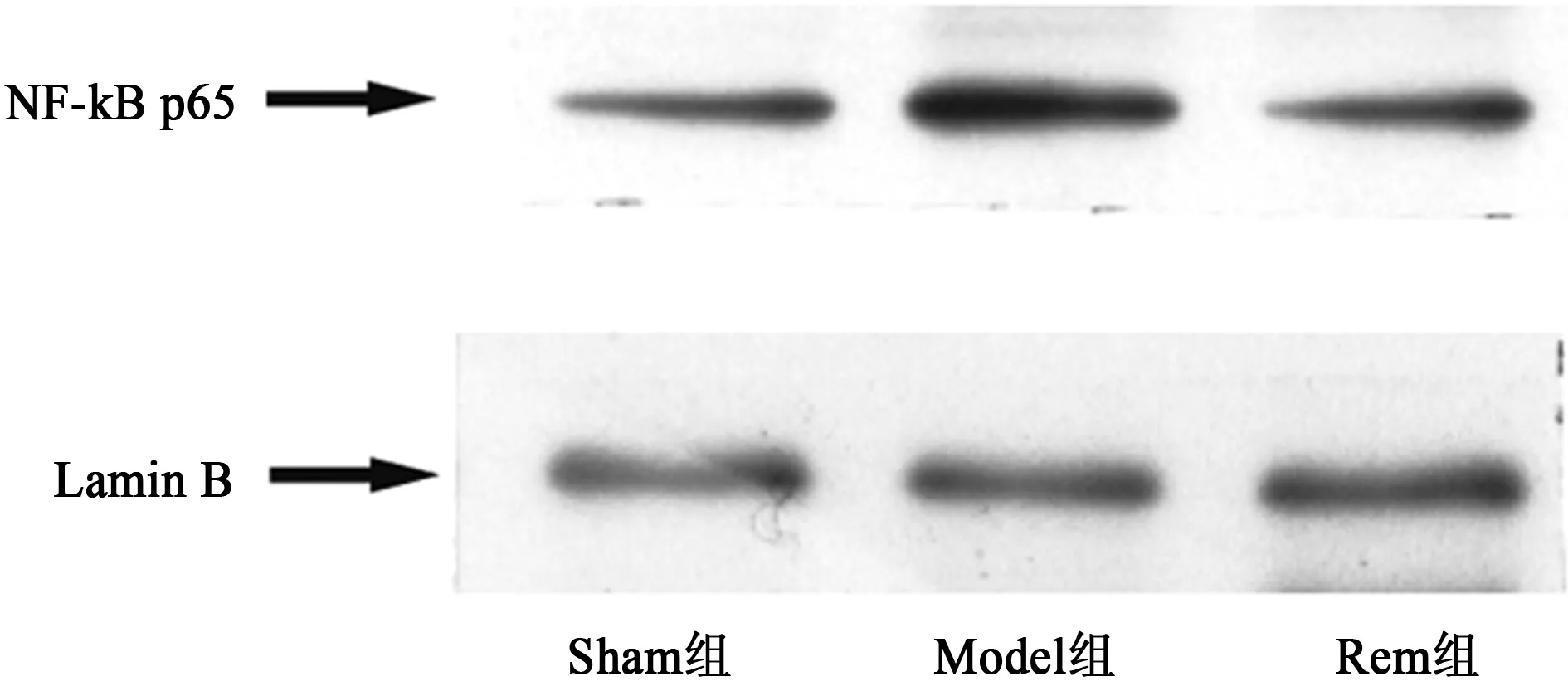
图1 瑞芬太尼对缺血侧皮层组织细胞核内NF-κB水平的影响
2.4瑞芬太尼降低促炎症细胞因子的表达 模型组小鼠在脑缺血再灌注0 h和6 h后,缺血侧皮层组织中IL-1β和TNF-α的表达水平显著增加(P<0.05);在脑缺血再灌注12 h后,IL-1β和TNF-α的表达水平开始下降。而与模型相比,瑞芬太尼预处理组可以显著减低缺血侧皮层组织中IL-1β和TNF-α的表达水平(P<0.05)。见表1。

表1 各组大鼠缺血侧皮层组织不同时刻IL-1β、TNF-α、IL-10和TGF-β±s,n=6,pg/mg)
2.5瑞芬太尼增加抗炎症细胞因子的表达 模型组小鼠在脑缺血再灌注0、6、12和24 h后,缺血侧皮层组织中IL-10和 TGF-β1的表达水平显著增加,并都在6 h达到最高水平。与模型组相比,瑞芬太尼预处理组可以显著增加缺血侧皮层组织中IL-10和 TGF-β1的表达水平(P<0.05)。见表1。
3 讨 论
阿片受体是一种G蛋白耦联受体,其在人体内广泛存在,具有多种生物学活性。近年研究发现,阿片受体具有脑保护作用,能抵抗脏器缺血再灌注损伤〔4~6〕。阿片受体主要有四种类型:δ、μ、κ和孤啡肽受体。近年研究发现,μ型阿片受体具有抗炎症作用〔7〕。瑞芬太尼作为一种新型的μ阿片受体激动剂,广泛用于临床的麻醉。已有研究结果表明,瑞芬太尼对脑缺血再灌注损伤具有抵抗作用。但对其保护机制目前还不清楚。在本实验中,瑞芬太尼能通过抵抗炎症反应改善小鼠脑缺血再灌注损伤所致的行为障碍,减少脑梗死体积。
炎症反应是脑缺血再灌注损伤的重要原因之一〔8〕。脑缺血时血液炎症细胞会向脑内浸润,胶质细胞会被激活,引发脑组织炎症反应的失控,加重脑缺血再灌注损伤〔9〕。细胞因子在脑缺血的炎症应答过程中扮演着十分重要的作用。脑缺血会导致IL-1β和TNF-α等促炎症因子的表达上调〔9~11〕。在短暂性局部脑缺血模型中IL-1β和TNF-α的表达被上调,并在再灌注数小时内达到顶峰。IL-1β和TNF-α对脑缺血时嗜中性粒细胞的浸润和胶质细胞的激活起着十分关键的作用,IL-1β或TNF-α的抑制剂可以缓解脑缺血损伤〔12,13〕。脑缺血后炎症应答过程所致的损伤程度主要取决于促炎症因子的级联反应和抗炎症因子的诱导作用。抗炎症因子IL-10和 TGF-β1对缓解脑缺血再灌注损伤具有重要的调控作用,外源性IL-10和 TGF-β1的给予可以抵抗脑缺血再灌注损伤〔14~17〕。研究证实,IL-10能抑制促炎症因子的产生〔18〕。本实验中,瑞芬太尼能显著地上调抗炎症因子IL-10和 TGF-β1的表达,并抑制促炎症因子IL-1β和TNF-α的表达,推测瑞芬太尼可能通过抑制炎症反应过程,阻止嗜中性粒细胞的浸润和胶质细胞的激活,从而起到脑保护作用。
NF-κB是细胞内重要的核转录因子,广泛分布于神经元、小胶质细胞和星形胶质细胞中。NF-κB的激活可以诱导多种促炎症因子的表达,促进炎症反应。静息状态下,NF-κB与其抑制因子IκB结合成复合物存在于细胞质中。在应激条件下,NF-κB被激活,进入细胞核,从而促进相关基因的表达。许多研究证实,脑缺血会导致NF-κB的活化,诱导多种促炎症因子的表达,如IL-1β和TNF-α〔19,20〕。在本实验中,脑缺血再灌注时细胞核内NF-κB的含量显著地增加,NF-κB被活化。这一结果与脑缺血再灌注所致IL-1β和TNF-α的上调具有同向变化趋势。而瑞芬太尼能显著得抑制NF-κB的活化。这些研究结果表明,瑞芬太尼可能通过抑制NF-κB的活化,下调促炎症因IL-1β和TNF-α的表达,从而抑制炎症反应。
综上,瑞芬太尼对脑缺血再灌注损伤所致的炎症反应具有抑制作用,可能通过降低促炎症因子的表达,增加抗炎症因子的表达,抑制NF-κB的活化,进而起到脑保护作用。为瑞芬太尼应用于脑缺血性卒中的治疗及围术期发生脑缺血缺氧的高危患者的安全用药提供实验依据。
4 参考文献
1方舒东,朱也森,徐 辉,等.瑞芬太尼对大鼠全脑缺血再灌注后神经元凋亡和半胱天冬酶-3表达的影响 〔J〕.上海医学,2010;33(2):123-7.
2贾丽玲,曹定睿,张维智,等.瑞芬太尼预处理对脑缺血/再灌注大鼠脑组织mda含量和sod活性的影响 〔J〕.中国医药指南,2010;8(5):27-9.
3Longa EZ,Weinstein PR,Carlson S,etal.Reversible middle cerebral artery occlusion without craniectomy in rats 〔J〕.Stroke,1989;20(1):84-91.
4Schultz JJ,Hsu AK,Gross GJ.Ischemic preconditioning and morphine-induced cardioprotection involve the delta(delta)-opioid receptor in the intact rat heart 〔J〕.J Mol Cell Cardiol,1997;29(8):2187-95.
5Rubaj A,Gustaw K,Zgodzinski W,etal.The role of opioid receptors in hypoxic preconditioning against seizures in brain 〔J〕.Pharmacol Biochem Behav,2000;67(1):65-70.
6Zhang Y,Irwin MG,Wong TM,etal.Remifentanil preconditioning confers cardioprotection via cardiac kappa- and delta-opioid receptors〔J〕.Anesthesiology,2005;102(2):371-8.
7Philippe D,Dubuquoy L,Groux H,etal.Anti-inflammatory properties of the mu opioid receptor support its use in the treatment of colon inflammation 〔J〕.J Clin Invest,2003;111(9):1329-38.
8Benakis C,Bonny C,Hirt L.JNK inhibition and inflammation after cerebral ischemia 〔J〕.Brain Behav Immun,2010;24(5):800-11.
9Ye XH,Wu Y,Guo PP,etal.Lipoxin A4 analogue protects brain and reduces inflammation in a rat model of focal cerebral ischemia reperfusion 〔J〕.Brain Res,2010;1323(6):174-83.
10Davies CA,Loddick SA,Toulmond S,etal.The progression and topographic distribution of interleukin-1beta expression after permanent middle cerebral artery occlusion in the rat 〔J〕.J Cereb Blood Flow Metab,1999;19(1):87-98.
11Zhang Z,Chopp M,Goussev A,etal.Cerebral vessels express interleukin 1beta after focal cerebral ischemia 〔J〕.Brain Res,1998;784(1-2):210-7.
12Loddick SA,Turnbull AV,Rothwell NJ.Cerebral interleukin-6 is neuroprotective during permanent focal cerebral ischemia in the rat〔J〕.J Cereb Blood Flow Metab,1998;18(2):176-9.
13Barone FC,Arvin B,White RF,etal.Tumor necrosis factor-alpha.A mediator of focal ischemic brain injury 〔J〕.Stroke,1997;28(6):1233-44.
14Zhang RL,Chopp M,Chen H,etal.Temporal profile of ischemic tissue damage,neutrophil response,and vascular plugging following permanent and transient(2H) middle cerebral artery occlusion in the rat 〔J〕.J Neurol Sci,1994;125(1):3-10.
15Frenkel D,Huang Z,Maron R,etal.Nasal vaccination with myelin oligodendrocyte glycoprotein reduces stroke size by inducing IL-10-producing CD4+ T cells 〔J〕.J Immunol,2003;171(12):6549-55.
16Ooboshi H,Ibayashi S,Shichita T,etal.Postischemic gene transfer of interleukin-10 protects against both focal and global brain ischemia〔J〕.Circulation,2005;111(7):913-9.
17Pang L,Ye W,Che XM,etal.Reduction of inflammatory response in the mouse brain with adenoviral-mediated transforming growth factor-ss1 expression 〔J〕.Stroke,2001;32(2):544-52.
18Moore KW,de Waal Malefyt R,Coffman RL,etal.Interleukin-10 and the interleukin-10 receptor 〔J〕.Annu Rev Immunol,2001;19:683-765.
19Nurmi A,Lindsberg PJ,Koistinaho M,etal.Nuclear factor-kappaB contributes to infarction after permanent focal ischemia 〔J〕.Stroke,2004;35(4):987-91.
20Stephenson D,Yin T,Smalstig EB,etal.Transcription factor nuclear factor-kappa B is activated in neurons after focal cerebral ischemia〔J〕.J Cereb Blood Flow Metab,2000;20(3):592-603.
