高血糖对全脑缺血再灌注大鼠学习记忆的影响及PD98059的干预作用
2014-09-13李建民赵雅宁常学优
李建民 赵雅宁 常学优 刘 乐
(河北联合大学康复医学院,河北 唐山 063000)
研究发现高血糖不仅是脑梗死的最常见病因,同时,高血糖又增加了脑梗死的危险性,加重脑缺血病理损伤,影响预后〔1〕。PD98059是丝裂原活化蛋白激酶(MAPKs)家族成员-细胞外信号调节激酶1/2(ERK1/2) 特异性抑制剂。MAPKs信号通路是连接大多数细胞外信号与膜受体、转录因子和各基因调节的中央信号通路,其家族成员包括细胞外信号调节激酶(ERK)和p38 MAPK等。研究认为ERK1/2信号激活后通过链式级联反应,激活转录因子ATF-2、Elk-1、CHOP10等,调控细胞因子,凋亡基因的表达,对中枢神经系的影响主要表现“双刃剑”作用〔2,3〕。本研究建立高血糖大鼠全脑缺血再灌注损伤模型上,应用PD98059进行干预,观察海马区神经细胞形态结构、学习记忆功能的变化,以探讨PD98059对高血糖大鼠脑缺血再灌注损伤后认知功能的影响。
1 材料与方法
1.1实验动物 健康雄性SD大鼠120只,由北京维通利华公司提供,体重250~300 g,实验动物使用许可证编号:SCXK(京)2005-0013。
1.2实验仪器与试剂 图像采集及图像分析系统(美国Bio-Rad生物仪器设备公司);八臂迷宫(淮北正华生物仪器设备有限公司);血糖仪(拜耳仪器设备有限公司)。
1.3实验方法 大鼠随机分为4组:假手术组(Sham,n=10)、全脑缺血再灌注组(IR,n=20)、高血糖+全脑缺血再灌注组(DCI,n=20)、高血糖+全脑缺血再灌注+PD98059抑制剂组(PD,n=20)。每组又随机分为24 h、48 h两个时间点。采用改良的Pulsineli 4血管阻断(4-VO)法〔3〕制作SD大鼠全脑缺血模型:动物常规麻醉,颈正中切口,分离双侧颈总动脉,在其下置线备用。枕后部正中切开,暴露双侧第1颈椎横突翼孔,直视下热凝其下通过的椎动脉,电凝每次时间约2~4 s,使翼小孔后双侧椎动脉永久闭塞。术后大鼠缝皮回笼,24 h后以无创性微动脉夹夹闭双侧颈总动脉,缺血30 min后松开动脉夹,实行再灌注。缺血及再灌注期间用红外线测温仪监测耳内鼓膜温度,并使之维持在(37±0.2)℃。Sham组分离暴露血管,但不电凝椎动脉、不夹闭颈总动脉。DCI模型:大鼠术前禁食12 h,按55 mg/kg腹腔注射链脲佐菌素(STZ),72 h后空腹血糖超过16.7 mmol/L,有多尿、体质量下降等表现的大鼠为高血糖大鼠后,按照上述IR模型进行手术,方法同IR组。PD抑制剂组:高血糖大鼠复制成功后,在夹毕双侧颈总动脉前2 h经尾静脉注射配制好的PD98059(0.3 mg/kg)其余手术方法同IR组。
1.4病理组织学检测 HE染色: 0.4 % 戊巴比妥钠麻醉动物,开胸、暴露心脏,4%多聚甲醛行心灌流,断头取脑,在视交叉后1 mm和6 mm处冠状面切开,取中间块入4%多聚甲醛固定液固定,石蜡包埋,切片(片厚5 μm),苏木精-伊红染色。电镜:动物常规麻醉,混合固定液(2.5%戊二醛和2%多聚甲醛的磷酸缓冲液)心脏灌流,取海马,切成1 mm ×1 mm ×1 mm 组织块,立即以4 %戊二醛固定,0.1 mol/L二甲砷酸缓冲液冲洗两遍,再经1%四氧化锇固定,缓冲液冲洗,逐级丙酮脱水,环氧树脂浸透,包埋,超薄切片,醋酸铀枸橼酸铅双重染色。透射电镜观察脑组织超微结构的变化。
1.5学习记忆功能检测 八臂迷宫是一种比较理想的测试学习和记忆的模型,实验动物通过观察周围一些固定的参照物所提供的信息,来学习和记忆自身与饵(置于迷宫臂末端的食物)的相对位置。该方法不但可以有效地排除动物由于自身运动机能障碍而对学习和记忆观察指标的影响,还可以同时分离和分析动物工作记忆与参照记忆〔4〕。各组实验动物在晚8:00和早6:00分2次进入八臂迷宫进行学习和记忆行为功能检测,每天每只动物测试两次,取均值。将大鼠放入迷宫内,记数大鼠5 min内搜索放置在八臂中的四个臂内(1、3、5、7号臂)食物饵的规律:①总错误次数(TTEF),即大鼠进入没有饵的臂(包括已吃完和未放饵的臂)的次数;②工作记忆错误次数(TWMEF),工作记忆错误是指大鼠再次进入开始放有饵的臂的次数;③参考记忆错误次数(TRMEF),参考记忆错误是指大鼠第1次进入没有放饵的臂的次数。
1.6统计学方法 应用SPSS统计软件进行方差分析。
2 结 果
2.1病理检测结果 HE染色(表1):Sham组海马区神经元结构完整,排列整齐致密,未见变性坏死的神经元。IR组24和48 h时间点均可见海马区变性坏死神经元,表现为细胞间隙加大,细胞核浓缩、深染,溶解、消失,存活神经元密度均明显减少(P<0.05);DCI组中海马区神经元结构损伤加重,神经元细胞存活密度进一步降低(P<0.05);PD组海马区存活的神经元较进一步减少,视野内较少正常的神经细胞(P<0.05)。电镜(图1,图2):Sham组中神经元内可见正常细胞器,包括高尔基体、粗面内质网、多聚核糖体、线粒体、溶酶体等。神经细胞轴索、微管正常;轴索结构排列正常。IR组24和48 h时间点可见神经细胞不同程度固缩,胞质、胞核电子密度增高,核膜凹陷,高尔基体扩张呈大泡状,多聚核糖体解聚,高度肿胀、线粒体嵴断裂或空泡化,双膜结构模糊或外膜破裂、消失,细胞器稀疏;轴索排列紊乱、肿胀,髓鞘泡鼓、内折及分层,轴索变性、断裂等。DCI组中神经元细胞损伤进一步加重,染色质聚集明显,基质出现大量空泡,核膜模糊、凹陷,细胞器数量减少,仅见极少量细胞器,髓鞘严重分层,一些部位出现断裂。PD组各时间点神经元损伤现象进一步加重,视野内较少超微结构正常的神经细胞。
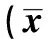
表1 各组大鼠海马区存活神经元密度比较±s,n=20)

图1 各组大鼠缺血48 h海马区神经元形态变化(×20 000)

图2 各组大鼠缺血48 h海马区髓鞘的形态变化(×20 000)
2.2学习记忆功能检测结果 与Sham组比较,IR组动物8次测试中总错误次数和参考错误次数增加(P<0.05),与IR组比较,DCI组中大鼠总错误次数、参考错误次数和工作记忆次数增加(P<0.05);与DCI组比较,PD组中总错误次数和参考记忆错误次数进一步增多(P<0.05),但工作记忆错误次数无明显变化(P<0.05)。见表2。
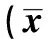
表2 各组大鼠学习记忆功能指标检测结果比较±s,n=20)
3 讨 论
本实验结果说明高血糖可加重脑缺血的病理损伤及神经功能的预后。与临床相关报道一致。研究认为高血糖加重缺血性脑损伤的机制与加剧对血脑屏障的破坏、恶化炎症反应、增加细胞凋亡等从而加重脑缺血再灌注损伤有关〔5,6〕。
PD98059是ERK1/2蛋白特异性抑制剂,可抑制ERK1/2/MAMPK信号通路的激活,该信号的特点是应激激活后通过链式级联反应,激活转录因子ATF-2、Elk-1、CHOP10等,调控细胞因子,凋亡基因的表达,参与多种病理和生理过程。目前关于ERK1/2信号通路在中枢神经系统疾病中的病理作用存有一定争议。有学者认为ERK1/2通过介导某些生长因子转录如ELK-1、c-fos、c-myc等,促进细胞的增殖、分化,影响突触重塑,抑制死亡、促进细胞存活而对神经损伤后的形态和功能有保护作用〔7〕。也有观点认为ERK1/2信号可强化谷氨酸兴奋性毒性作用、扩大炎症及氧化应激反应、介导神经细胞凋亡从而加重脑缺血、癫痫、PD等病理损伤。海马是大脑的重要结构,在学习和记忆功能以及调节神经内分泌和自主神经活动中起重要作用〔8,9〕。动物实验显示,损毁双侧海马可妨碍动物视觉分辨学习,使大鼠Y迷宫分辨学习和防御条件反应的保持遭到严重的破坏〔10〕。本研究说明PD98059进一步加剧了高血糖对脑缺血动物的神经损伤,也提示ERK1/2作为内源性启动的保护性蛋白参与高血糖加重脑缺血损伤病理进程。本研究中,与DCI组比较,PD组中海马区存活神经元密度进一步下降。结合文献,我们认为PD98059干扰ERK1/2信号通路的活化,抑制ERK1/2的促细胞存活信号的转录,促进海马区神经细胞的死亡,进而加重了高血糖脑缺血动物的学习记忆损伤。
4 参考文献
1Kagansky N,Levy S,Knor H.The role of hyperglycemia in acute stroke〔J〕.Arch Neurol,2001;58(8):1209-14.
2Biswas SC,Greene LA.Nerve growth factor (NGF) down-regulates the Bcl-2 homology3 (BH3) domain-only protein Bim and suppresses its proapoptotic activity by phosphorylation〔J〕.Biol Chem,2002;277(5):49511-6.
3李金星,赵海梅,朱贤立,等.弥漫性脑损伤细胞外信号调节激酶1/2信号通路的激活及意义〔J〕.中华创伤杂志,2007;23(11):373-6.
4LI JM.The temperature-dependent modulation of an inhibitory circuit in hippocampal slices as revealed by a population spike recording is mediated by extracellular adenosine〔J〕.Jpn Physiol,2007;7(12):1147-51.
5Kawai N,Keep RF,Betz AL.Hyperglycemia and the vascular effects of cerebral ischemia〔J〕.Acta Neurochir Suppl,1997;70(4):27-9.
6郭子江,张仲慧,尹 琳,等.高血糖对大鼠脑缺血再灌注损伤脑梗死体积和ICAM-1表达及白细胞浸润的影响〔J〕.中国民康医学杂志,2005;17(5):14-6.
7Gonzalez-Zulueta M,Feldman AB,Klesse LJ,etal.Requirement for nitric oxide activation of p21(ras)/extracellular regulated kinase in neuronal ischemic preconditioning〔J〕.Proc Natl Acad Sci,2000;97(6):436-41.
8Kang L,Chung LC,Chen SD,etal.Inhibition of the MEK/ERK pathway reduces microglial activation and interleukin-1-beta expression in spinal cord ischemia/reperfusion injury in rats〔J〕.Thorac Cardiovasc Surg,2007;133(4):934-41.
9孔 敏,巴茂文,刘振国,等.细胞外信号调节激酶通路在帕金森病运动并发症中的作用〔J〕.中华神经外科杂志,2009;25:306-9.
10Chee MW,Chuah LY,Venkatraman V,etal.Functional imaging of working memory following normal sleep and after 24 and 35 h of sleep deprivation correlations of fronto-parietal activation with performance〔J〕. Neuroimage,2006;31(1):419-28.
