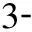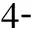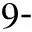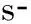活化蛋白C对体外循环大鼠肺的保护作用
2014-09-12周建明胡若愚靖胜杰王玉华薛新汤文浩
周建明,胡若愚,靖胜杰,王玉华,薛新,汤文浩
(东南大学附属中大医院 心胸外科,江苏 南京 210009)
本研究通过建立大鼠CPB模型,并于CPB开始前给予APC预处理,探讨APC对CPB术后大鼠ALI的保护作用及其可能的机制,并研究其与凝血酶的相互作用关系。
1 资料与方法
1.1 实验动物
成年雄性SD大鼠48只,体重 450~550 g,由东南大学医学院动物中心提供,随机分为对照组、凝血酶组、APC组、APC+凝血酶组4组,每组12只。
1.2 实验试剂及主要器材
1.3 实验方法
1.3.1 大鼠CPB模型的建立 CPB建立方法参照文献[6]并略加改进。主要步骤如下:0.2%戊巴比妥钠溶液腹腔麻醉,气管插管机械通气,潮气量为8 ml·kg-1。分离左侧股动脉,近心端穿刺置入24 G静脉留置针,监测动脉血压,并经该通路留取血样标本。尾动脉根部穿刺置入20 G静脉穿刺导管,接动脉灌注管,经右颈静脉穿刺置入16 G静脉导管(导管侧面制6~8个侧孔),将导管插管向远端直插入右房近下腔静脉入口处,左股静脉置入18 G插管接静脉引流管,接储血槽(10 ml空针),连接微量滚动泵及膜式氧合器,膜式氧合器远心端连接动脉灌注管经尾动脉进行动脉灌注。循环60 min后停止CPB并观察,待大鼠心率、血压等生命体征平稳后,撤除血管插管,缝合手术切口,结束实验。
1.3.2 各组大鼠干预方法 CPB开始时凝血酶组、APC组大鼠分别给予凝血酶0.5U·kg-1、APC 0.1 mg·kg-1;APC+凝血酶组给予凝血酶 0.5U·kg-1,5 min后给予APC 0.1 mg·kg-1;对照组给予等量生理盐水。各组大鼠分别于CPB术前、结束即时、结束后60 min抽取动脉血1 ml,离心后留取血浆,-80 ℃保存备用。各组大鼠分别于CPB术前、CPB术后即刻、术后60 min取全血细胞,经溶血素裂解红细胞后洗涤、离心、重悬后获得白细胞悬液,使用流式细胞仪检测白细胞悬液中CD11b+/CD18+细胞含量。
1.3.4 支气管肺泡灌洗液(BALF)白细胞计数、肺毛细血管通透性指数(PMPI)测定及肺湿干重比(W/D) 处死大鼠后,解剖胸腔获得肺组织,结扎左主支气管,以Hank液2.5 ml经右主支气管灌洗,反复3次,获得的BALF经10 000 r·min-1离心后抽提上清,采用考马斯亮蓝蛋白测定法检测BALF上清及血清中蛋白浓度,BALF中蛋白浓度与血清蛋白浓度之比为PMPI。
经离心沉淀的细胞成分用Hank液在同样条件离心冲洗2次,制成细胞悬液。在改良的Neubauer计数台上计数BALF中细胞总数,以×109L-1表示。后进行HE染色,在40倍光学显微镜下计数200个细胞,进行细胞分类计数,计算白细胞数量。
取部分肺组织,称重后放入80 ℃烤箱中48 h,再称重,计算W/D。
1.3.5 肺组织病理学检测 取左下肺叶部分肺组织(约1 cm3),置入10%中性甲醛固定、石蜡包埋后切片,经HE染色、封片后于光镜下检测肺组织损伤程度。
1.4 统计学处理

2 结 果
2.1 肺组织病理学检测
HE染色组织切片显示:4组均可观察到明显肺组织损伤征象,表现为肺泡结构的破坏、肺泡腔减小、肺泡腔及肺间质内出血、炎症细胞浸润、肺泡透明膜形成等。APC组肺组织病理切片较其他3组损伤程度有明显减轻,APC+凝血酶组次之,凝血酶组肺损伤最为严重。见图1。
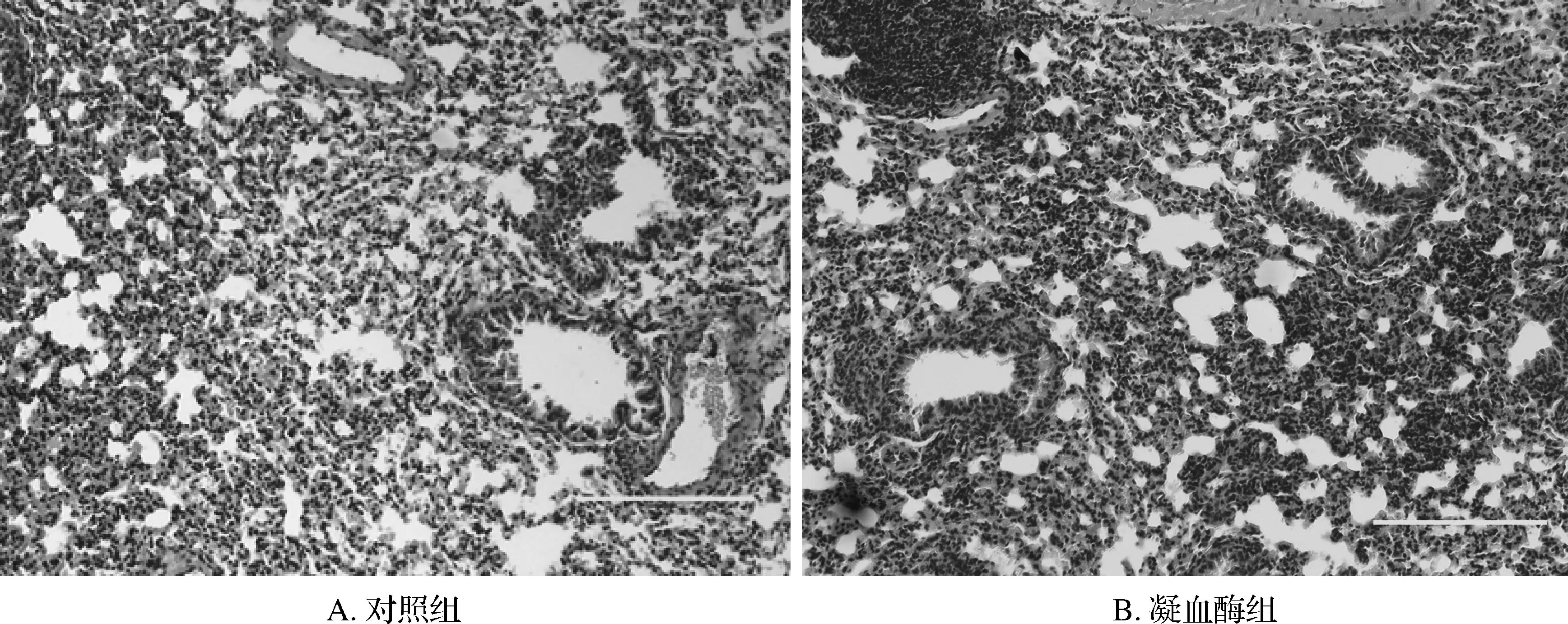
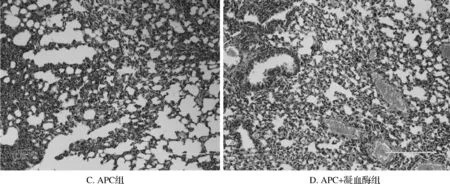
图1肺组织病理切片凝血酶组间质水肿,肺泡壁毛细血管扩张、出血,中性粒细胞聚集浸润明显,APC组这种改变最轻,APC+凝血酶组次之 HE×200
2.1.1 外周血CD11b/CD18流式细胞检测 各组CPB术后其外周血中CD11b+/CD18+细胞含量明显升高(P<0.01),其中凝血酶组升高最为明显。APC组在CPB结束即时及术后60 min明显低于其他各组水平(P<0.05)。对照组与APC+凝血酶组在CPB结束时无差异(P=0.061),术后1h APC+凝血酶组明显低于对照组(P<0.01)。见表1。

组 别CPB开始CPB结束即刻CPB结束60minCd11b/CD18IL-8/pg·ml-1NE/ ng·ml-1Cd11b/CD18IL-8/pg·ml-1NE/ng·ml-1Cd11b/CD18IL-8/pg·ml-1NE/ ng·ml-1对照组27.13±3.805.57±1.2324.18±4.7361.02±9.5847.69±6.2478.81±10.0963.61±7.4257.51±8.3498.78±8.71凝血酶组26.74±4.075.08±1.1427.95±5.2573.74±6.90b63.34±1.31a91.80±11.99a76.87±5.57b81.09±8.95a113.28±13.9aAPC组29.32±3.605.27±1.2029.08±4.8746.23±6.19bc29.9±4.82ac63.71±9.52bc43.01±6.97bc36.43±4.70bc79.56±8.71bcAPC+凝血酶组25.51±3.995.31±1.3426.17±3.6053.79±5.32c32.41±6.49ac69.13±11.62ac50.79±5.30bc46.72±6.50bc78.32±11.01ac
与对照组比较, aP<0.05, bP<0.01; 与凝血酶组比较, cP<0.01
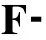

组 别BALF白细胞计数/106L-1肺组织TNF-α/ng·g-1PMPI肺W/D对照组8.13±1.3110.27±1.601.11±0.206.77±0.84凝血酶组10.12±1.22a12.37±1.99a1.39±0.28a7.82±1.01APC组5.92±1.14ab7.44±1.91ab0.83±0.16ab5.42±0.80abAPC+凝血酶组6.64±1.19ab8.19±1.68ab0.88±0.17b5.89±0.96ab
与对照组比较, aP<0.05; 与凝血酶组比较, bP<0.01
3 讨 论
据报道,ALI患者血浆蛋白C的含量明显低于健康对照组,凝血酶调节蛋白和纤溶酶原激活物抑制物的抗原含量显著高于健康对照组,即凝血活性增加而纤溶活性降低;这种变化与肺组织损伤的严重程度成正相关[7]。在炎症因子的刺激下,肺泡巨噬细胞、肺泡上皮细胞产生大量组织因子,导致凝血活性明显增强以及肺部微血栓的形成[8]。
ALI发生时,肺微血管内皮细胞和肺泡上皮细胞凋亡增加,而中性粒细胞(polymerphonuclear,PMN)等炎症细胞凋亡延迟并在肺内聚集[9]。凝血酶原激活后与肺泡上皮表面表达的血栓调节蛋白结合,激活蛋白C生成APC,但肺泡上皮的大量凋亡阻断了这一功能。因此,外源性APC有可能通过减少或对抗凝血酶的作用,调节凝血/纤溶系统平衡,抑制全身炎症反应的发展,达到减轻肺损伤可能。