粗糠柴毒素对SD大鼠抗心肌缺血-再灌注损伤的作用
2014-09-12李鸿博郎小娥
李鸿博 郎小娥
(北京协和医学院,北京 100005)
及时开通梗死相关动脉恢复心肌血流灌注,挽救濒死心肌是治疗急性心肌梗死最有效最关键的措施。然而缺血心肌的再灌注(I/R)可引起心肌I/R损伤(MIRI)。随着心脏外科手术和介入治疗技术的进展以及心肌缺血病人的增加,MIRI已成为临床上常见的一种病理生理过程。随着研究的深入,缺血预处理、麻醉预处理等一系列心肌保护措施已被发现〔1~3〕,且已被证明可以有效地对抗MIRI。心脏保护的机制较为复杂,其中乙醛脱氢酶2(ALDH2)的磷酸化与激活被证明在心脏保护中起关键介导作用〔4〕。另外,有研究发现在再灌注初期蛋白激酶Cδ(PKCδ)活化可通过调控线粒体介导细胞的凋亡和坏死,抑制PKCδ则会减轻I/R的各项损伤指标〔5〕。粗糠柴毒素是从植物粗糠柴中提取出的一种小分子物质〔6〕。Gschwendt等〔7〕首次报道粗糠柴毒素是一种PKCδ的选择性抑制剂后,大量实验研究以施用粗糠柴毒素作为抑制PKCδ活性的药理学手段。另一方面,关于粗糠柴毒素的潜在药物用途的研究也有报道,但就其对抗MIRI的效果却研究较少。本研究通过构建大鼠在体心肌I/R模型并观察粗糠柴毒素的处理效果来阐明粗糠柴毒素的心脏保护作用。
1 材料和方法
1.1实验动物 选取雄性SD大鼠,体重200~220 g。由清华大学实验动物中心提供。安置于无特殊病原体、温度(23℃±3℃)和湿度(60%±5%)的控制室内,光暗周期为12 h:12 h(光照早上8点开始)。饮用水和标准饲料均经灭菌后供动物自由取用。
1.2急性心肌I/R模型制备 给予实验SD雄性大鼠腹腔注射戊巴比妥钠(30 mg/kg)麻醉,气管切开术后,大鼠肺组织进行机械正压通气,使用30%~40%的空气/氧气混合物,通过调整呼吸频率和潮气量,在整个实验中维持动脉血气pH值在生理范围内。心肌梗死是由结扎冠状动脉左前降支(LAD)引起。在大鼠胸骨左缘第4或第5肋间隙开胸,实施胸廓切开术及心包切开术后,暴露心脏,在距LAD基部2~3 mm处用6~0无创伤性丝线进行结扎,通过结扎LAD造成心肌梗死即可建立大鼠急性心肌缺血模型。剪断结扎线心肌复灌。对所有大鼠进行区域性心肌缺血40 min,之后进行120 min再灌注处理〔8〕。将大鼠随机分为两组,各8只:实验组在缺血处理前5 min给予1 μmol/L粗糠柴毒素处理,对照组以生理盐水处理。
1.3血清乳酸脱氢酶(LDH)活性和肌酸激酶同工酶(CK-MB)活性的测定 再灌注5 min后,从各实验组大鼠采集5 ml静脉血样本,使用台式离心机以5 000 r/min离心5 min,血清保存于液氮中。样品解冻后进行分析测定。使用7 600全自动生化分析仪及商用试剂盒Creatine Kinase-MB Liquid Reagent和Cytotoxicity Detection Kit (LDH) 测定LDH和CK-MB的活性,作为评价心肌损伤的指标。
1.4Western 印迹测定心肌组织phos-ALDH2和Total-ALDH2蛋白的表达 取血后,迅速剪下各组大鼠的心脏,每只大鼠取相同部位的左心室前壁心肌组织0.2 g,用生理盐水冲洗,剪碎心肌组织后加入2 ml RIPA裂解液(1 ml RIPA+10 μl PMSF)至玻璃匀浆器中,冰浴下进行机械匀浆,匀浆液在冰上静置30 min直至充分裂解后,以12 000 r/min 4℃离心30 min,取上清,用二喹啉甲酸(BCA)法测定蛋白质浓度。用RIPA裂解液均衡每一样品中的蛋白液浓度,保证每个样品孔蛋白上样量一致,加入5×loading buffer后,于100℃煮沸变性5 min,分装蛋白上样液并于-70℃储存。取50 μg蛋白上样进行十二烷基硫酸钠-聚丙烯酸胺凝胶(SDS-PAGE)电泳,电泳分离蛋白后,将目标蛋白带转移至聚偏氯乙烯(PVDF)膜上,将印迹后的PVDF膜放入盛有封膜液的平皿中室温孵育封闭2 h。用抗体稀释液按1∶1 000分别稀释兔抗大鼠ALDH2抗体和兔抗大鼠Phos-ALDH2抗体,按1∶500稀释抗大鼠β-actin抗体,将PVDF膜蛋白面朝下放于抗体液面上,4℃孵育过夜。用Tris盐酸缓冲液(TBST)洗涤PVDF膜3次,5 min/次。然后将膜用TBST(1∶2 000)稀释的HRP标记的山羊抗兔IgG二抗室温下孵育2 h后,用TBST室温下洗膜3次,10 min/次。增强化学发光法(ECL)显色。将胶片进行扫描或拍照,用凝胶图像处理系统分析目标带的分子量和净光密度值等记录相应的表达量,得出磷酸化ALDH2占总ALDH2的比例。
1.5统计学分析 采用SPSS15.0软件进行t检验。
2 结 果
粗糠柴毒素处理显著抑制大鼠MIRI所导致的血清CK-MB和LDH升高。另外,粗糠柴毒素处理使I/R心肌细胞ALDH2磷酸化水平显著增加,这提示粗糠柴毒素可能通过激活ALDH2来诱导心脏保护。各组LDH、CK-MB活性及ALDH2磷酸化比例见表1。典型的Western 印迹条带,见图1。
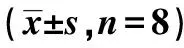
表1 两组LDH、CK-MB活性与phos-ALDH2/Total-ALDH2比值比较

图1 Western 印迹结果
3 讨 论
自从1994年粗糠柴毒素被首次报道以来,关于粗糠柴毒素药理作用的研究一直在进行〔7〕。目前已发现的作用包括抗过敏、诱导肿瘤干细胞自噬及凋亡以及抑制肿瘤细胞转移等〔8~11〕。也有文献报道〔6〕粗糠柴毒素有希望作为新的肿瘤化疗药物。
关于粗糠柴毒素的作用机制至今尚存在争议。最初认为粗糠柴毒素是一种选择性的PKCδ抑制剂〔7〕,并用于大量对PKCδ生物学功能的研究中〔6〕。然而,随后有证据表明在很多条件下粗糠柴毒素对PKCδ活性并无直接影响,而且特异性不强,对蛋白激酶家族的多个成员如PKB、PRAK等均具有抑制作用〔12〕。也有研究表明在PKCδ敲除的大鼠中,粗糠柴毒素还可表现其抑制蛋白磷酸化的作用〔13〕。目前一般认为粗糠柴毒素的作用机制复杂,存在PKCδ依赖和非PKCδ依赖两类途径〔6〕。粗糠柴毒素的线粒体氧化磷酸化解耦联作用已被证明不依赖于PKCδ,其下游事件可能是粗糠柴毒素多种生物学功能的真正机制〔14〕。
粗糠柴毒素与细胞凋亡的关系也较为复杂。研究证实粗糠柴毒素有促凋亡与抑制凋亡的双重作用,且可能为PKCδ依赖或非PKCδ依赖性〔14〕。已有研究〔10〕表明粗糠柴毒素具有胰腺肿瘤干细胞凋亡的作用,而本研究中粗糠柴毒素表现为抑制I/R心肌细胞的凋亡及物质释放。ALDH2作为一种醛类代谢的关键酶,在清除缺氧条件下产生的毒性醛类起关键作用,其磷酸化参与了多种药物预处理方式如乙醇预处理〔5〕、麻醉预处理〔15〕等诱导的心脏保护。本实验提示了无论粗糠柴毒素在对抗MIRI方面的机制如何,这一物质最终能够激活ALDH2保护通路,减轻I/R引起的心肌细胞死亡。虽然粗糠柴毒素尚未被批准药用〔16〕,且其作用机制有待于进一步阐明,然而本研究提示了一种新的药物预处理方式,对MIRI的机制研究提供了新的途径。
4 参考文献
1Murry CE,Jennings RB,Reimer KA. Preconditioning with ischemia:a delay of lethal cell injury in ischemic myocardium〔J〕.Circulation,1986;74(5):1124-36.
2Kersten JR,Schmeling TJ,Pagel PS,etal. Isoflurane mimics ischemic preconditioning via activation of K(ATP) channels:reduction of myocardial infarct size with an acute memory phase〔J〕.Anesthesiology,1997;87(2):361-70.
3Cason BA,Gamperl AK,Slocum RE,etal. Anesthetic-induced preconditioning:previous administration of isoflurane decreases myocardial infarct size in rabbits〔J〕. Anesthesiology,1997;87(5):1182-90.
4David T,Lucas DT,Szweda LI. Declines in mitochondrial respiration during cardiac reperfusion:Age-dependent inactivation of a-ketoglutarate dehydrogenase〔J〕.Proc Natl Acad Sci U S A,1999;96(12):6689-93.
5Chen CH,Budas GR,Churchill EN,etal. Activation of aldehyde dehydrogenase-2 reduces ischemic damage to the heart〔J〕.Science,2008;321 (5895):1493-5.
6Maioli E,TorricelliC,Valacchi G.Rottlerin and cancer:novel evidence and mechanisms〔J〕.Sci World J,2012;2012:350826.
7Gschwendt M,Muller HJ,Kielbassa K,etal.Rottlerin,a novel protein kinase inhibitor〔J〕.Biochem Biophys Res Commun,1994;199(1):93-8.
8Raphael J,Rivo J,Gozal Y. Isoflurane-induced myocardial preconditioning is dependent on phosphatidylinositol-3-kinase/Akt signalling〔J〕.Br J Anaesth,2005;95(6):756-63.
9Chan TK,Ng DS,Cheng C,etal. Anti-allergic actions of rottlerin from Mallotus philippinensis in experimental mast cell-mediated anaphylactic models〔J〕.Phytomedicine,2013;20(10): 853-60.
10Singh BN,Kumar D,Shankar S,etal. Rottlerin induces autophagy which leads to apoptotic cell death through inhibition of PI3K/Akt/mTOR pathway in human pancreatic cancer stem cells〔J〕.Biochem Pharmacol,2012;84(9):1154-63.
11Lin CJ,Lin CY,Chen Y,etal.Rottlerin inhibits migration of follicular thyroid carcinoma cells by PKCδ-independent destabilization of the focal adhesion complex〔J〕.J Cell Biochem,2010;100(2):428-37.
12Davies SP,Reddy H,Caivano M,etal.Specificity and mechanism of action of some commonly used protein kinase inhibitors〔J〕.Biochemi stry,2000;351(1):95-105.
13Leitges M,Elis W,Gimborn K,etal.Rottlerin-independent attenuation of pervanadate-induced tyrosine phosphorylation events by protein kinase C-delta in hemopoietic cells〔J〕.Lab Invest,2001;81(8):1087-95.
14Soltoff SP.Rottlerin:an inappropriate and ineffective inhibitor of PKCdelta〔J〕.TRENDS Pharmacol Sci,2007;28:453-8.
15Lang XE,Wang X,Zhang KR,etal. Isoflurane preconditioning confers cardioprotection by activation of ALDH2〔J〕.PLoS One,2013;8(2):e52469.
16Huang DC,Strasser A.BH3-only proteins-essential initiators of apoptotic cell death〔J〕.Cell,2000;103(6):839-42.
