RAGE阻断剂FPS-ZM1对糖基化终末产物所致大鼠脑部炎症反应的影响及机制
2014-09-12孙梦晗候训尧马莹娟罗鼎真刘雪平
孙梦晗 洪 艳 候训尧 马莹娟 申 超 罗鼎真 刘雪平
(山东大学附属省立医院老年神经科,山东 济南 250021)
糖基化终末产物(AGEs)是蛋白质非酶糖化的终末不可逆聚合物,研究证实阿尔茨海默病(AD)患者脑中存在大量AGEs,并通过与其受体RAGE结合启动核转录因子(NF)-κB 等信号途径,从而维持和扩大AD的炎症反应〔1〕。因此通过阻断RAGE与AGEs的结合来抑制炎症反应,可能将成为治疗AD的有效手段之一。FPS-ZM1是一种人工合成的RAGE受体特异性阻断剂,已有研究证明FPS-ZM1有较高的血脑屏障通过性,且即使高于治疗剂量的500倍也在安全范围之内。研究亦发现FPS-ZM1能够通过血脑屏障,作用于脑内细胞以减轻NF-κB的活性,从 而 阻 断Aβ 产 生,并提高痴呆小鼠的智能〔2〕。本实验在此研究的基础上,采用脑AGEs损伤的动物模型,用FPS-ZM1干预,观察RAGE、p-NF-κB和肿瘤坏死因子(TNF)-α表达水平,为揭示AD发病机制及明确FPS-ZM1对AD脑内炎症反应的影响提供依据。
1 材料与方法
1.1材料
1.1.1实验动物及分组 健康成年雄性Wistar 大鼠40只,体重250~270 g。适应性喂养1 w,标准啮齿类动物饲料喂养, 自由进食与饮水, 室温保持约25℃,湿度约50%。由山东大学医学院动物中心提供。随机分为生理盐水组(NC组)、FPS-ZM1对照组、AGEs组和FPS-ZM1组,每组10只。
1.1.2主要试剂及仪器 AGEs- BSA(10 mg/ml) 购自Biovision公司, 小鼠抗RAGE多克隆抗体系美国Milli pore公司产品 ,小鼠抗p-NF-κB p65多克隆抗体为美国 CST公司产品 ,兔抗TNFα多克隆抗体系ImmunoWay生物科技公司产品,大鼠 Aβ1~40,Aβ1~42酶联免疫检测试剂盒购自上海希美化学有限公司,兔抗β-actin多克隆抗体为北京中杉金桥公司产品,小鼠抗β-actin多克隆抗体购自美国 Santa Cruz公司,组织总蛋白抽提试剂盒,BCA浓度测定试剂盒、化学发光法(ECL)发光液购自上海申能博彩公司、免疫组化染色试剂盒二氨基联苯胺(DAB)显色试剂盒购自北京博士德生物工程有限公司,辣根过氧化物酶标记羊抗兔二抗试剂盒购自北京中杉金桥生物技术有限公司、大鼠脑立体定位仪及微量注射器购自日本Narshige公司。
1.2方法
1.2.1动物分组及模型建立 Wistar大鼠麻醉后固定立体定位仪上,常规备皮消毒,于颅顶部正中切开,用微量注射泵海马内注射法造模〔3〕。AGEs组及FPS-ZM1治疗组大鼠两侧海马内各注射AGEs 5 μl,建立AGEs脑损伤模型,NC组及FPS-ZM1对照组以同样方法注射等量生理盐水以做脑损伤模型空白对照。造模前1 w以1 mg·kg-1·d-1向FPS-ZM1组和FPS-ZM1对照组腹腔注射FPS-ZM1并连续4 w给药,AGEs组、NC组则同时腹腔注射相同体积生理盐水以做给药空白对照。
1.2.2Morris水迷宫实验 该实验是检验学习记忆能力的一种重要手段,实验从造模3 w以后开始前4天每天于上午10点到下午4点训练,训练4次/d。训练开始前,在水迷宫池壁分别标4个方向的入水点,将平台放于西南象限正中,向迷宫内注入牛奶且高于平台。然后将大鼠分别从4个入水点放入迷宫若干次,训练其寻找到水面下平台的能力。第5天测试,任选1个入水点将大鼠放入池中,记录每次找到平台的时间。
1.2.3标本采集 于脑立体定位第3周,麻醉后剪开胸腔,行左心室生理盐水150~200 ml,持续灌洗,剪开右心耳,至右心耳流出清亮液体后,断头取脑,取出海马以液氮保存,用于Elisa检测和Western 印迹检测。
1.2.4酶联免疫(ELISA)检测 取出包被有抗淀粉样蛋白(Aβ)特异抗体的酶标板,按照标准品的次序分别向空白反应孔加50 μl不同浓度的标准品溶液,50 μl未知浓度的样品,50 μl蒸馏水;各孔加100 μl酶标记溶液;封口胶密封后,37℃温育60 min。甩去孔内液体,每孔加入洗涤液充分洗板3次,吸水纸拍干;每孔加显色剂A,B液各50 μl,37℃避光温育15 min后,取出酶标板每孔加50 μl终止液,15min内用酶标仪在450 nm处读OD值,并绘制标准曲线,根据样品的OD值在标准曲线上换算相应浓度。
1.2.5Western 印迹检测RAGE、NF-κB和TNFα蛋白表达 取组织提取蛋白,用二喹啉甲酸(BCA)法测蛋白浓度,经聚丙烯酰胺琼脂糖凝胶电泳后,转移到聚偏氯乙烯(PVDF)膜上,封闭液封闭 。用10 ml一抗稀释液孵育PVDF膜,4℃过夜,Tris盐酸缓冲液(TBST)洗膜 3 次,然后同辣根过氧化物酶结合的二抗室温一起孵育1 h。TBST洗膜3 次, 将膜与X线片在增感屏上紧密接触,应用Alpha Imager 2000凝胶图像分析系统(美国 Alpha innotech 公司产品)照相和条带密度扫描,计算目的蛋白表达相对水平:相对系数 =目的带表达强度/ β- actin 表达强度,以此进行半定量分析。
1.2.6免疫组化检测TNFα 石蜡切片常规脱蜡至水,切片置于枸橼酸抗原修复液中,微波加热进行抗原修复。取出切片,磷酸盐缓冲液(PBS)冲洗3次。滴加3%过氧化氢37℃温箱孵育30 min,PBS冲洗3次。分别滴加TNFα一抗(1∶200),湿盒中4℃过夜。PBS冲洗3次。滴加山羊抗兔二抗,37℃温箱孵育30 min。PBS冲洗3次;加入SABC复合物,37℃温箱孵育30 min,PBS洗3次;滴加DAB显色液,镜下显色30 s,蒸馏水冲洗,停止显色,苏木素复染2 min,自来水冲洗3 min,酒精梯度脱水,封片,拍照。

2 结 果
2.1实验动物情况 全部实验过程中 AGEs- BSA组大鼠意外死亡3只,死亡原因:1只死于手术时出血过多导致颅内压增高,2只死于麻醉过深,死亡组别给以相应补充。
2.2Morris水迷宫实验 AGEs组逃避潜伏期〔(18.80±1.69)s〕较NC组〔(12.40±2.07)s〕、FPS-ZM1对照组〔(12.50±2.37) s〕明显延长(P<0.01),FPS-ZM1组逃避潜伏期〔(11.90±2.13)s〕较AGEs组明显缩短(P<0.01),FPS-ZM1组逃避潜伏期较NC组、FPS-ZM1对照组无明显改变(P>0.05)。
2.3ELISA法定量检测各组大鼠海马区Aβ的表达 AGEs组海马区Aβ1~42和Aβ1~40的浓度(77.78±14.19,142.5±20.81)均较NC组(16.89±4.78,51.02±5.19)、FPS-ZM1对照组(9.32±5.82,53.02±11.47)明显增高(P<0.01);与AGEs组、FPS-ZM1组Aβ1~42和Aβ1~40的浓度明显降低(P<0.01),与NC组、FPS-ZM1对照组比较,FPS-ZM1组(20.34±8.81,68.43±12.86)Aβ1~42和Aβ1~40的浓度升高(P<0.01)。
2.4Western 印迹检测各组大鼠海马RAGE、p-NF-κB和TNFα蛋白表达并进行半定量分析 AGEs- BSA 组RAGE、p-NF-κB和TNFα蛋白表达明显高于 NC组、FPS-ZM1对照组(均P<0.01);与AGEs组比较,FPS-ZM1组上述指标表达明显降低(P<0.01);与NC组、FPS-ZM1对照组比较,FPS-ZM1组RAGE表达无明显差异(P>0.05),但p-NF-κB和TNFα表达增强(P<0.01)。见图1。
2.5免疫组化检测大鼠海马区TNFα的表达 与其他各组比较,AGEs组大鼠海马组织可见TNFα蛋白呈棕褐色阳性表达,着色最深;FPS-ZM1组免疫反应阳性细胞数少,染色浅;NC组、FPS-ZM1对照组海马区几乎没有阳性细胞,且较AGEs组和FPS-ZM1组细胞排列紧密,细胞无明显萎缩现象,见图2。

与NC组比较:1)P<0.01;与AGEs组比较:2)P<0.01;与FPS-ZM1对照组比较:3)P>0.05;与FPS-ZM1对照组比较:4)P<0.01
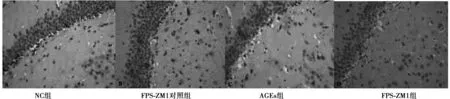
图2 免疫组化染色检测各组大鼠大脑海马区TNFα的表达(×400)
3 讨 论
流行病学资料显示,在需要长期使用非甾体抗炎药(NSAIDs)治疗的疾病人群(如风湿性关节炎病人)中,患AD的危险性明显低于同年龄对照组〔4〕。Blaskod等〔5〕研究发现培养的人星形胶质细胞中,在干扰素(IFN)-7和白介素(IL)-1β或TNF-α的共同作用下可产生Aβ,并导致脑内星形胶质细胞凋亡、坏死,提示炎症反应可能在AD的发生,发展起关键作用。
AGEs是由人体内的还原糖(葡萄糖)与蛋白质或脂质游离基发生不可逆反应形成〔6〕。有学者发现AD患者脑中的老年斑和神经纤维缠结存在大量AGEs〔7,8〕。AGEs是通过两种途径导致AD脑内慢性炎症反应的主要因素之一,具体机制主要有两方面:(1)AGEs可以直接在精氨酸和赖氨酸残基上对老年斑进行修饰,修饰后的老年斑可以激活邻近的胶质细胞,产生炎性细胞分子诱发 AD早期的炎症反应〔9〕。(2)通过诱导AD患者脑内的神经元和胶质细胞表面RAGE过量表达,引起NF-κB上调和磷酸化,促进前炎症因子的合成〔10~12〕。同时,RAGE还可以与Aβ结合,发生上述途径加剧炎症反应〔13〕,不仅如此,NF-κB的上调和炎症因子的增多会进一步促进RAGE的表达,因此阻断RAGE能切断AD患者脑内的炎症反应通路〔14〕,从而有效抑制AD的发生发展。
迄今为止AD尚无特效治疗方法和药物,关于AD抗炎药物的研究主要集中在NSAID〔15〕,Rogers等〔18〕在对28例AD病人进行6个月的吲哚美辛治疗后发现。吲哚美辛组认知得分仅提高1.3%〔16〕。研究发现:服NSAIDs组的平均病期较未服NSAIDs组明显延长;服NSAIDs组的认知评分较未服NSAID组高〔17〕。但目前关于NSAID治疗AD的临床试验多为回颐性资料,而前瞻性研究的样本均较小且观察期限短,同时因NSAIDs通过血脑屏障的能力一直未有实验证明。而使其对AD患者中枢的抗炎等作用受到质疑,加之NSAIDs本身的副作用〔16〕。因此,使NSAIDs全面推广于AD的临床治疗受到限制。
FPS-ZM1是一种人工合成的RAGE特异性阻滞剂,本实验提示FPS-ZM1能通过血脑屏障,通过抑制RAGE使p-NF-κB活性降低,最终减少TNFα的分泌而发挥明显的抗炎作用。不仅如此,研究证实因FPS-ZM1能阻断RAGE与Aβ结合,从而能减少外周Aβ进入脑内,并透过血脑屏障作用于脑内细胞上RAGE,通过降低p-NF-κB活性减少Aβ的生成〔2〕。已知NF-κB是一种多功能核内蛋白因子,其不仅负责调控炎症因子的转录,近来发现NF-κB还能在上游水平调控NSAID的作用靶点COX〔19〕,且NF-κB和RAGE参与AD的多条细胞信号转导通路,因此与NSAID相比,FPS-ZM1在抗炎和其他治疗AD的作用方面具有更显著和全面的优势。
综上,FPS-ZM1能穿过血脑屏障,通过特异性阻断RAGE,来抑制AGEs与RAGE结合引起的由NF-κB为介导的炎症反应,并能减少Aβ的生成,具有改善AD患者智能的潜力。关于FPS-ZM1如何通过抑制上述炎症通路来影响Aβ的生成仍需进一步研究。
4 参考文献
1Lue LF,Kuo YM,Beach T,etal.Microglia activation and anti-inflammatory regulation in alzheimer’s disease〔J〕.Mol Neurobiol,2010;41(2-3):115-28.
2Deane R,Singh I,Sagare AP,etal.A multimodal RAGE-specific inhibitor reduces amyloid β-mediated brain disorder in a mouse model of Alzheimer disease〔J〕.J Clin Invest,2012;122(4):1377-392.
3Li XH,Lv BL,Xie JZ,etal.AGEs induce alzheimer-like tau pathology and memory deficit via RAGE-mediated GSK-3 activation〔J〕.Neurobiol Ageing,2012;33(7):1400-10.
4McGeer PL,Schulzer M,MeGetr EG.Arthtitis and anti-inflammatory agents as possible protective factors for AIzheimer’s disease:a review of 17 epidemiologic studies〔J〕.Neurology,1996;47(2):425-32
5Blasko I,Veerhuis R,Stampfer-Kountchev M,etal.Costimulatory effects of interferon-gamma and interleukin-1 beta or tumornecrosis factor alpha on the synthesis ofAbeta l-40 andAbeta l-42 by human astrocytes〔J〕.Neu-robiolDis,2000;7(6 PtB):682-9
6Rahmadi A,Steiner N,Munch G.Advanced glycation endproducts as gerontotoxins and biomarkers for carbonyl-based degenerative processes in Alzheimer’s disease〔J〕.Clin Chem Lab Med,2011;49(3):385-91.
7Vitek MP,Bhattacharya K,Glendening JM,etal.Advanced glycation end products contribute to amyloidosis in Alzheimer disease〔J〕.Proc Natl Acad Sci USA ,1994;91(11):4766-70.
8Smith MA,Taneda S,Richey PL,etal.Advanced maillard reaction end products are associated with alzheimer disease pathology〔J〕.Proc Natl Acad Sci USA,1994;91(12):5710-4.
9Münch G,Kuhla B,Lüth HJ,etal.Anti-AGEing defences against Alzheimer's disease〔J〕.Biochem Soc Trans,2003;31(6):1397-9.
10丛 潇,王友政,张文生.晚期糖基化终末产物受体与阿尔茨海默病〔J〕.中国老年学杂志,2010;30(12):1759-61.
11杨秀颖,杜冠华.糖基化终末产物及相关药物研究进展〔J〕.中国药理学通报,2011;27(9):1185-8.
12Srikanth V,Maczurek A,Phan T,etal.Advanced glycation endproducts and their receptor RAGE in Alzheimer’s disease〔J〕.Neurobiol Aging,2011;32(5):763-77.
13Mattson MP.Apoptosis in neurodegenerative disorders〔J〕.Nat Rev Mol Cell Biol,2000;1(2):120-9.
14Haslbeck KM,Schleicher E,Bierhaus A,etal.The AGE/RAGE/NF-(kappa)B pathway may contribute to the pathogenesis of polyneuropathy in impaired glucose tolerance (IGT)〔J〕.Exp Clin Endocrinol Diabetes,2005;113(5):288-91
15盛树力.老年性痴呆:从分子生物学到临床诊治〔M〕.北京:科学技术文献出版社,1998:90-126.
16Breitner JC,Welsh KA,Helms MJ,etal.Delayed onset of Alzheimers' disease with nonsteroidal anti-inflammatory and histamine H2 blocking drugs〔J〕.Neurobiol Aging,1995;16(4):523-30.
17Halliday G,Robinson SR,Shepherd C,etal.Alzheimer’s disease and inflammation:a review of cellular and therapeutic mechanisms〔J〕.Clin Exp Pharmacol Physiol,2000;27(1-2):1-8.
18Rogers J,Griffin WST.Inflammatory mechanisms of Alzheimer’s disease〔A〕.In:Wool PL ,editor.Neuroinflammation:mechanisms and management〔C〕.Totowa,NY:Human Press,1998;177-93.
19Kim JH,Na HK,Pak YK,etal.Roles of ERK and p38 mitogen-activated protein kinases in phorbol ester-induced NF-kappaB activation and COX0~2 expression in human breast epithelial cells〔J〕.Chem Biol Interact,2008;171(2):133-41.
