冬凌草甲素通过激活ATM蛋白诱导人肝癌HepG2 细胞G2/M细胞周期阻滞
2014-09-12王海艳朱志兵
王海艳 朱志兵
( 德州市人民医院,山东 德州 253000)
冬凌草甲素(oridonin),别名冬凌草素、延命草宁,是冬凌草的主要有效成分,为四环二萜类化合物。研究表明,冬凌草甲素对多种肿瘤细胞有显著的抑制或杀伤作用,具有明显的细胞毒作用和较强的抗肿瘤活性〔1〕,冬凌草甲素对 20 余种人癌细胞株生长均有明显的直接抑制作用〔2〕,对多种肿瘤细胞如白血病细胞 NB4〔3〕、肝癌细胞 HepG2〔4〕、膀胱癌细胞MB49〔5〕、黑色素瘤细胞 A357-S2〔6〕等的增殖具有明显抑制作用。 我们前期工作表明冬凌草甲素对人肝癌HepG2 细胞具有生长抑制和诱导凋亡作用〔4〕。本课题在前期研究基础观察不同浓度的冬凌草甲素诱导肝癌HepG2细胞细胞周期阻滞和作用机制。
1 材料和方法
1.1材料 冬凌草甲素购自上海诗丹德生物技术有限公司(纯度≥98%),用DMSO 溶解(浓度≤0.1%) ;DMEM 培养基(美国Gibco公司);小牛血清(美国Gibco公司);H2AX(1∶100;Cell Signalling),γ-H2AX(1∶100;Cell Signalling),Phos-S1981ATM(1∶100;Cell Signalling),anti-p53(FL-353 at 1 μg/ml,Santa Cruz); anti-phospho-p53(S15) (1∶1 000,Cell Signaling);anti-ATM (1∶500,Rockland), anti-phosph-CHK2 (T68) (1∶500,Cell Signalling), anti-CHK2 (1∶1 000,Cell Signalling),辣根过氧化酶标记的羊抗兔、羊抗鼠二抗(1∶1 000,SantaCruz Biotechnology 公司); β-actin(美国 Santa Cruz公司); RNA酶、PI染液(美国Sigma 公司)。
1.2细胞系 人肝癌HepG2细胞株购自武汉大学中国典型培养物保藏中心。细胞接种于含10%小牛血清的DMEM 培养基中,置于37℃、5%CO2培养箱中培养,常规消化传代,取对数生长期细胞用于实验。
1.3Western印迹检测 p53、Cyclin A、 H2AX蛋白表达 不同浓度的冬凌草甲素(0、16、32、64 μmol/L)处理HepG2 细胞48 h 后, 收集2×106/ml细胞,总蛋白的提取用赛百胜公司的 Protein Extraction solution,并且用Bradford方法定量蛋白质。上样前取 20 μg 等量蛋白质加上等体积 2×上样缓冲液,于 95℃变性10 min后进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳结束后,恒流260 mA,90 min 将蛋白质转到 PVDF 膜上,然后用含 5% BSA 的 TTBS 室温封闭 1 h,进行一抗孵育,将一抗按照推荐浓度溶于封闭液中,与对应膜共同封闭在塑料袋中, 4℃下过夜。一抗孵育结束后,用TBST(TBS+0.1% Tween20)漂洗膜4次,每次15 min。再使用对应的二抗孵育,按照相应比例稀释(1∶1 000),室温轻摇1 h,二抗孵育结束后,再用TBST漂洗膜4次,每次15 min。最后使用辣根过氧化物酶HRP-ECL发光显色法对膜进行显色曝光。
1.4流式细胞仪检测细胞周期改变 不同浓度(16、32、64 μmol/L)冬凌草甲素处理细胞24 h后收集细胞,冰PBS洗2次,用70%冰乙醇4℃固定1 h,冰PBS洗2次,用3 ml PBS重悬细胞加入RNA酶至终浓度为100 μg/L,37℃水浴30 min,加入PI至终浓度为50 μg/L,4℃避光30 min, 流式细胞仪上机,488 nm 波长激发检测细胞周期并分析。重复试验3次。
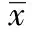
2 结 果
2.1Western印迹结果 不同浓度的冬凌草甲素处理HepG2 细胞48 h后,Western印迹结果表明,随着浓度的增加,Phos-S1981ATM、anti-phosph-CHK2 (T68)、anti-phosph-CHK2(T68)、Phos-p53和γ-H2AX蛋白水平呈逐渐增加趋势(见图1)。

图1 Western 印迹结果
2.2流式细胞仪检测细胞周期结果 不同浓度的冬凌草甲素(0、 16、32、64 μmol/L)处理HepG2 细胞48 h后,G2/M 期细胞比例分别为16.03%、26.01%和46.95%,呈逐渐增多趋势,而G0/G1期细胞呈相对减少趋势。16、32和64 μmol/L 冬凌草甲素组G2/M 期细胞比例与对照组比较差异具有统计学意义(P<0.05) 。见表1。
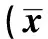
表1 不同浓度冬凌草甲素对HepG2 细胞周期的影响±s,%)
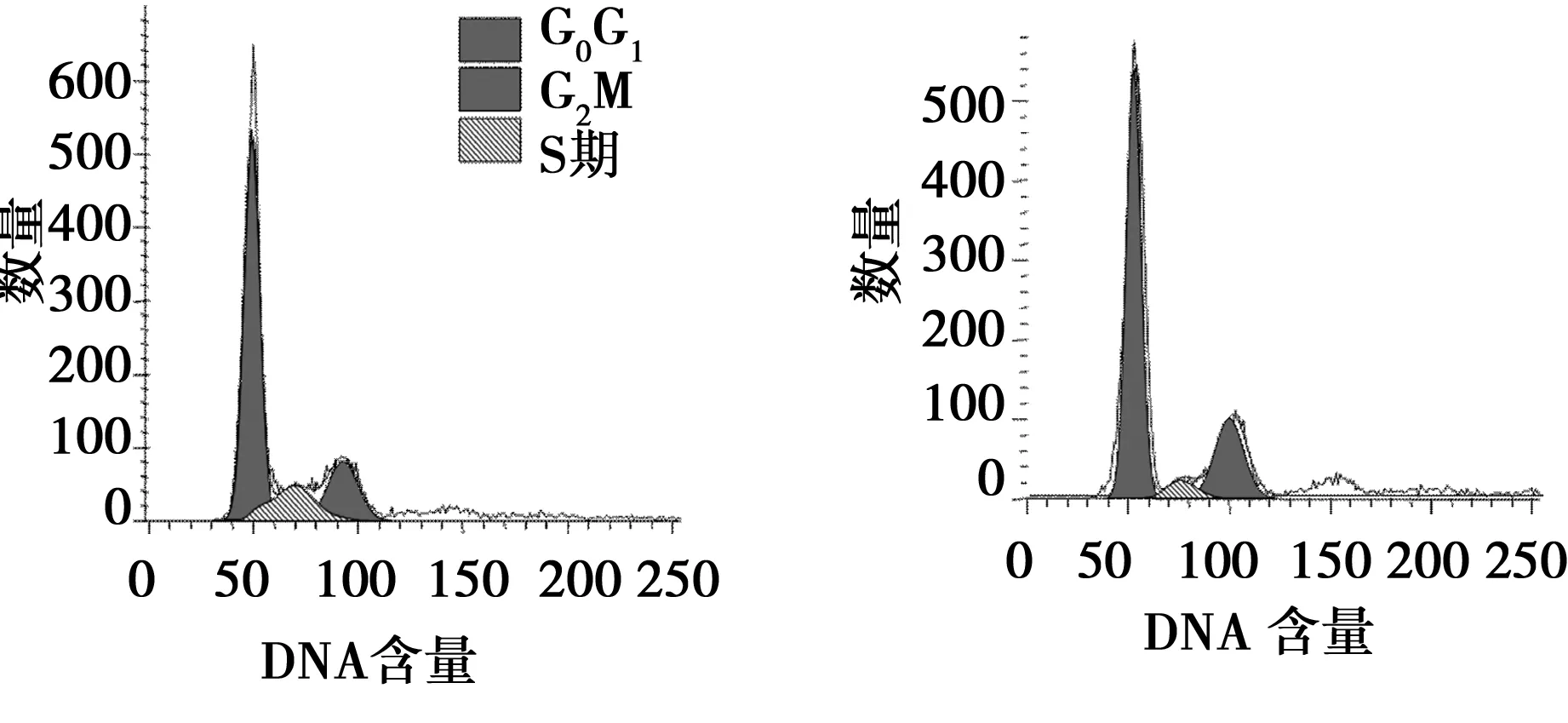

图2 细胞周期流式图
3 讨 论
与其他一些常见的恶性肿瘤相比,肝癌的治疗效果很差。外科手术仍然是最有可能为肝癌带来治愈希望的治疗手段。但是只有外科手术是不够的,综合治疗必不可少,寻找肝癌治疗的途径势在必行。我国对冬凌草及其有效成分的药理研究始于20 世纪70 年代后期。此后,主要集中在对冬凌草甲素抗肿瘤作用及其机制的研究上。既往多项体外试验表明,冬凌草甲素对多种人癌细胞株有生长抑制效应〔7,8〕。
细胞周期是细胞生命活动的基本过程,细胞的增生、分裂、变形、凋亡和坏死等生理或病理过程都发生在它所处的细胞周期的某一时相;若细胞周期的某一时相出现异常,细胞将进入与之相关的病理过程〔9〕。细胞周期受体内外多种因子、多层次调控,而细胞周期调控与肿瘤的发生、发展关系密切。几乎所有的肿瘤都有一个共同的特征: 细胞周期调控机制破坏,导致细胞失控性生长。G/M期DNA损伤检验点是细胞周期运行至有丝分裂前细胞自我修复的最后时机,本实验研究结果显示,冬凌草甲素使细胞阻滞于G2/M 期,通过有丝分裂扰乱细胞进程、抑制细胞生长。
细胞DNA在细胞周期运行过程中不断受到外源性和内源性因素的损伤。DNA损伤后激活细胞周期损伤检验点,启动修复机制,在进入有丝分裂之前修复损伤的DNA,确保转录基因组的完整性,如果修复失败或者损伤因素积累,损伤的基因会随着细胞分裂遗传给子代细胞,就可能导致无法控制的细胞增殖,最终导致癌变〔10〕。细胞周期中主要的细胞DNA损伤检验点是细胞进入有丝分裂前修复DNA损伤的最后时机〔11〕,共济失调-毛细血管扩张突变基因(ATM)和Rad-3相关蛋白(ATM and Rad-3 related,ATR)激酶可以感知DNA损伤,并将DNA损伤信号传导到下游靶蛋白,启动应激系统,产生细胞周期阻滞,从而完成DNA修复或启动细胞凋亡程序〔12~14〕,因此ATM和ATR对维持细胞基因组的稳定和防止肿瘤的发生至关重要。
本研究Western印迹结果表明,随着冬凌草甲素浓度的增加,Phos-S1981ATM、anti-phosph-CHK2 (T68)、anti-phosph-CHK2 (T68)、Phos- p53和γ-H2AX蛋白水平呈逐渐增加趋势。由以上结果可以分析,冬凌草甲素通过激活ATM蛋白细胞信号通路,引起G2/M期阻滞而为损伤DNA修复提供时间。细胞内激活各种检验点相关蛋白,触发检验点信号传导级联反应,激活由ATM R调节的网络系统,在相关调节蛋白作用下,感应蛋白将DNA损伤信号传递至信号传导蛋白,作用于相应的效应蛋白,通过“ATM-p53-CHK2”通路, 引起细胞周期G 期阻滞,最终导致细胞周期阻滞、细胞凋亡、DNA修复,损伤诱导的转录程序激活。
本研究结果表明冬凌草甲素能够通过激活ATM细胞信号通路、诱导人肝癌HepG2 细胞发生阻滞,发挥抑制HepG2细胞生长的作用,从而调整细胞增殖与凋亡间的平衡。本试验结果为研究冬凌草甲素抗肿瘤作用分子药理机制是否与分子靶标有关提供了一定的试验依据。
4 参考文献
1刘家云, 魏 敏, 顾琴龙. 冬凌草甲素抗肿瘤的研究进展 〔J〕. 中国新药与临床杂志, 2010;29(2): 81-4.
2Chen JH, Wang SB, Chen DY,etal. The inhibitory effect of oridonin on the growth of fifteen human cancer cell lines〔J〕. Chin J Clin Oncol, 2007;4(1): 403-6.
3刘加军, 李 桥, 潘祥林, 等. 冬凌草甲素对白血病NB4 细胞的诱导凋亡作用及其机制 〔J〕. 中草药, 2005;36(8): 1188-93.
4魏凤香,李美玉,李红枝,等.冬凌草甲素对肝癌HepG2 细胞凋亡的影响〔J〕.南方医科大学学报,2009;29(8):48-9.
5车宪平, 韩瑞发, 周 晶, 等. 冬凌草甲素注射剂诱导膀胱癌 MB49 细胞凋亡及机制研究 〔J〕. 中草药, 2008;29(8): 1219-22.
6张春玲, 吴立军, 左海军. 冬凌草甲素通过线粒体途径诱导人黑色素瘤A375-S2 细胞凋亡 〔J〕. 中草药, 2004;35(4 ): 423-6.
7Tian W, Chen SY. Recent advances in the molecular basis of anti-neoplastic mechanisms of oridonin〔J〕.Chin J Integr Med, 2013;19(4):315-20.
8Li D, Xu S, Cai H,etal.Enmein-type diterpenoid analogs from natural kaurene-type oridonin: Synthesis and their antitumor biological evaluation〔J〕.Eur J Med Chem,2013;64(12):215-21.
9Kikuchi K, Hettmer S, Aslam MI,etal. Cell-cycle dependent expression of a translocation-mediated fusion oncogene mediates checkpoint adaptation in rhabdomyosarcoma〔J〕. PLoS Genet,2014;10(1):e1004107.
10Kinner A,Wu W,Staudt C,etal. Gamma-H2AX in recognition and signaling of DNA double-strand breaks in the context of chromatin〔J〕.Nucleic Acids Res,2008;36(17): 5678-94.
11Stark GR,Taylor WR.Control of the GeM transition 〔J〕.Mol Biotechnol,2006;32(3):227-48.
12Lee JH, PaullTT.ATM activation byDNA double-strand breaks through the Mre11-Rad50-Nbs1 complex〔J〕.Science, 2005;308(4): 551-4.
13Falck J,Coates J, Jackson SP.Conservedmodes of recruitment of ATM,ATR and DNA-PKcs to sites of DNA damage〔M〕.Nature,2005;434: 605-61.
14Jazayeri A, Falck J,Lukas C,etal.ATM-and cell cycledependent regulation of ATR in response to DNA double strand breaks〔J〕.Nat Cell Biol,2006:8(1):37-45.
