肝癌MHCC97H细胞中CD133+和CD133-亚群分选及其生物学特性
2014-09-12易善永南克俊张丽娟姜丽丽
易善永 南克俊 张丽娟 柯 洋 姜丽丽
(郑州大学附属郑州中心医院肿瘤科,河南 郑州 450007)
近年来研究发现,肿瘤组织中含有极少量肿瘤干细胞(CSC),它在肿瘤发生、发展、复发及转移等过程中起决定性作用〔1~4〕。本研究旨在探讨肝癌MHCC97H细胞中CD133+和CD133-亚群分选及其生物学特性。
1 材料与方法
1.1主要材料与试剂 MHCC97H细胞株购于上海中科院细胞库;Balb/C裸鼠购于中国科学院上海实验动物中心。RPMI-1640 培养基(Sigma公司),胎牛血清(杭州四季青生物工程材料有限公司)。鼠抗人CD133抗体、兔抗人Bmi抗体、鼠抗人SMO抗体、兔抗人Notch-1抗体、鼠抗人β-catenin抗体、鼠抗人Oct3/4抗体(R&D公司)。鼠抗人PE-CD133、CD133免疫磁珠细胞分选系统(Miltenyi公司),流式细胞仪(BD公司)。
1.2免疫磁珠法分选细胞 取呈对数生长期的人肝癌MHCC97H细胞株数瓶,胰酶消化,用0.4%台盼兰染色、计数,使细胞总量保持在1×108数量级。取上述准备好的MHCC97H细胞,按100 μl/108的比例加入FcR阻断试剂;5 min后按100 μl/108的比例加入交联CD133抗体的微磁珠标记MHCC97H细胞。充分混匀后在4~8℃冰箱内孵育25 min。然后加入缓冲液进行离心,弃上清,制成细胞悬液;过MACS分离柱分选MHCC97H细胞,并分别收集CD133+和CD133-细胞。
1.3流式细胞仪检测分选前后CD133的表达 分别取培养的对数生长期的MHCC97H细胞和分选后的CD133+细胞,并制备成单细胞悬液。分别加入PE-CD133抗体,并在暗处室温下孵育30 min。并洗去未结合的抗体,上流式细胞仪检测,采集图像及数据分析。
1.5细胞体外增殖能力的比较 分别将上述各种细胞种植到96孔板中,每组细胞种10个孔,使每孔1×104个细胞,加入干细胞培养液放入培养箱中进行培养。在培养的第1、3、5、7天用MTT比色法测定各组细胞的增殖状态。以各组平均OD490 nm值为纵坐标,培养天数为横坐标,绘制细胞生长曲线。
1.6Western印迹法检测干细胞相关基因蛋白的表达 将准备好的细胞分别用胰酶进行消化处理,然后用PBS缓冲液洗涤两次,离心弃上清液。加入细胞裂解液进行裂解,离心收集上清蛋白。行凝胶电泳,至酚溴蓝染色接近胶底边后停止电泳。电泳后将凝胶中的蛋白质通过湿法电转移方法转移至PVDF膜上。将封闭转移后的PVDF,分别加入按适当比例稀释的一抗(兔抗人Bmi单克隆抗体、鼠抗人SMO单克隆抗体、兔抗人Notch-1单克隆抗体、鼠抗人Oct3/4单克隆抗体或鼠抗人β-catenin单克隆抗体);4℃过夜或37℃摇床2~3 h。去掉一抗,加入二抗。常规曝光、显影、定影和分析。采用Image J图像软件对目的蛋白条带的光密度值,以β-actin蛋白的光密度值进行标准校正,计算各目的蛋白与内参照的相对吸光度值作为其表达的相对含量。
1.7裸鼠皮下接种成瘤实验 取6只4~6周龄Balb/C裸鼠,并将其随机分为3组。分别按梯度将1×103、1×104及1×105个CD133+和CD133-细胞接种于9只裸鼠前肢两侧背部皮下。4 w后用颈椎脱臼法处死裸鼠,切下皮下移植瘤,测量其大小,并计算其体积。
1.8统计学方法 采用SPSS17.0软件进行t检验。
2 结 果
2.1MHCC97H分选前后CD133的表达 CD133在分选前的MHCC97H细胞株中呈低表达(1.09±0.43)%;CD133在分选后的CD133+细胞亚群中呈高表达(86.65±6.49)%。分选前后CD133的表达差异显著(P<0.01)。
2.2免疫组化法检测CD133在不同细胞中的表达 CD133在细胞胞膜和胞质中表达,呈棕黄色均匀染色。在未分选的MHCC97H细胞株中胞膜及胞质中偶见棕黄色颗粒,即CD133表达较弱;在分选后CD133+细胞亚群中胞膜及胞质中可以看到大量的棕黄色颗粒,即CD133表达较强;在分选后CD133-细胞亚群及阴性对照组中胞膜及胞质中未见棕黄色颗粒,即CD133不表达。经过检测,未分选MHCC97H细胞组的灰度值为186.37±21.23,分选后CD133+细胞组的灰度值为156.42±16.58,CD133在分选后表达升高(P<0.01)。见图1。
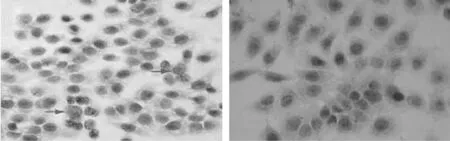
未分选 分选后CD133+
2.3细胞体外增殖能力的比较结果 CD133+细胞的OD 490 nm值要高于CD133-细胞和未分选MHCC97H细胞,差异具有统计学意义(P<0.05,P<0.01)。见表1。从三组细胞的生长曲线图可以看出,CD133+细胞组的曲线较陡直;未分选MHCC97H细胞组次之,生长曲线稍平缓;而CD133-细胞的生长曲线较为平坦。见表2。
表1 细胞体外增殖能力比较±s,n=30)
2.4不同细胞体内成瘤实验 将不同数量级的CD133+细胞与CD133-细胞分别各接种到3只裸鼠皮下。第3天时CD133+细胞组已有部分接种部位长出移植瘤,直到第4周CD133-细胞组才有1个接种部位有移植瘤形成。CD133+细胞组共有7个接种部位有移植瘤形成,而CD133-组只有1个接种部位有移植瘤形成。此外,CD133+细胞组形成的移植瘤体积、重量及数量均与CD133-细胞大。见表2。
2.5Western印迹法检测结果 Bmi、SMO、Notch-1、Oct3/4和β-catenin蛋白在CD133+细胞中表达较强,而在CD133-细胞中则表达较弱(图2)。分别将Bmi,SMO,Notch-1,Oct3/4和β-catenin蛋白条带光密度与其相应的β-actin的光密度进行比,然后再将其比值分别进行比较,CD133+细胞与CD133-细胞之间的差异有统计学意义。见表3。
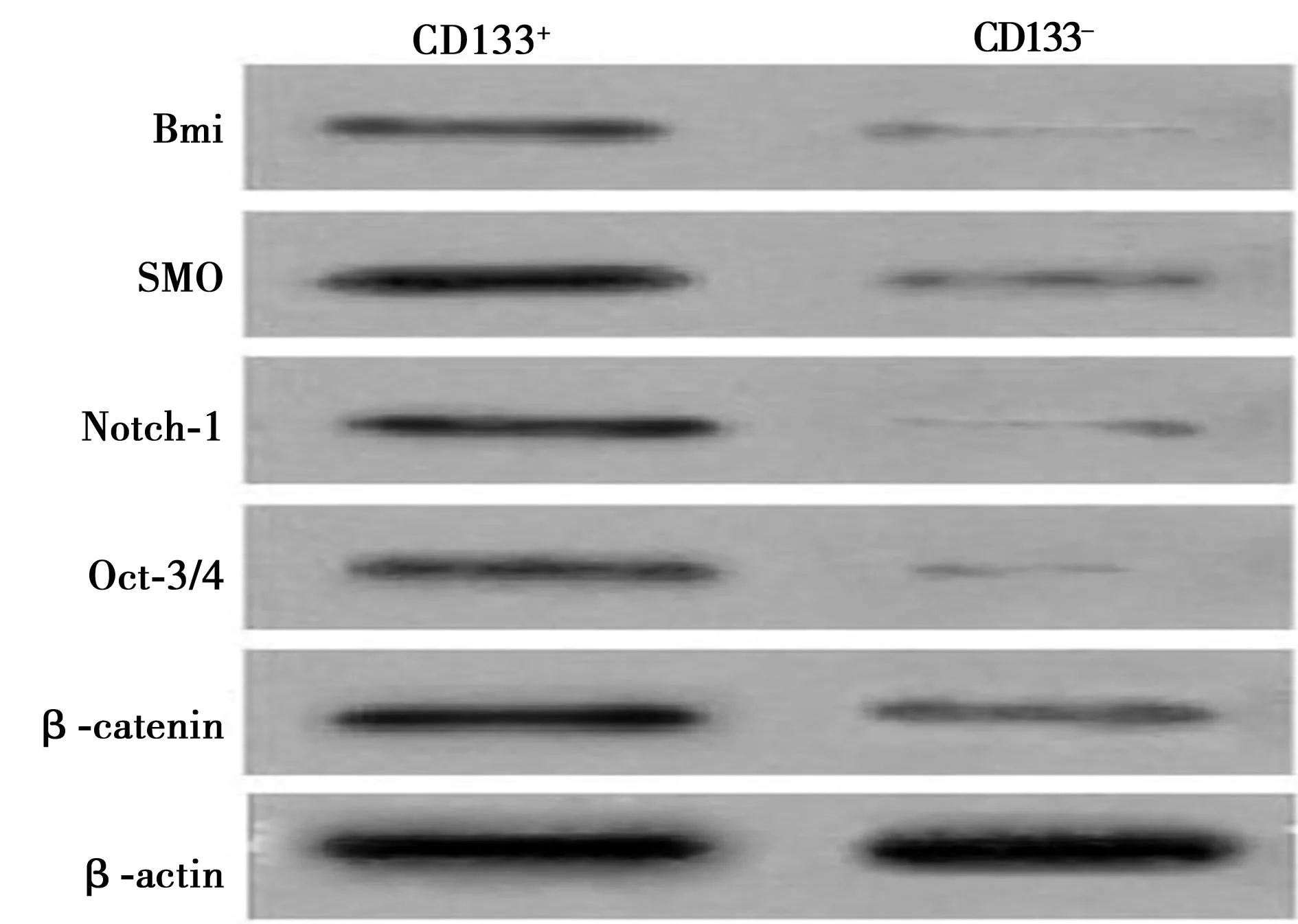
图2 Western印迹检测不同细胞的干细胞相关基因蛋白表达

表2 CD133+和CD133-细胞成瘤的数量及大小
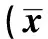
表3 不同细胞的干细胞相关基因蛋白表达±s,n=30)
3 讨 论
近年来研究表明,肿瘤是由一小部分具有无限增殖、自我更新和多向分化潜能的肿瘤干细胞驱动下发生的。它不仅是肿瘤发生、发展的关键,而且还是肿瘤复发和转移的源泉〔1~5〕。随着对肿瘤认识观念的改变,对肿瘤的治疗也必须从一个新的视角去把握。转变过去针对大部分增殖能力有限的肿瘤细胞进行治疗的模式,针对肿瘤干细胞治疗消灭肿瘤发生、发展、转移及复发的根源,进而有可能治愈肿瘤〔6~8〕。
本研究中采用MACS技术对MHCC97H细胞株中CD133+细胞亚群进行分离,然后再用流式细胞仪检测分离纯度及分选效果〔2〕。本研究结果提示MACS是一个非常理想的分离纯化肝癌干细胞样细胞的方法。本实验细胞免疫组化检测结果显示,与FACS定量分析结果基本吻合。在MHCC97H细胞株中只有(1.09±0.43)%的细胞恒定表达膜抗原CD133,这说明CD133+细胞只是人肝癌细胞株MHCC97H中含量非常少的一个亚群。
本实验细胞生长曲线结果,提示CD133+细胞亚群具有较强的体外增殖能力,符合其作为肿瘤干细胞的生物学特性。
目前还不能从形态学上对肿瘤干细胞做出明确鉴定,只有从功能学方面对其进行鉴定〔2~4〕。虽然体外培养可一定程度上反映肿瘤干细胞的生物学特性,但最终还需要通过体内成瘤实验来进一步证实其致瘤性。体内成瘤实验是将分离纯化的特定细胞亚群接种到裸鼠内,通过观察接种后是否可形成移植瘤、移植瘤体积大小以及移植瘤形成所需要的时间等来综合判断其致瘤能力〔7~9〕。本研究结果表明:CD133+细胞亚群的体内成瘤能力远远大于CD133-细胞亚群,这也表明CD133+细胞具有肿瘤干细胞的生物学特性。随后将移植瘤切除,制成病理切片,进行常规HE染色。病理观察可见,移植瘤与人原发肝癌在病理形态上非常相似。这些结果表明CD133+细胞亚群在裸鼠体内增殖分化产生了移植瘤内其他细胞,也证实了它具有较强的增殖分化潜能。因此,本研究认为CD133是人肝癌细胞株MHCC97H的肿瘤干细胞标志之一。
近年来研究表明,肿瘤干细胞和正常干细胞具有很多相似的生物学特性,这可能与它们具有某些相同的干细胞自我更新、增殖和分化调控基因有关〔7〕。本研究Western印迹检测结果提示CD133+细胞亚群高表达这些与干细胞/前体细胞增殖、自我更新以及决定其特性密切相关的基因,进而证实CD133+细胞具有干细胞特性。
综上所述,本研究证实肝癌MHCC97H细胞中存在CD133+细胞亚群,其增殖、多向分和成瘤性均高于CD133-细胞亚群,并且高表达干细胞相关基因,如:Bmi,Hedgehog/SMO,Notch-1,Oct3/4,Wnt/β-catenin等。因此,本研究认为CD133+细胞可能富集了肿瘤干细胞,从而为肝癌今后的治疗提供一种新方法和新思路。
4 参考文献
1Sell S,Leffert HL.Liver cancer stem cells〔J〕.J Clin Oncol,2008;26(17):2800-5.
2Yi SY,Nan KJ.Tumor-initiating stem cells in liver cancer〔J〕.Cancer Biol Ther,2008;7(3):325-30.
3O'brien CA,Pollett A,Gallinger S,etal.A human colon cancer cell capable of initiating tumor growth in immunodeficient mice〔J〕.Nature,2007;445(7123):106-10.
4Dean M.ABC transporters,drug resistance,and cancer stem cells〔J〕.J Mammary Gland Biol Neoplasia,2009;14(1):3-9.
5Winquist RJ,Boucher DM,Wood M,etal.Targeting cancer stem cells for more effective therapies:taking out cancer's locomotive engine〔J〕.Biochem Pharmacol,2009;78(4):326-34.
6易善永,南克俊,陈 静,等.吉西他滨常规化疗对肝癌干细胞样细胞的影响〔J〕.中华肿瘤防治杂志,2010;17(16):1270-2.
7Nicolis SK.Cancer stem cells and "stemness" genes in neuro-oncology〔J〕.Neurobiol Dis,2007;25(2):217-29.
8Chumsri S,Phatak P,Edelman MJ,etal.Cancer stem cells and individualized therapy〔J〕.Cancer Genomics Proteomics,2007;4(3):165-74.
9Gupta R,Vyas P,Enver T.Molecular targeting of cancer stem cells〔J〕.Cell Stem Cell,2009;5(2):125-6.
