成人脂肪干细胞分离培养与鉴定
2014-09-12王玲玲
韩 旭 王玲玲
(北华大学附属医院肛肠外科,吉林 吉林 132001)
抵抗素于2001年在小鼠脂肪细胞内首次发现〔1〕。人们一度认为白色脂肪组织是抵抗素的主要来源〔2,3〕,但有研究认为抵抗素主要有外周血单核细胞/巨噬细胞表达和分泌;有些研究认为在脂肪组织中,脂肪前体细胞表达抵抗素高于成熟的脂肪细胞,但也有研究得出相反结论〔4〕,还有研究表示抵抗素表达随脂肪干细胞(ADSCs)分化不断增加,在细胞分化成熟时达到高峰,之后稳定表达。本实验在体外分离、培养、鉴定成人ADSCs,进一步研究抵抗素与ADSCs的关系。
1 材料与方法
1.1材料 标准胎牛血清(FCS)、Ⅰ型胶原酶、胰蛋白酶购自HYCOLON公司;油红O染料、DMEM-F12培养基购自北京百泰克公司;鼠抗人CD34、CD44、CD106单克隆抗体购自上海江莱生物科技;鼠抗人CD29单克隆抗体购自友华医疗;辣根过氧化物酶标记山羊抗小鼠购自中国碧云天生物技术公司;其他试剂均由北华大学附属医院脑血管病研究所提供。
1.2方法
1.2.1成人皮下脂肪组织ADSCs的分离及培养〔5〕无菌条件下取健康成年人皮下脂肪约5 g,经组织冲洗液(Hank’s液加150 μg/ml庆大霉素和1 μg/ml两性霉素)冲洗,培养皿中剔除结缔组织和小血管,眼科剪剪成细小组织碎片,磷酸盐缓冲液(PBS)反复冲洗3次除去红细胞。0.1%Ⅰ型胶原酶与胰蛋白酶按1∶1配制成组织消化液,按组织3倍体积加入进行消化,37℃恒温摇床中振荡(190 r/min)消化30 min。组织悬液经200目筛网进行机械分离,得细胞悬液经1 000 r/min离心5 min,弃上清。所得细胞沉淀经PBS反复冲洗;离心3次,最终所得细胞沉淀以含20%FCS的DMEM-F12培养基进行培养,待观察到贴壁细胞后首次换液。
1.2.2噻唑蓝(MTT)生长曲线测定 细胞传至3代制备单细胞悬液,按1×104/ml比例200 μl/孔接种于96孔板,设5复孔。共接种9块96孔板,实验第2天开始选择每天某一固定时间取出1块,加入MTT溶液20 μl/孔,培养箱中培养4 h后,弃上清;加入150 μl/孔DMSO,震荡10 min,在酶联免疫分析仪上490 nm波长测定吸光度值,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.2.3免疫细胞化学染色 取第3代细胞进行爬片,以细胞密度 2.0×104ml/L接种于24孔板中 ,加入500 μl/孔DMEM 培养基,置于37℃、5%CO2培养箱内培养,待细胞 60%~70%融合后进行免疫细胞化学染色。取4孔细胞,弃去上清后用PBS冲洗3次。4%多聚甲醛固定10 min,PBS冲洗3次,加封闭液室温孵育30 min,弃封闭液。分别向4孔内滴入一抗 CD29、CD44、CD34 及CD106 单克隆抗体 300 μl(1∶100),4℃孵育过夜(14~16 h)。次日弃一抗,PBS冲洗3次,每孔加入辣根过氧化物酶标记山羊抗小鼠二抗300 μl(1∶200),室温避光孵育2 h,弃二抗,PBS冲洗3次,15 min/次,甘油封片,在倒置显微镜下观察并拍照。成脂诱导和鉴定〔6〕,取第3代细胞经胰蛋白酶消化按1×104/孔接种于24孔板(分组:诱导组和非诱导组),待细胞融合达80%时,诱导组进行成脂诱导(诱导液成分:10%FCS的高糖DMEM、0.5 mmol/L 3-异丁基-1-甲基黄嘌呤、1 μmol/L地塞米松、10 μmol/L胰岛素、200 μmol/L吲哚美辛)。非诱导组以常规高糖DMEM培养液进行细胞培养。诱导14 d后进行油红O染色鉴定。油红O染色:培养细胞弃培养液,PBS冲洗后4%多聚甲醛固定1 h,加60%异丙醇冲洗,油红O工作液(油红O染料经异丙醇溶解后过滤,取6 ml,加蒸馏水4 ml,混合后静置10 min,即可使用)染色20 min,60%异丙醇洗去多余染料,蒸馏水冲洗,甘油封固,显微镜下观察。
2 结 果
2.1成人皮下脂肪组织ADSCs原代提取及培养 原代提取单细胞,细胞呈现圆形或椭圆形。待细胞培养24~48 h后可见部分细胞贴壁,细胞换液后可去除红细胞。待细胞传到3代时进行染色,经显微镜观察可见贴壁细胞呈长梭形,偶见鱼群样分布。见图1。

A:原代提取单细胞;B:细胞培养24~48 h;C:细胞传第3代染色
2.2MTT生长曲线测定结果 细胞生长曲线呈S型分布,细胞经过1~2 d生长停滞期至第3天进入迅速生长期,第5~6天达到细胞增殖顶峰,第8天开始进入平台期,与以往研究结果相一致。见图2。
2.3免疫细胞化学细胞表面标记物的检测 培养第3代细胞进行免疫细胞化学实验,细胞表面抗原CD29及CD44呈现阳性表达,CD34及CD106呈现阴性表达,说明实验所得细胞是ADSCs。见图3。
2.4成脂诱导和鉴定 第3代细胞进行脂肪细胞诱导,细胞经诱导液诱导14 d后进行油红O染色,染色结果显示诱导组细胞可见细胞内有红色大小不等的脂滴形成,细胞形态由长梭形向椭圆形转化。未诱导组细胞无此现象出现。结果证明该细胞具有体外转分化能力,符合间充质干细胞特点。见图4。
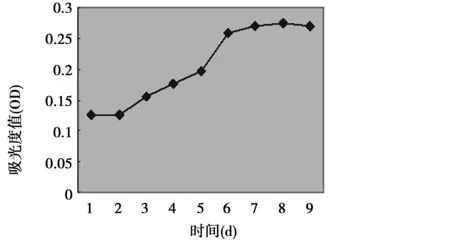
图2 细胞生长曲线
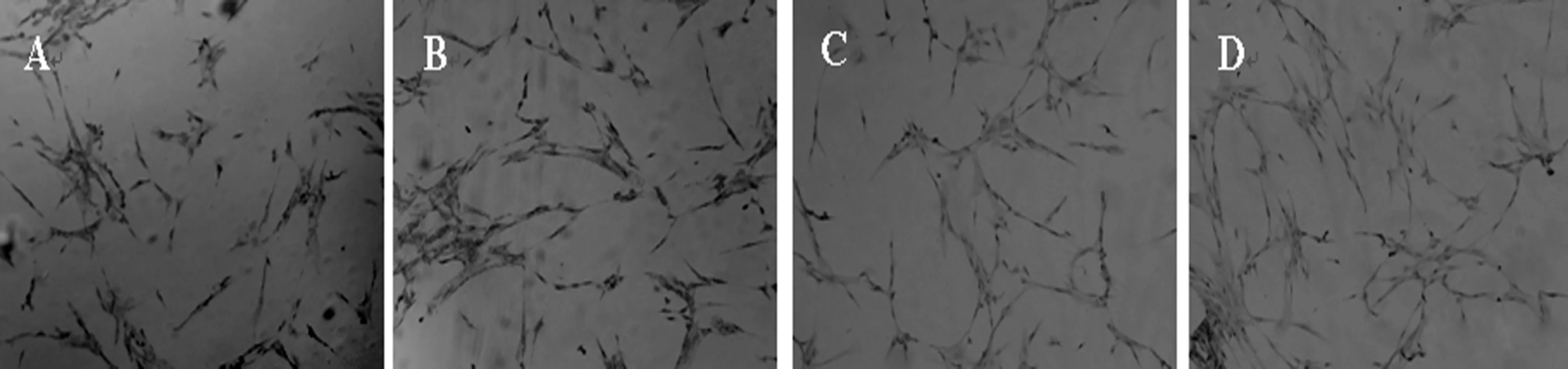
A:细胞表面抗原CD29检测结果;B:细胞表面抗原CD44检测结果;C:细胞表面抗原CD34检测结果;D:细胞表面抗原CD106检测结果
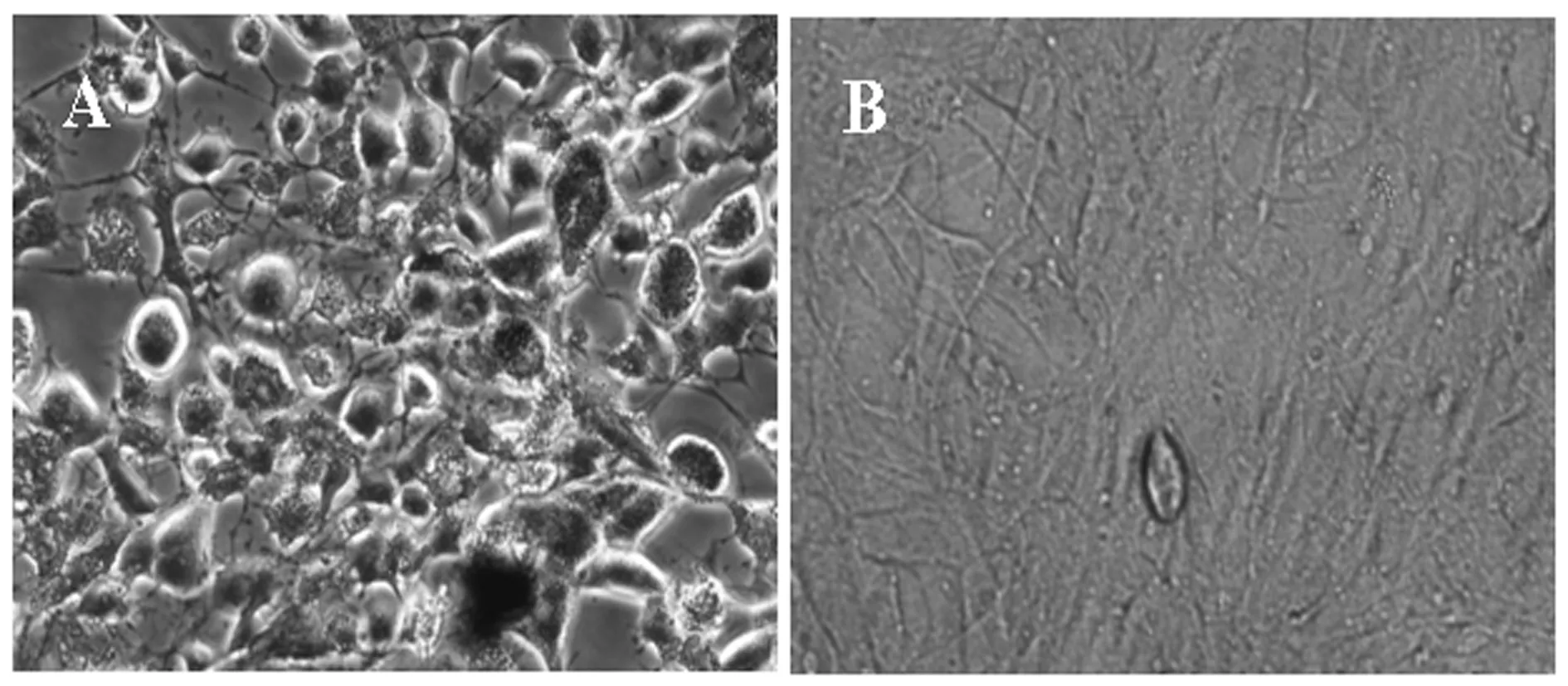
诱导组细胞 非诱导组细胞
3 讨 论
ADSCs是近年来从脂肪组织中分离得到的一种具有多向分化潜能的干细胞〔7〕。孙庆章〔8〕从吸脂术抽取的脂肪组织悬液中最先分离培养出多向分化潜能的干细胞。研究发现,ADSCs 能够在体外稳定增殖且衰亡率低,同时它具有取材容易,少量组织即可获取大量干细胞,适宜大规模培养,对机体损伤小等优点,而且其来源广泛,体内储备量大,适宜自体移植,逐渐成为近年来新的研究热点之一〔9~12〕。
本研究经患者同意,采用Ⅰ型胶原酶联合胰蛋白酶消化法〔13,14〕从成人皮下脂肪组织中成功分离出人ADSCs,免疫细胞化学结果提示,细胞不表达造血细胞表面抗原如造血前体细胞标志抗原CD34,而表达干细胞特异性的抗原CD44,并且表达CD29而不表达CD106。成脂诱导实验证明,所得细胞有多向分化的能力。上述各项指标表明本实验中所提取的细胞为 ADSCs,为后续实验打下了基础。
4 参考文献
1Antuna-Puente B,Fevec B,Fellahi S,etal. The missing link between insulin resistance and obesity〔J〕.Diabet Metab,2008;34:2-11.
2Osawa H,Yamada K,Onuma H,etal. The G/G genotype of a resistin single-nucleotide polymorphism at 5420 increases type 2 diabetes mellitus susceptibility by inducing promoter activity through specific binding of sp1/3〔J〕.Am J Hum Genet,2004;75:678-86.
3Haluzíková DL,Bosaská H,Papezová H,etal. Adiponectin and resistin gene polymorphisms in patients with anorexia nervosa and obesity and its influence on metabolic phenotype〔J〕.Physiol Res,2008;57: 539-46.
4Shibata R,Skurk C,Ouchi N,etal. Adiponectin promotes endothelial progenitor cell number and function〔J〕.FEBS Lett,2008;582(11):1607-12.
5杨旭芳,何 旭,张丽红,等.人脂肪干细胞向内皮细胞的定向分化〔J〕.中华整形外科杂志,2011;27(1):58-62.
6相新新,赵 晶,李 茵,等.脂肪干细胞定向分化的影响因素〔J〕.生理科学进展,2010;41(5):341-6.
7田 霖,孙筱放,刘海波,等.人脂肪干细胞的分离培养与生物学特性〔J〕.中国组织工程研究,2012;(32):5946-52.
8孙庆章.人脂肪干细胞的分离培养及鉴定〔J〕.中国社区医师(医学专业),2011;13(8):6.
9范开防,王国栋,刘兴龙,等.人上睑眶隔脂肪来源的脂肪干细胞的分离培养及鉴定〔J〕.现代医药卫生,2012;28(19):2881-5.
10林立新,黄 勇,王玉婷,等.不同部位脂肪源性干细胞的生物学特性比较〔J〕.中国组织工程研究,2013;7(27):4992-7.
11沙德潜,陈 伟.人脂肪干细胞分离培养鉴定及多向分化潜能的实验研究〔J〕.中国急救复苏与灾害医学杂志,2011;6(3):202-22.
12彭 智,陈 崎,贾振华,等.组织块培养法扩增人脂肪源性干细胞的生物学特征鉴定〔J〕.中国组织工程研究与临床康复,2010;14(36):6689-94.
13纪伟宁,杨毅宁,马依彤,等.脂肪干细胞的分离培养及成心肌诱导〔J〕.新疆医科大学学报,2011;34(6):555-7.
14黄海华.组织块培养法体外诱导人脂肪干细胞向神经样细胞转化的实验研究〔D〕.广州:广东医学院硕士论文,2011.
