多层螺旋CT对肝细胞癌合并肝动脉门静脉分流的诊断价值
2014-09-12刘汉菊
刘汉菊
(吉化集团公司总医院 北华大学第二附属医院MRI科,吉林 吉林 132002)
肝动静脉分流(APS)是在CT增强时表现为肝动脉期出现不同程度的门静脉显影和(或)肝实质内出现楔形、不规则形一过性强化,于门静脉期恢复正常或呈稍高、低密度影,无占位效应。以原发性肝癌(HCC)致APS形成者居多,正确认识HCC合并APS对识别肿瘤征象、指导介入治疗、判断病人预后等方面具有重要意义。本文对22例HCC合并APS病例进行回顾性分析,旨在探讨MSCT对HCC合并APS的诊断价值。
1 材料与方法
1.1一般资料 以2012年1月至2013年5月在本院同时进行16层多层螺旋CT(MSCT)和数字减影血管照影(DSA)检查的HCC患者105例。DSA检查是在进行HCC介入栓塞中完成的,两种检查前后时间间隔在2 w之内。HCC的诊断,经活检病理诊断24例,余81例根据特征性影像学(MSCT、MR、彩超)及血清甲胎蛋白(AFP)等临床指标综合诊断。其中男73例,女32例,年龄27~81〔平均(56±6.3)〕岁。
1.2研究方法和技术 MSCT检查采用SIEMENS Sensation 16层MSCT机描。扫描参数:120 kV,66 mAs,准直器Coll.16x0.75 mm,扫描范围为自膈顶至肝下缘,使用高压注射器以3.0 ml/s的流速注入总量约80~100 ml(1.5~2.0 ml/kg)的碘帕醇(300 mgI/ml),先行肝脏平扫,在行双期动态扫描,采集到的原始数据行层厚1 mm,层间隔0.75 mm重建并传到Wizard工作站,后处理技术使用3D、Vessleview技术。DSA检查采用TOSHIBA公司数字化血管造影机,以Seldinger技术经右股动脉穿刺插管,以4~5 ml/s的流率经导管注入碘帕醇(300 mgI/ml)20 ml,记录肝动脉期和实质期图像。
1.3APS的诊断标准
1.3.1APS的MSCT诊断标准〔1〕和分型标准〔2〕(1)门静脉主干和(或)一级分支提早显影,或显影密度大于肠系膜上动脉(SMV)/脾动脉(SV)者属于中央型,位于肝门区,部分病例可见线条征或轨道征;(2)门静脉二级及以下分支提早显影,或显影密度大于上一级分支者属于周围型-Ⅰ型,显影不超过1个肝叶;(3)一过性肝实质强化(THPE),即肝动脉期肿瘤周围非癌变区呈楔形、片状强化,少数呈不规则或结节影,门静脉期该区域显示为等密度或略高密度,它属于周围型-Ⅱ型,多位于肝边缘或肿瘤周围,尖端指向肝门,显影不超过一个肝段。
1.3.2APS的DSA诊断标准 (1)门静脉主干和(或)一级分支提早显影,肿瘤染色出现于门静脉显影以后,肝门附近可见不规则排列迂曲的网状血管影。(2)门静脉二级及以下分支提早显影,门静脉分支有时与肝动脉分支伴行呈“双轨征”,在肝动脉内注入碘油时,肿块边缘出现小草样门脉分支显影,即“病灶碘油门脉显影征”。
1.4影像学评价及统计学处理 由从事影像诊断的2名主治医师采用单盲法对CT轴位、CTA和DSA图像进行分析、评价;以DSA为标准,对比分析CT横轴位和CT横轴位基础上的CTA对APS的诊断能力,计算CT横轴位和CT横轴位基础上的CTA诊断APS的敏感度、特异度和准确度。
2 结 果
2.1APS的MSCT表现及分型 共发现22例HCC合并APS病例。根据APS的表现形式及部位,把APS分为3种类型。4例为中央型,它位于肝门区,表现为门静脉主干和(或)一级分支提早显影,或显影密度大于SMV/SV。其中3例伴有门静脉癌栓,门静脉管壁明显增粗,强化呈“轨道征”,滋养动脉增粗、迂曲呈“线条征”〔3〕;7例为周围型-Ⅰ型,它位于肝实质中间部分但未靠近肝边缘,表现为门静脉二级及以下分支提早显影,或显影密度大于上一级分支。其中4例合并门静脉癌栓,3例显示为门静脉的充盈缺损,1例显示门静脉管壁呈“轨道征”,滋养动脉呈“线条征”;11例为周围型-Ⅱ型,多位于肝周缘或肿瘤周围,尖端指向肝门区,表现为THPE,在该组病例中,未发现合并门静脉癌栓,但病例发现1例合并门静脉癌栓。见图1。
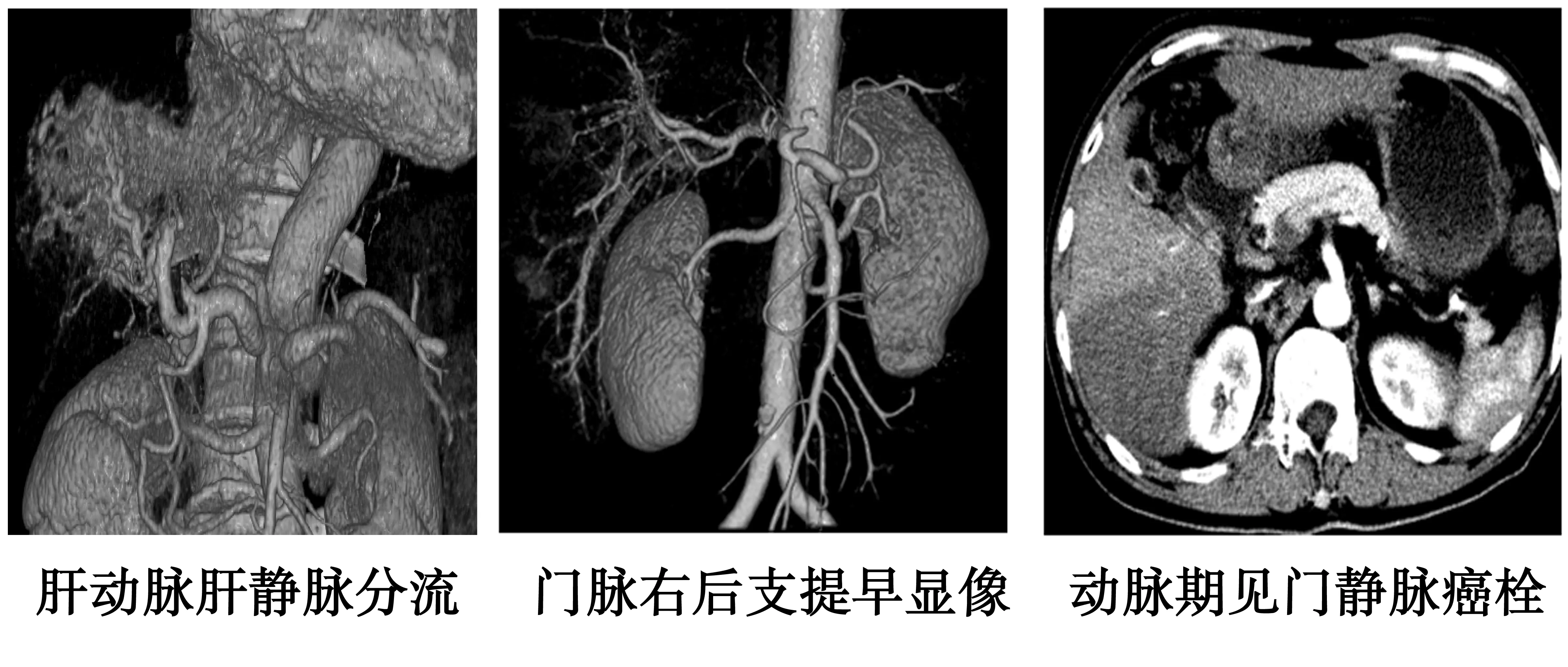
图1 Aps的MSCT的影像学表现
2.2MSCT对APS的诊断能力 DSA证实中央型APS 4例,均在CT轴位和此基础上的CTA发现相关的阳性征象。CT轴位上发现2例假阳性患者,表现为肝门区门静脉管壁的“轨道征”及滋养动脉增粗迂曲呈“线条征”,系由于合并门静脉癌栓,在CTA上可完全排除;DSA证实周围型-I型7例,在CT轴位和此基础上的CTA均能发现阳性征象,亦无假阴性,CT轴位上发现1例假阳性患者,可能由于巨块压迫门静脉分支,而供应受压该区域的肝动脉出现高灌注现象的缘故,CTA可以完全排除;DSA证实周围型-Ⅱ型11例,假阴性2例,CT轴位和CTA上均不能排除,可能分流量小有关,CT轴位发现假阳性6例,表现为肝动脉期肿瘤边缘非癌变区肝实质出现THPE,通过CTA排除4例。CT轴位诊断APS的敏感度为90.9%(20/22),特异度为89%(76/85),准确度为93.3%(98/105);CT轴位基础上的CTA诊断APS的敏感度为90.9%(20/22),特异度为97.6%(83/85),准确度为96.2%(101/105)。在轴位诊断的基础上结合CTA可明显提高APS的准确性和特异性。见表1、表2。
3 讨 论
APS的形成既有解剖因素又有多种病理因素,是二者相互作用的结果。正常情况下肝脏的血液有肝动脉和门静脉双重血供,肝脏重量占体重的2.5%,却接受了25%的心输出量,所以这套血管系统具有高血容量和低灌注压的特点。肝脏微循环单位从门脉终支及肝动脉终支开始,经过肝窦到肝静脉终支的这段微血管构成,离门脉终支近的肝窦较狭细、迂曲,吻合支多,形成网状,离门脉终支远的肝窦形成平行的血管,终止于中央静脉。肝动脉终支的血液仅有一小部分直接进入肝血窦,大部分经过各种通路流经门静脉终支后再进入肝血窦,因此肝动脉和门静脉之间存在着多条潜在的吻合支〔4,5〕。生理情况下吻合支是不开放的,任何病理原因导致它们之间的压力梯度逆转,都会引起APS。可能有以下原因:(1)肝静脉受累(概率较门静脉低〔6,7〕),当肿块挤压或压迫肝静脉时,肝动脉、门静脉血流回流受阻致肝窦压力增高,当压力超过所属门静脉分支时门静脉成为引流静脉,就形成肝窦性APS;门静脉受累比较多见,当HCC压迫或挤压门静脉时,肝脏双重血供比例发生变化,为维持受累肝区供血量的稳定,肝动脉血流代偿性增加,又因为动脉血较少受到含对比剂的门静脉血流的冲击,造成肝窦性APS,表现为肝动脉期肿瘤边缘非癌变区呈楔形、片状模糊强化区,少数病例呈不规则或结节影;两种情况肝动脉期表现基本相同,而门静脉期,肝静脉阻塞时由于所属门静脉成为引流静脉,而表现为所属区域为低灌注而呈低密度影,有时可见阻塞的肝静脉呈低密度树枝状血管影,而门静脉阻塞时肝实质密度呈等密度影或稍高密度影。(2)当门脉较大分支受压或侵犯门静脉分支形成癌栓时,门静脉血流障碍,肝动脉血流可通过肝脏中央部分较大胆管周围的血管丛、肝血窦和血管(门脉管壁的营养血管)等途径,作为顺肝方向的侧支循环开放、增生,代偿受阻的门静脉血流,在门静脉主干尚未强化之前,该区域可见强化的门静脉血流而形成血管丛性APS。(3)当HCC直接侵犯、破坏门静脉,在其内形成癌栓或沿着血管壁生长时,癌栓被门静脉管壁的APS即滋养血管网血管化并不断生长,增粗扩张的滋养动脉成为其主要的供血动脉〔8〕,并直接引流入门静脉,形成血管性APS。这种APS量大,表现为动脉期门静脉主干和(或)以下分支提早显影。本研究提示APS的发生是癌灶播散、转移的另一重要途径。
传统上DSA是诊断APS的金标准,但作为一项有创的检查,且操作难度大、费用昂贵及又具有一定并发症,使患者不愿意接受限制了APS的检出。而MSCT的轴位成像及血管成像为临床医生提供了多方位、多角度及直观立体解剖图,其CTA成像可以与DSA相媲美。MSCT轴位双期扫描对发现APS具有较高的敏感性,与CT轴位基础上的CTA相一致。CT轴位和CT轴位基础上的CTA未发现的2例(假阴性)均为周围型-Ⅱ型APS,可能与APS分流量极小有关,而DSA显影的原因可能与肝动脉造影的压力及注射流率有关。CT轴位发现9例假阳性病例,结合CTA排除其中6例。该9例中,2例为中央型并门静脉癌栓所致。这是由于合并门静脉癌栓时,门静脉血流量减少,为维持正常的肝实质血供,而出现门静脉海绵状变性现象;1例为周围型-I型APS,可能是由于巨块压迫门静脉分支使该区域的肝实质血流减少,出现该区域的肝动脉血流代偿性高灌注现象,表现为肝动脉期相应区域高密度,而门静脉期为等或稍低密度,结合CTA可以排除。另外6例,表现为THPE,可能是由于肿瘤细胞在生长过程中分泌大量的血管生长因子(VEGF)刺激血管生成〔9〕,肿瘤血管往往不能形成成熟的血管床和完整的基底膜,因此通过血管壁调节血流量的功能差,HCC周围非癌变肝实质往往会通过血管调节功能获得血流量,CTA可排除4例。在CT轴位的基础上,结合CTA可明显提高APS诊断的特异性和准确性,分别达到97.6%,96.2%。
总之,HCC合并APS具有复杂性、多样性的特点,不同类型的APS均有特征性表现,根据CT轴位和CTA成像可以对中央型和周围型-Ⅰ型病例可做出准确判断,而对周围型-Ⅱ型,DSA显示仍有部分不足〔10〕,CTA成像可以弥补。对HCC合并APS行介入栓塞前进行MSCT检查,从不同角度观察肿瘤供血动脉、引流静脉的起源、走形、变异血管及迷走血管情况,是否合并APS进行全面评估,选择合适的栓塞材料及方式,给DSA插管超选提供合理的入路〔11,12〕。这样有针对性的插管,减少了寻找靶血管的难度,缩短寻找瘘口的时间,降低了患者与医护人员的射线吸收量,因此有很大的临床意义,但这并不降低DSA的诊断价值。另外CTA成像还可对合并门体侧支循环、门门侧支循环进行显示, 本文中有2例可见开放的食管胃底静脉和附脐静脉,可以对其采取相应的治疗措施提供“路标”。
4 参考文献
1罗明月,单 鸿,姜在波,等.多排CT对肝细胞癌动门脉分流诊断能力研究〔J〕.中华肿瘤杂志,2004;26(4):231-3.
2Quiroga S,Sebastia MC,Moreiras M,etal.Intrahepatic arterioportal shunt:helical CT findings〔J〕.Eur Radiol,1999;9(6):1126-30.
3肖文莲,罗光华,罗明贤,等.肝动脉-门静脉分流的多层螺旋CT诊断〔J〕.美国中华临床医学杂志,2005;7(2):87-90.
4李志群,张 丰,祝 扬,等.慢性乙型肝炎肝脏微循环障碍发生发展机制的研究〔J〕.实用肝脏病杂志,2010;13(2):104-6.
5Nagula S,Jain D,Groszmann RJ,etal.Histologhical-hemodynamic correlation in cirrhhosis-a histological classification of the severity of cirrhosis〔J〕.J Hepatol,2006;44(1):111-7.
6Tian JL,Zhang JS.Hepatic perfusion disorders:etiopathogenesis and related diseases〔J〕.World J Gastroenterol,2006;12(20):3265-70.
7Kim HJ,Kim AY,Kim TK,etal.Transient hepatic attenuation differences in focal hepatic lesions:dynamic CT features〔J〕.Am J Roentgenol,2005;184(1):83-90.
8罗明月,林云崖,胡 冰,等.肝细胞癌两种类型动静脉分流的多层CT表现在介入栓塞中的意义〔J〕.世界华人消化杂志,2005;13(6):755-9.
9李先浪, 先正元, 石荣书,等.原发性肝癌 DSA 表现特点与癌组织血管内皮细胞生长因子表达相关性研究〔J〕.介入放射学杂志,2010;19(5):377-81.
10Rahbari NN,Mehrabi A,Mollberg NM,etal.Hepatocellular carcinoma:current management and perspectives forthe future〔J〕.Ann Surg,2011;253(3):453-69.
11刘向东,卢春雨,李榕华.肝癌介入术中动静脉瘘的评判与处理〔J〕.介入放射学杂志,2009;18(12)934-6.
12Chan WS,Poon WL,Cho DH,etal.Transcatheter embolisation of intrahepatic arteriovenous shunts in patients with hepatocellular carcinoma〔J〕.Hong Kong Med J,2010;16(1):48-55.
