大鼠PAX2基因RNA干扰慢病毒载体的构建及沉默效果
2014-09-12吴玉斌
李 里 吴玉斌
(辽宁医学院儿科,辽宁 锦州 121001)
PAX2基因编码核转录因子,是肾脏胚胎发育过程中诱导肾小管上皮细胞转分化的关键性发育基因之一〔1〕,成熟肾单位其表达减少。近年来发现,PAX2在病理肾中出现胎儿期的回归表达,参与肾脏的损伤过程,其具体机制尚不明确。慢病毒载体是近年发展起来的一种新型病毒载体,其介导的RNA干扰(RNAi)相对质粒介导的RNAi而言,其感染的细胞种类更广,基因沉默的效果更好,转染效率更高,持续时间更长,因而被广泛用于基因表达调控、基因治疗等领域。本研究设计、构建和鉴定表达PAX2 siRNA 的慢病毒载体,为研究PAX2基因调控肾间质纤维化肾管坡细胞间充质细胞转化(EMT)机制及基因治疗奠定基础。
1 材料与方法
1.1材料 人胚肾293T细胞、大肠杆菌菌株DH5α,pGCSIL-GFP载体、pHelper1.0 载体、pHelper 2.0 载体小干扰序列和引物(上海吉凯基因技术有限公司);质粒抽提试剂盒和慢病毒包装试剂盒(均德国QIAGEN公司);转染试剂positive clone germ测序、DNA ladder Marker(美国 Invitrogen 公司);大鼠正常肾小管上皮细胞(NRK52E)(中国科学院上海生命科学研究院细胞所);琼脂糖和SDS(美国Sigma公司); 优质胎牛血清、DMEM培养基(美国Gibco公司);PAX2单克隆抗体(美国Santa Cruz公司);辣根过氧化物酶标记的二抗(中杉金桥公司)。
1.2方法
1.2.1RNA干扰PAX2慢病毒载体制备 根据靶序列筛选原则,采用本课题前期研究成果中的靶点序列GGAGCGAGTTCTCAGGCAA,据该序列设计一对互补的单链DNA(中间有loop环),两端为限制性内切酶AgeⅠ和EcoRⅠ酶切位点的粘性末端(表1)。AgeⅠ和EcoRⅠ双酶切pGCSIL-GFP载体使其线性化。把合成后成对的引物干粉溶解于退火缓冲液中,90 ℃水浴15 min,然后自然冷却至室温,形成带双链的DNA oligo。按如下体系连接至载体:线性化的载体DNA 1 μl,DNA oligo 1 μl,10×连接缓冲液 2 μl,T4连接酶1 μl,ddH2O补足至20 μl,混匀后16 ℃连接过夜,将连接产物转化E.coli感受态细胞, 经菌液PCR鉴定阳性克隆菌株送测序。

表1 PAX2-shRNA 的结构框架
1.2.2慢病毒包装、浓缩及滴度检测 提取慢病毒包装系统中质粒DNA,及两种辅助包装元件载体质粒。转染前24 h,调整293T细胞密度为1.2×107个/20 ml,接种于培养皿中。转染前2 h将细胞培养基更换为无血清培养基。将质粒DNA与(Opti-MEM)混合均匀,调整总体积为2.5 ml,室温下温育5 min;稀释后的质粒与稀释后的Lipofectamine 2000进行混合,室温下温育5 min;将混合液转移至293T细胞培养液中,转染后8 h更换为完全培养基,培养48 h后,收集富含慢病毒颗粒的细胞上清液。病毒浓缩纯化使用Centricon Plus-20离心超滤装置(USA),对其浓缩后得到高滴度的慢病毒浓缩液,分装后保存在病毒管中,-80℃长期保存。取其中一支使用逐孔稀释滴度测定法进行病毒生物学滴度测定,并计算病毒滴度。
1.2.3NRK52E的培养和慢病毒转染 NRK52E细胞在含10%胎牛血清,95% 湿度,5% CO2, RPMI-1640培养基中常规培养,37℃。转染前,常规消化收集细胞,将细胞接种于6孔板,待细胞生长至密度为50%~70%时,用慢病毒液感染NRK52E细胞,6~8 h后换液,感染48 h后于倒置荧光显微镜下观察细胞强化绿色荧光蛋白(GFP)表达情况。
1.2.4RT- PCR检测感染细胞PAX2基因的mRNA表达 取感染效率在 80%以上的靶细胞,TRIzol法提取细胞总RNA, 以未感染和感染空载体细胞为对照。 分光光度计测RNA浓度,取等量RNA逆转录为cDNA, 以cDNA 为模板用RT- PCR 法检测PAX2 mRNA表达量。PAX2及β-actin引物由Invitrogen公司设计合成,PAX2 F5′-CGGTGAGAAGAGGAAACGAG-3′,R5′-GCTTGGAAGACATCGGGATA-3′;片段长度246 bp;β-actin引物序列:F5′-GTG GGG CGC CCC AGG CAC CA-3;R5′-CTC CTT AAT GTC ACG CAC GAT TTC-3;片段长度498 bp。扩增条件为:94℃ 1 min,58 ℃ 50 s,72 ℃ 1.5 min,40个循环;最后72 ℃ 10 min。1.0%质量分数琼脂糖凝胶电泳,100 v,约20 min,电泳后0.5 mg/L,EB染色45 min,凝胶成像系统扫描每个目的条带的紫外光光密度。计算每个标本扩增的目的条带与相应β-actin条带的吸光度比值(R),代表该样本细胞目的基因的相对表达量。
1.2.5Western 印迹检测感染细胞PAX2蛋白的表达 取感染后的靶细胞及对照细胞,提取细胞总蛋白,离心沉淀后作超声破碎处理,并使蛋白变性;SDS-PAGE凝胶电泳样品;电泳结束后,使用转移电泳装置,在4℃,400 mA恒流条件下电转120 min,将蛋白转移到(PVDF)膜上;用封闭液〔含5%脱脂牛奶的(TBST)溶液〕室温封闭PVDF膜1 h或4℃过夜。用封闭液稀释的一抗抗体与封闭好的PVDF膜室温孵育2 h或4 ℃过夜;TBST洗膜3次,每次10 min;在室温下,用封闭液稀释的二抗与PVDF膜孵育2 h;TBST洗膜3次,每次10 min;采用Amersham公司ECL+plusTM,Western 印迹 system试剂盒进行显色;在暗房中进行获得显示条带的胶片。用GAPDH作内参照验证蛋白的含量。计算每个标本的目的条带与相应内参照基因β-actin条带的光密度比值(R),代表该样本细胞目的蛋白的相对表达量。

2 结 果
2.1鉴定与测序结果 阳性克隆的鉴定PAX2基因的寡核苷酸序列,经退火形成双链,与经AgeⅠ和 EcoR I双酶切后的pGCSIL-GFP载体,连接产物转化大肠杆菌感受态细胞DH5α,挑选重组阳性克隆进行鉴定和测序。PAX2基因干扰的重组细菌克隆产物362 bp(插入片段为56 bp)经双酶切后没有插入片段的pGCSIL-GFP载体产物306 bp为对照,鉴定结果和预期一致(图1)。测序结果表明,合成的PAX2-shRNA核苷酸序列插入正确,中间为产生针对靶基因的寡核苷酸(图2)。
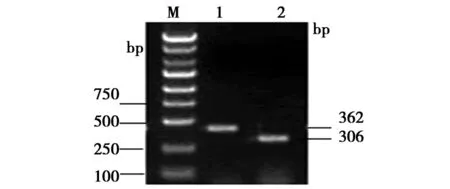
M:DL 2000 DNA marker;1:PAX2基因干扰的重组细菌克隆产物;2:经双酶切后没有插入片段的pGCSIL-GFP载体产物
2.2RNAi慢病毒大量包装 将重组慢病毒载体pGCSIL-GFP- PAX2、慢病毒包装质粒pHelper 1.0 载体、Helper 2.0载体共转染293T细胞48 h后的绿色荧光强度高,细胞生长良好,表明病毒包装成功(图 3)。病毒过滤浓缩后测定病毒滴度为2×108TU/ml,滴度高符合后续实验的要求。
2.3慢病毒转染NRK52E 细胞的效果 用慢病毒上清感染NRK52E细胞, 感染后48 h荧光显微镜观察GFP荧光情况,见细胞荧光明显,感染效率为81.2%(图 4)。
图2 PAX2-shRNA测序结果

图3 慢病毒包装后293T细胞荧光表达情况(×100)

图4 慢病毒感染NRK52E细胞后荧光表达情况(×200)

M:DL 2000 DNA marker ;1~3:β-actin;4:未转染组;5:空载组;6:慢病毒感染组
2.4慢病毒转染NRK52E 细胞后PAX2 mRNA和蛋白的表达 感染PAX2 shRNA慢病毒的细胞组与对照组及空载组相比较,PAX2基因的mRNA表达水平有明显下降,敲减率为46%(图5,表2)(P<0.05)。感染PAX2 shRNA慢病毒的细胞组与对照组及空载组相比较,PAX2蛋白表达水平有明显下降,敲减率为45%(图6,表2)(P<0.05)。

表2 慢病毒转染后对PAX2基因表达量的影响
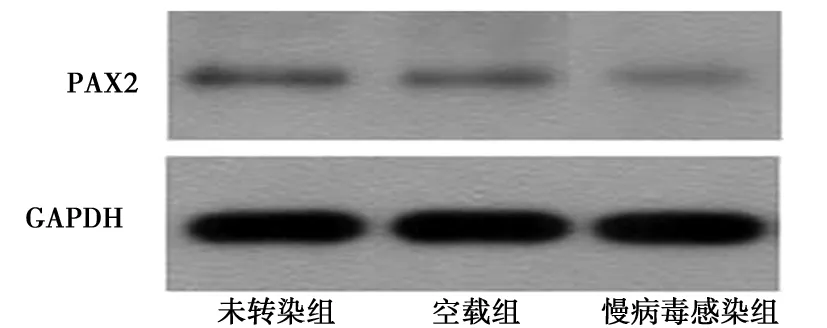
图6 慢病毒介导的PAX2 RNAi对NRK52E细胞PAX2蛋白表达的影响
3 讨 论
梗阻性肾病的发病率逐年升高,儿童梗阻性肾病占儿童终末期肾脏疾病的0.3%,占儿童肾移植的16.1%〔2〕。肾间质纤维化是梗阻性肾病最终的共同途径,是慢性肾衰竭的进行性发展过程中的始动因素。EMT它是肾间质纤维化的重要发病机制之一〔3,4〕。PAX2基因编码核转录因子,是肾脏胚胎发育过程中诱导肾小管上皮细胞转分化的关键性发育基因之一,在前、中、后肾发育的全过程中表达。Li等〔5〕研究表明:PAX2在梗阻性肾病大鼠模型肾脏中出现了回归表达,且参与调控EMT,但对其作用机制仍然不清楚。
RNAi现象是指内源性或外源性双链 RNA(dsRNA)介导细胞内的mRNA发生特异性降解,导致靶基因的表达沉默,产生相应的功能表型缺失,属于转录后的基因沉默机制。随着对RNA:现象机制的深入研究,RNAi已经成为一种功能基因组研究的有效工具,在基因治疗中的潜在应用价值正引起临床的广泛关注〔6〕。慢病毒载体是一种复制缺陷型逆转录病毒载体,以H型免疫缺陷病毒(HIV1)为基础发展而得,能够转染非分裂期细胞和分裂期细胞,而且病毒的遗传物质能够整合到宿主的基因组,将其用于梗阻性肾病的基因治疗,除比其他病毒载体更具优势外,病毒的糖蛋白(VSVG)外壳使载体病毒颗粒具有更强的稳定性,慢病毒载体RNAi作用持久,同时扩大了载体感染细胞的范围,因此慢病毒载体是很有前途的基因治疗载体。用慢病毒载体介导 RNAi的几项研究〔7,8〕均显示了该技术策略在内源性基因功能研究和基因治疗前沿领域的重大意义。
根据本课题前期研究成果中的靶点序列与pGCSIL-GFP载体连接,将连接产物转化到DH5a大肠杆菌感受态细胞,经PCR筛选阳性克隆,测序鉴定,测序结果与设计的序列一致,成功构建siRNA-PAX2慢病毒载体,经293T细胞包装以后产生慢病毒,体外感染NRK52E细胞后能有效降低PAX2mRNA和蛋白的表达, 提示可以通过PAX2特异性RNAi来研究其在梗阻性肾病发生、发展中的作用,进一步揭示肾脏纤维化的机制,为后续以PAX2为靶点的基因治疗梗阻性肾病提供实验依据。
4 参考文献
1Narlis M,Grote D,Gaitan Y,etal.Pax2 and Pax8 regulate branching morphogenesis and nephron differentiation in the developing kidney〔J〕.J Am Soc Nephrol,2007;18(4):1121-9.
2Baseands JL,Schanstra JP.Obstructive nephropathy:insights from genetically engineered animals〔J〕.Kidney Int,2005;68(3):925-37.
3Liu Y.New insights into epithelial-mesenchymal transition in kidney fibrosis〔J〕.J Am Soc Nephrol,2010;21(4):212-22.
4Picard N,Baum O,Vogetseder A,etal.Origin of renal myofibroblasts in the model of unilateral ureter obstruction in the rat〔J〕.Histochem Cell Biol,2008;130(1):141-55.
5Li L,Wu YB,Zhang WG.PAX2 re-expression in renal tubular epithelial cells and correlation with renal interstitial fibrosis of rats with obstructive nephropathy〔J〕.Ren Fail,2010;32(5):603-11.
6Imamura T,Kanai F,Kawakami T,etal.Proteomic analysis of the TGF-beta signaling pathway in pancreatic carcinoma cells using stable RNA interference to silence Smad4 expression〔J〕.Biochem Biophys Res Commun,2004;318(1):289-96.
7Oberbek A,Matasci M,Hacker DL,etal.Generation of stable,high-producing CHO cell lines by lentiviral vector-mediated gene transfer in serum-free suspension culture〔J〕.Biotechnol Bioeng,2011;108(3):600-10.
8Surdziel E,Eder M,Scherr M.Lentivirus-mediated antagomir expression〔J〕.Methods Mol Biol,2010;667(1):237-48.
