Foxq1与E-cadherin蛋白在大肠癌中的表达及其临床意义
2014-09-12魏正强蒙长远汤为学
骆 赞 魏正强 向 相 蒙长远 黎 晖 汤为学
(重庆医科大学附属第一医院胃肠外科, 重庆 400016)
近年来,随着生活水平的提高,大肠癌的发病呈上升趋势,严重影响患者的生活质量〔1〕。近几年有研究报道,卵巢癌,肺癌,乳腺癌等恶性肿瘤的发生发展及转移均与Foxq1的高表达有关〔2~4〕。E-cadherin蛋白是上皮间质化(EMT)的标志之一,其表达降低与大肠癌的发生发展及转移有重要联系〔5,6〕。目前,国内外综合研究二者在大肠癌的发生发展及转移的报道较少,本实验探讨Foxq1和E-cadherin蛋白在大肠癌中的相互作用及其与大肠癌的临床病理特征的关系。
1 资料与方法
1.1材料 收集重庆医科大学第一附属医院胃肠外科2012年3~9月行大肠癌根治术的标本62例,每例均包括癌组织、癌旁组织(距癌组织2~5 cm)、正常大肠黏膜组织(距癌旁组织≥8 cm)。所有标本均得到病理学证实,且术前均未行放化疗,所有病例临床及病理资料完整,其中男36例,女26例,Dukes A或B期34例,C或D期28例,年龄31~83岁,平均(58.3 ±9.43)岁。
1.2方法
1.2.1主要试剂 免疫组化SP试剂盒,DAB显影液购自北京康为生物公司;兔抗人Foxq1多克隆抗体购自ABGENT公司;兔抗人E-cadherin抗体购自Protetech公司;山羊抗兔二抗,凝胶试剂盒购自碧云天生物技术有限公司;蛋白提取试剂盒购自贝博公司。
1.2.2免疫组织化学法检测Foxq1与Ecadherin在大肠癌标本中的表达 上述每例标本取一部分行10%中性甲醛固定24 h,梯度酒精脱水,石蜡包埋,4 μm连续切片。按免疫组织化学SP法试剂盒说明书进行操作,Foxq1和E-cadherin一抗稀释度为1∶100,用PBS代替一抗作为阴性对照。经DAB显色,苏木精复染后,用Olympus光学显微镜下观察切片,以出现棕黄色至棕褐色颗粒为染色阳性,根据着色强度和着色面积将染色强度分为4级:0分,细胞无显色;1分,浅黄色;2分,棕黄色;3分,棕褐色。每张切片随机观察5个视野,根据阳性细胞占总细胞数的着色面积百分率分为5个等级:<5%为0级;5%~25%为1级;26%~50%为2级;51%~75%为3级;>75%为4级,分别取相应分值0、1、2、3、4分。用细胞数得分和强度得分的和作为判断表达结果,积分0~1分为阴性(-),2分为弱阳性(+),3~5分为中等阳性(),6~7分为强阳性()。
1.2.3Western印迹检测Foxq1与E-cadherin在大肠癌标本中的表达 收取新鲜大肠癌标本35例保存于-80℃。按照蛋白提取试剂盒操作说明提取上述组织的总蛋白,BCA法测定蛋白浓度。取50 μg总蛋白加适量上样缓冲液,煮沸变性5 min。分别配制5%浓缩胶和10%分离胶,恒压40 V电泳,待Marker电泳至浓缩胶后调整电压至80 V;待Marker电泳至距玻板底部1 cm时停止电泳。250 mA恒流转印蛋白至0.45 μm PVDF膜上,5%的脱脂奶粉溶液封闭2 h,以兔抗人Foxq1抗体和兔抗人Ecadherin抗体作为一抗(1∶200),4℃孵育过夜,TBST洗膜3次,15 min/次。再加入羊抗兔二抗(1∶2 000),37℃孵育90 min,洗膜同前。采用ECL化学发光试剂盒进行显色。实验重复3次。
1.3统计学方法 采用SPSS17.0软件,免疫组化结果采用χ2检验;Western印迹结果采用方差分析;相关性分析采用Spearman检验。
2 结 果
2.1Foxq1与Ecadherin在大肠癌标本中的表达
2.1.1免疫组织化学结果 Foxq1蛋白表达定位于细胞核,E-cadherin蛋白表达定位于细胞膜。Foxq1在大肠癌组织中的表达水平高于大肠癌癌旁组织及正常大肠黏膜组织,在癌旁组织的表达水平高于正常组织;其中,在大肠癌组织中的表达率为75.8%(47/62);在癌旁组织中的表达率为24.2%(15/62),在正常大肠黏膜组织中仅为6.5%(4/62);差异比较具有统计学意义(P<0.05)。E-cadherin蛋白在大肠癌组织中的表达水平明显低于大肠癌癌旁组织及正常大肠黏膜组织,在癌旁组织的表达水平低于正常组织;其中,在大肠癌组织中的表达率为14.5%(9/62),在癌旁组织中的表达率为30.6%(19/62),在正常大肠黏膜组织中仅为66.1%(41/62),差异比较具有统计学意义(P<0.05)。见图1、图2。
2.1.2Western印迹检测结果 Foxq1在大肠癌组织中表达水平(0.749±0.297)明显高于正常大肠黏膜组织(0.189±0.154)及癌旁组织(0.434±0.213),癌旁组织相对于正常黏膜组织也有所增高。E-cadherin蛋白在大肠癌组织中表达水平(0.379±0.176)明显低于正常大肠黏膜组织(0.837±0.284)及癌旁组织(0.628±0.245),癌旁组织相对于正常黏膜组织也有所降低,差异均具有统计学意义(P<0.05)。见图3。
2.2Foxq1与E-cadherin蛋白的表达与大肠癌临床病理特点之间的关系 二者在大肠癌中的表达与患者的年龄、性别、肿瘤大小无关(P>0.05),而与肿瘤的分化程度、Duke分期、淋巴结转移密切相关(P<0.05)。见表1、表2。
2.3Foxq1与E-cadherin蛋白在大肠癌中的相关性 经Spearman相关分析显示,Foxq1与E-cadherin蛋白在大肠癌中的表达水平呈显著负相关(r=-0.864,P<0.05;Western印迹r=-0.718,P<0.05)。
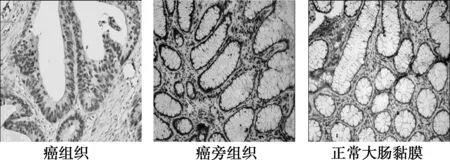
图1 Foxq1在大肠癌组织中的表达(SP, ×200)
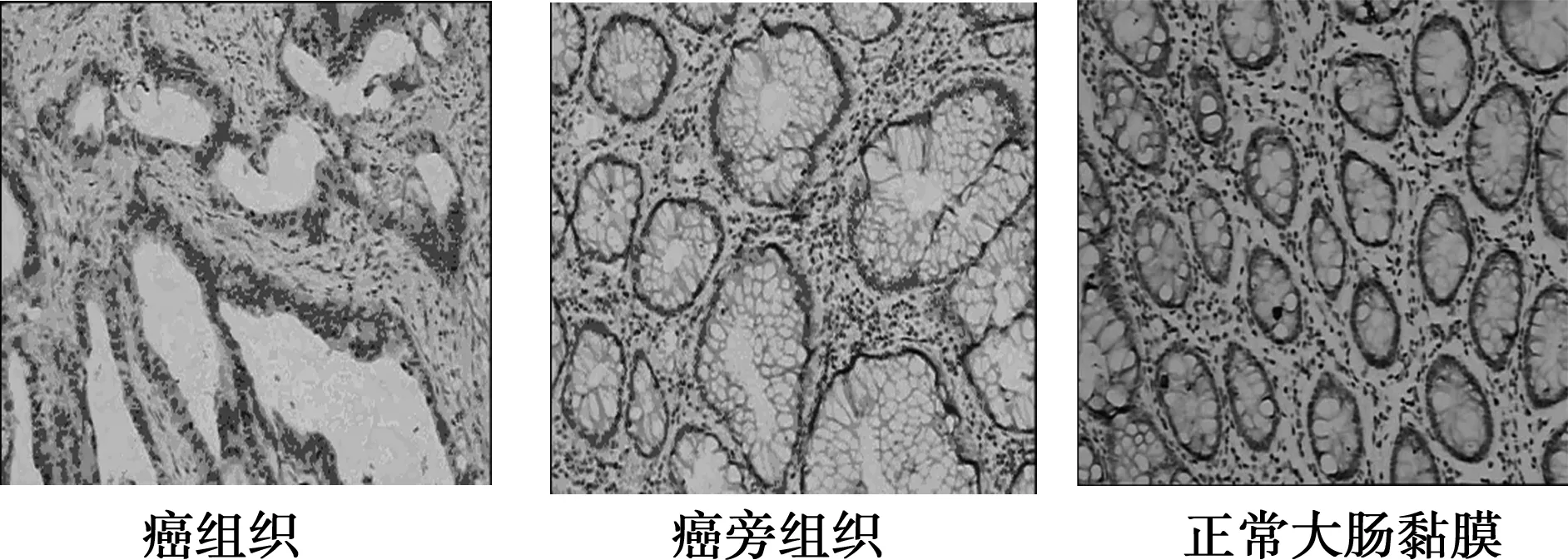
图2 E-cadherin在大肠癌组织中的表达(SP, ×200)
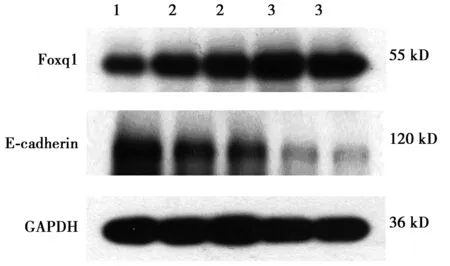
1:正常大肠黏膜组织;2:大肠癌旁组织;3:大肠癌组织

表1 Foxq1、E-cadherin蛋白的阳性表达与大肠癌的临床病理特征的关系(n)

表2 Foxq1、E-cadherin蛋白的表达与大肠癌的临床病理特征的关系
3 讨 论
Fox家族是一类庞大而功能广泛的转录因子家族,参与胚胎发育、细胞周期调控、糖类和脂类代谢、生物老化、免疫调节等多种生物学过程,其突变和表达异常与发育畸形、代谢性疾病以及肿瘤发生有关〔7〕。Fox家族中,有多个亚族都广泛参与肿瘤的发生发展及转移。FoxMlb在肝细胞癌〔8〕、乳腺癌〔9〕和基底细胞癌中均表达增高。研究表明,FoxM1上调在食管鳞状细胞癌的发生中起到了十分关键的作用,而且FoxM1表达水平越高预后越差〔10〕。对于黑色素瘤细胞的调控,FoxO3a与FoxP3也起着至关重要的作用〔11,12〕。此外,还有报道FoxP1在胃黏膜相关淋巴组织(MALT)淋巴瘤中高表达〔13〕,且与乳腺癌的进展密切相关〔14〕。另外,FoxD4a、FoxIMb的表达与白血病的发生也有着十分紧密的联系。
Foxq1是Fox基因家族的新发现的转录因子之一,其基因定位于6p25.3,全长2 319 bp,含有1个外显子,编码有403个氨基酸的蛋白。Foxq1在肺癌的发生中起到关键性作用,通过调控E-cadherin,使其表达下调,引起肺上皮细胞发生EMT化,最终导致肺癌发生〔4〕。E-cadherin是一种钙依赖性跨膜糖蛋白,介导细胞间黏附反应,被称为上皮标志物。E-cadherin也被公认为是一种抑癌因子,其表达的缺失或下降与多种肿瘤的浸润生长、转移、预后不良有密切关系。E-cadherin蛋白在膀胱癌、前列腺癌、乳腺癌、子宫内膜癌、胃癌等恶性肿瘤中均低表达或不表达。以上研究证实,由于E-cadherin蛋白的下调或缺失,可导致β-catenin在细胞质内聚集,进而激活β-catenin所介导的WNT信号通路,最终导致肿瘤的发生发展与转移〔15,16〕。有文献报道,Foxq1在乳腺癌中与E-cadherin蛋白的核心启动子区的E-box结合,抑制E-cadherin蛋白的表达,从而引起乳腺癌的发生发展及转移〔5〕,提示Foxq1和E-cadherin在肿瘤发生中可能存在一定关系。
本研究显示Foxq1在大肠癌组织中表达较高,尤其是高恶性程度的和晚期大肠癌,而在伴有淋巴结转移的或远处转移的晚期大肠癌组织中,Foxq1更是明显表达增高。而E-cadherin蛋白在大肠癌组织中的表达明显降低,尤其是高恶性程度的和晚期大肠癌,而在伴有淋巴结转移的或远处转移的晚期大肠癌组织中,E-cadherin表达更是明显表达减少,提示二者不仅与大肠癌的发生发展,还与扩散转移有重要联系。相关性分析显示,Foxq1与E-cadherin蛋白呈负性相关,提示二者在大肠癌发生发展及转移的过程中,存在直接或间接的相互调节的作用。本研究提示,可能正是由于Foxq1的增加,使E-cadherin蛋白的下调,最终导致大肠癌的发生发展及转移,但具体机制还有待进一步研究。
综上,揭示了二者在大肠癌发生发展及转移过程中的相互关系,Foxq1在大肠癌中处于异常活化状态,而E-cadherin蛋白在大肠癌明显低表达,提示二者的联合检测对提高大肠癌的诊疗水平,改善预后都具有一定意义。同时,也显示Foxq1可能为大肠癌治疗的新靶点,可能为临床化疗新药的开发提供理论基础。
4 参考文献
1Kim JC, Kim SY, Roh SA. Gene expression profiling: canonical molecular changes and clinicopathological features in sporadic colorectal cancers 〔J〕. World J Gastroenterol, 2008;14(43):6662-72.
2Qiao YY, Jiang X, Lee ST,etal. FOXQ1 regulates epithelial-mesenchymal transition in human cancers 〔J〕. Cancer Res, 2011;71(8):3076-86.
3Feng J, Zhang XS, Zhu HJ,etal. FoxQ1 overexpression influences poor prognosis in nonsmall cell lung cancer, associates with the phenomenon of EMT 〔J〕. PLoS One, 2012;7(6):e39937.
4Zhang HJ , Meng FY, Liu G,etal. Forkhead transcription factor foxq1 promotes epithelial-mesenchymal transition and breast cancer metastasis 〔J〕. Cancer Res, 2011;71(4):1292-301.
5Buda A, Pignatelli M. E-Cadherin and the cytoskeletal network in colorectal cancer development and metastasis 〔J〕. Cell Commun Adhes, 2011;18(6):133-43.
6Li N , Chen XB , Wan XB ,etal. Relationship between expression of CEA, E-cadherin and liver metastasis in colorectal cancer 〔J〕. Chin J Clin Oncol, 2008;5(6):429-32.
7袁 杰. FOX基因与发育的关系 〔J〕. 国际儿科学杂志, 2010;4(24):409-12.
8Park HJ, Gusarova G, Wang ZB,etal. Deregulation of FoxM1b leads to tumour metastasis 〔J〕. EMBO Mol Med, 2011;3(1):21-34.
9Wonsey DR,Follettie MT.Loss of the forkhead transcription factor Foxm1 causes cent-rosome amplification and mitotic catastrophe 〔J〕. Cancer Res, 2005;65(12):5181-9.
10Hui MK, Chan KW, Luk JM,etal. Cytoplasmic Forkhead box M1 (FoxM1) in esophag-eal squamous cell carcinoma significantly correlates with pathological disease stage 〔J〕. World J Surg, 2012;36(1):90-7.
11Zanella F, Renner O, García B,etal. Human TRIB2 is a repressor of FOXO that contri-butes to the malignant phenotype of melanoma cells 〔J〕. Oncogene, 2010;29(20):2973-82.
12Knol AC, Nguyen JM, Pandolfino MC,etal. Tissue Biomarkers in Melanoma Patients Treated with TIL 〔J〕. PLoS One, 2012;7(12):e48729.
13Lin L, Min M, Bi CF,etal. Primary gastrointestinal diffuse large B-cell lymphoma: an immunohistochemical and prognostic study of 90 cases 〔J〕. Chin J Pathol, 2011;40(4):220-6.
14Shigekawa T, Ijichi N, Ikeda K,etal.FOXP1, an estrogen-inducible transcription factor, modulates cell proliferation in breast cancer cells and 5-year recurrence-free survival of patients with tamoxifen-treated breast cancer 〔J〕. Horm Cancer, 2011;2(5):286-97.
15Rao US, Hoerster NS, Thirumala S,etal. The influence of metastatic site on the expres-sion of CEA and cellular localization of β-catenin in colorectal cancer 〔J〕. Gastroenterol Hepatol, 2013;28(3):506-12.
16Stubbins RE, Hakeem A, Núez NP. Using components of the vitamin D pathway to prevent and treat colon cancer 〔J〕. Nutr Rev, 2012;70(12):721-9.
