苦参素对肝癌细胞HepG2细胞增殖和MicroRNA-122、MicroRNA-21表达的影响
2014-09-12黄赞松向发良周喜汉黄衍强邓志华仇仪英
黄赞松 向发良 周喜汉 黄衍强 邓志华 仇仪英
(右江民族医学院附属医院消化内科,广西 百色 533000)
肝癌的发生、发展与微小RNA(miRNA或MicroRNA)的异常表达有关,其中在肝癌中表达上调,行使癌基因的功能,被称为“肿瘤miRNA”(OncomiRs)〔1,2〕,如MicroRNA-21作为一个原癌miRNA,与多种肿瘤的发生发展密切相关〔3〕;另一部分miRNA 则行使抑癌基因的功能。目前,肝癌的治疗仍以综合治疗为主,但放、化疗毒副作用大,中药能降低化疗药物的毒副作用,增强人体免疫力,提高患者生存质量和延长生命所体现的优势,弥补了现代医学肿瘤治疗方法的不足〔4〕苦参素是苦豆子等中草药活性成分的提取物,具有抗肝癌的作用〔5〕,但其抗肝癌的作用机制未完全阐明。本实验研究不同浓度苦参素(Oxymatrine或OM)抗肝癌的作用,同时研究苦参素对HepG2细胞中MicroRNA-122、MicroRNA-21表达的影响。
1 材料与方法
1.1材料 HepG2细胞株购自中科院上海细胞库。并在含10%小牛血清、青霉素100 U/ml、链霉素100 U/ml的RPMI21640培养液中,置于37℃、5%二氧化碳(CO2)培养箱(MCO-18AIC CO2)内培养。苦参素注射液0.6 mg/mL,购于湖北天药药业股份有限公司。小牛血清购于GIBCO公司(北美洲),RPMI21640培养液及胰酶均购于北京索莱宝科技有限公司。MTT配制成5 mg/ml,过滤除菌分装备用。miRcute miRNA 提取试剂盒(目录号:DP501)、miRcute miRNA cDNA 第一链合成试剂盒(目录号:KR201)、miRcute miRNA荧光定量试剂盒(目录号:FP401)均购于天跟生化科技(北京)有限公司。MicroRNA-122、MicroRNA-21、U6(目的序列与内参序列具有相同的扩增效率)引物均购于天跟生化科技(北京)有限公司。仪器BHC-1300ⅡA/B3生物安全柜,MCO-18AIC CO2恒温培养箱,全自动酶标仪Multiskan MK3,倒置显微镜,台式高速冰冻离心机1-15PK,微型离心机UniForce6K,RT-PCR仪IQ5,凝胶成像仪。
1.2方法
1.2.1MTT法检测不同浓度苦参素作用HepG2细胞增殖的影响 取对数生长期的细胞,制成细胞悬液,以5×104/ml密度接种于96孔培养板,每孔接种100 μl细胞悬液,分为实验组苦参素组、阴性对照组和空白对照组,阴性对照组加细胞悬液,不加药物;空白对照组只加培养液,不加细胞和药物。每组设8个复孔。放入培养箱中培养,待细胞贴壁后加入预先配制好的含苦参素的培养液100 μl/孔,使其终浓度为0.5、1.0、2.0、4.0、8.0 mg/ml;向阴性对照组和空白对照组加入培养液100 μl/孔。将培养板放置CO2孵育箱中分别孵育48、72 h。分别于44、68 h时向苦参素组、阴性对照组和空白对照组加入5 mg/ml MTT 15 μl/孔,继续孵育4 h。小心吸弃上清液,每孔加入DMSO 150 μl,然后置于恒温振荡箱中,37℃、100 rpm,振荡10 min。在全自动酶标仪上于490 nm波长处测定光密度(OD)值,用复孔平均OD值进行比较,计算肿瘤细胞抑制率(IR)。以药物浓度为横坐标,抑制率为纵坐标绘制浓度效应曲线,求回归方程,得出50%抑制浓度(IC50)。
1.2.2实时聚合酶链反应检测MicroRNA-122和MicroRNA-21的表达
1.2.2.1细胞培养 取对数生长期细胞,制成细胞悬液,取等量细胞接种于两个新的培养瓶中,吹打混匀,然后置于饱和湿度、37℃、5%CO2培养箱中培养。待细胞贴壁后,1瓶细胞予常规换液处理作为未加药的阴性对照组,另1瓶细胞予换含IC50OM(根据回归方程,求得OM作用于HepG2细胞72 h IC50为3.2 mg/ml)培养液处理作为加药的OM实验组。分别做好标记,然后放回培养箱中继续培养72 h。
1.2.2.2细胞总RNA的提取及RNA反转录和PCR检测 根据天跟公司试剂盒进行RNA 提取和RNA逆转录,之后在实时PCR仪上进行扩增,操作步骤均按照试剂盒说明完成,使用Real time PCR进行检测MicroRNA-122和MicroRNA-21的表达,以U6作为内参,分管同机进行PCR反应。阴性对照组与OM实验组反应同机进行,重复实验3次。相对定量分析2-△△CT
1.2.2.3琼脂糖凝胶电泳验证PCR扩增产物 按一定(上样缓冲液:DNA样品=1∶5)的比例(体积/体积)加入1.5%的琼脂糖凝胶跑胶,条件为:80 V,30 min。停止电泳。取胶置于凝胶成像仪中进行观察和照相。
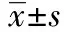
2 结 果
2.1苦参素对肝癌HepG2细胞增殖的影响 不同浓度苦参素作用肝癌HepG2细胞48 h、72 h后,发现苦参素对肝癌细胞增殖抑制率药物浓度的增加及作用时间延长显著增加(P<0.05,P<0.01),但低浓度0.5 mg/ml OM作用48 h、72 h时差异无统计学意义(P>0.05),故认为0.5 mg/ml OM组对肝癌HepG2细胞无增殖抑制作用。OM各浓度组作用48 h和72 h差异有统计学意义(P<0.05)。见表1,图1。
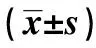
表1 苦参素对HepG2细胞增殖的影响

72 h对照组
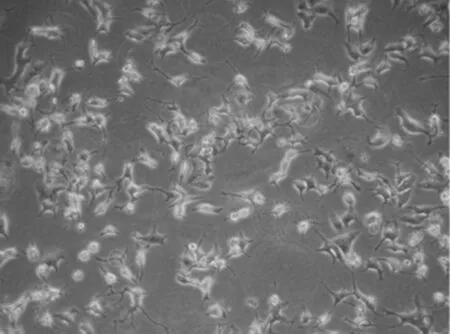
3.2 mg/ml OM作用72 h
2.2Real-time PCR法检测苦参素对HepG2细胞MicroRNA-122及MicroRNA-21表达的影响 OM实验组MicroRNA-122的表达为阴性对照组的2.79倍,MicroRNA-122表达上调。OM实验组MicroRNA-21的表达为阴性对照组的0.44倍,MicroRNA-21表达下调。
2.3MicroRNA-122和MicroRNA-21 PCR扩增产物琼脂糖凝胶电泳结果 Real-time PCR反应后为进一步验证扩增产物,予行琼脂糖凝胶电泳(见图2),MicroRNA-122、MicroRNA-21及U6均见单一清晰条带,无杂带和拖尾现象,说明产物特异性好,无非特异性扩增和引物二聚体。

1:Marker;2:OM实验组MicroRNA-122;3:阴性对照组MicroRNA-122;4:阴性对照组U6;5:OM实验组U6;6:阴性对照组MicroRNA-21;7:OM实验组MicroRNA-21;8:阴性对照组U6;9:OM实验组U6
3 讨 论
苦参素是苦豆子等中草药活性成分的提取物,主要含有氧化苦参碱和极少量氧化槐果碱的混合物,其中氧化苦参碱含量在98%以上,又名氧化苦参碱〔6,7〕。近年来其抗肿瘤作用的研究备受关注,以抗肝细胞肿瘤为甚,本研究发现苦参素对小鼠肝移植瘤有抑制作用〔8〕。有多项研究表明苦参素有抗肿瘤作用〔9~11〕,可通过抑制肿瘤细胞DNA的合成、抑制相关酶活性、影响肿瘤细胞的正常周期来抑制肿瘤细胞增殖;通过控制相关因子的表达来抑制肿瘤的转移;前期研究表明苦参素可通过影响与肿瘤相关基因的表达、影响端粒酶的活性等途径来诱发细胞发生凋亡〔12~14〕。
刘益均等〔15〕采用MTT法观察不同浓度和不同作用时间下OM对SGC-7901细胞的抑制情况,发现苦参素药物浓度达到1 mg/ml以上时,则能显著抑制细胞的增殖,抑制效应随着时间和浓度的增加呈逐渐增强,提示OM在体外能显著抑制SGC-7901细胞增殖。本实验结果发现OM浓度达到1.0 mg/ml以上后对HepG2细胞均有抑制作用,且随时间增加而抑制作用更显著,即OM对肿瘤细胞抑制作用具有浓度依赖性和时间依赖性。这与刘益均等研究结果一致。
MicroRNA(miRNAs)是一类短序列、非编码、具有调控功能的单链小分子RNA,大约由20~22个核苷酸构成,由一段具有发夹样环状结构、长约70~80nt的单链RNA前体(pre-miRNA)经Dicer酶加工后生成〔16,17〕。它们广泛存在于从植物、线虫到人类的细胞中。miRNAs主要是与靶mRNA的3’UTR区域结合,抑制mRNA的翻译或直接是mRNA降解,能调节多种生物功能〔18〕。有研究〔19〕发现microRNAs在肝癌组织中异常表达,它们可能参与了肝细胞癌变及肝癌转移的病理过程,包括MicroRNA-21、MicroRNA-122、mir-224、mir-93、mir-200a等〔20~22〕。
本实验结果发现OM实验组中其表达上调,OM能提高肝癌细胞内的MicroRNA-122的表达,抑制细胞增殖,根据以往实验结果microRNA-122在肝正常组织及癌旁组织中高表达,而在肝癌组织中低表达〔23〕,同时Lin等〔24〕研究发现Bcl-2 是MicroRNA-122 的一个靶基因,MicroRNA-122 作用于Bcl-2 的3’UTR 后,升高MicroRNA-122能明显抑制Bcl-2 蛋白的表达,继而导致细胞活力降低和半胱氨酸天冬氨酸酶-3(caspase-3)活性激活,从而促进了肿瘤细胞的凋亡。OM可能使肝癌细胞中MicroRNA-122表达升高,从而促进肿瘤细胞凋亡。OM能提高MicroRNA-122的表达,这能否逆转肿瘤细胞向癌旁组织及正常细胞转化需行大量的动物实验及临床试验进一步研究。
相关研究表明MicroRNA-21 基因的启动子受核因子(NF)-κB、激活蛋白(AP)-1〔25〕、NFIB和信号传导与转录激活因子-3(STAT3)〔26〕等转录因子的调节。Meng等〔27〕研究小组利用基因芯片技术对正常肝细胞和肝癌细胞中miRNA 的表达谱进行了分析,结果显示MicroRNA-21 在肝癌细胞中比正常细胞高9 倍,并且外源MicroRNA-21 的导入可抑制肿瘤抑制基因磷酸酶及张力蛋白同源物基因(PTEN)的功能,明显增强肝癌细胞的增值、侵袭及迁移能力,促进肿瘤的转移。本实验发现OM实验组中MicroRNA-21表达下调,而细胞数目减少, MicroRNA-21在HepG2细胞中可能起到癌基因作用,经过OM处理后的HepG2细胞中MicroRNA-21表达下调,其诱导的细胞增殖受到抑制,从而细胞数目减少。OM可能通过下调MicroRNA-21的表达从而抑制肝癌细胞增殖,促进肝癌细胞凋亡,抑制肿瘤转移。
综上所述,OM浓度达到1.0 mg/ml以上后对人肝癌细胞株HepG2细胞有明显抑制作用,且具有时间依赖性和浓度依赖性。OM可上调HepG2细胞的MicroRNA-122表达,促进肿瘤细胞凋亡,由于本实验存在局限,OM能否逆转肿瘤细胞向正常细胞转化需进一步行动物实验及临床研究进一步证实。MicroRNA-21作为癌基因,OM作用后可下调其表达,说明OM抑制肝癌作用的机制可能与下调MicroRNA-21表达有关。
4 参考文献
1Hammond SM.MicroRNAs as oncogenes〔J〕.Curr Opin Genet Dev,2006;16(1):4-9.
2邓志华,黄赞松.microRNA 与消化系统肿瘤〔J〕.生物医学工程与临床,2011;15(5):493-7.
3方国强,吴炳礼,李恩民,等.MicroRNA-21 与肿瘤〔J〕.癌变·畸变·突变,2010;22(1):68-74.
4黄赞松,仇仪英.中医药治疗原发性肝癌的研究现状〔J〕.时珍国医国药,2012;23(11):2851-3.
5向发良,黄赞松.苦参素抗肝癌作用研究〔J〕.医学综述,2011;17(19):2992-5.
6邓志华.苦参素对人肝癌细胞株 Bel-7404 细胞增殖和 E2F1、 c-myc 表达的影响〔D〕.广西医科大学,2011.
7黄赞松,周喜汉.苦参素药理和抗肿瘤作用研究〔J〕.医学综述,2009;15(11):1701-4.
8黄宏思,黄赞松,黄卫彤,等.苦参素与顺铂合用对小鼠肝癌移植瘤的影响〔J〕.时珍国医国药,2008;19(9):2102-3.
9刘欣阳,王艳苹,刘静华.苦参素抗肿瘤的研究进展〔J〕.国际中医中药杂志,2007;29(5):289-90.
10万旭英,罗 明,贺 平,等.苦参碱和氧化苦参碱体外对人肝癌细胞的诱导分化作用〔J〕.中国药理学通报,2009;25(7):977-9.
11邓志华,黄赞松,周喜汉.苦参素抗消化系统肿瘤作用机制和临床实验应用就〔J〕.医学综述,2010;16(14):2126-31.
12韦 星,黄赞松,黄岑汉,等.苦参素注射液联合顺铂对人肝癌SMMC-7721细胞凋亡相关基因c-myc、bcl-2和bax表达的影响〔J〕.山东医药,2012;52(7):12-4.
13韦 星,黄赞松,黄岑汉,等.苦参素注射液与顺铂联合对人肝癌细胞SMMC-7721端粒酶活性及wtp53、hTERT mRNA表达的影响〔J〕.实用医学杂志,2012;28(11):1759-61.
14黄赞松,周喜汉,韦 星,等.苦参素与顺铂联合应用诱导肝癌SMMC-7721细胞凋亡及其机制〔J〕.辽宁中医杂志,2008;35(9):1284-6.
15刘益均,郑 军,肖文波,等.氧化苦参碱对人胃癌SGC-7901细胞增殖及血管内皮生长因子表达的影响〔J〕.中国癌症杂志,2010;20(1):22-6.
16Kim VN,Nam JW.Genomics of m icroRNA〔J〕.Trends Genet,2006;22(3):165-73.
17Julia W,Steffen L,Dominik W,etal.Loop-miRs:active microRNAs generated from single-stranded loop regions〔J〕 Nucleic Acids Research,2013;41(10):5503-12.
18Engels BM,Hutvagner G.Principles and effects of microRNA-mediated post-transcriptional gene regulation〔J〕.Oncogene,2006;25(46):6163-9.
19Murakam i Y,Yasu da T,Saigo K,etal.Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues〔J〕.Oncogene,2006;25(17):2537-45.
20Tomimaru Y,Eguchi H,Nagano H,etal.MicroRNA-21 induces resistance to the anti-tumour effect of interferon-a/5-fluorouracil in hepatocellular carcinoma cells〔J〕.British J Cancer,2010;103:1617-26.
21Leina M,Jia L,Junjie S,etal. Expression of miR-122 mediated by adenoviral vector induces apoptosis and cell cycle arrest of cancer cells〔J〕.Cancer Biol Therapy,2010;9(7):554-61.
22Li Y,Tan W,Neo TW,etal.Role of the miR-106b-25 microRNA cluster in hepatocellular carcinoma〔J〕.Cancer,2009;100(7):1234-42.
23Wei CT,Sheng DH,Chu SH,etal.MicroRNA-122 plays a critical role in liver homeostasis and hepatocarcinogenesis〔J〕.J Clin Invest, 2012;8(122):2884-97.
24Lin CJ,Gong HY,Tseng HC,etal.MicroRNA-122 targets an anti-apoptotic gene,Bcl-w,in human hepatocellular carcinoma cell lines〔J〕.Biochem Biophys Res Commun,2008;375(3):315-20.
25Fujita S,Ito T,Mizutani T,etal.MicroRNA-21 Gene expression triggered by AP-1 is sustained through a double negative feedback mechanism〔J〕.J Mol Biol,2008;378(2):492-504.
26Löffler D,Brocke-Heidrich K,Pfeifer G,etal.Interleukin-6 dependent survival of multiple myeloma cells involves the Stat3-mediated induction of microRNA-21 through a highly conserved enhancer〔J〕.Blood,2007;110(4):1330-3.
27Meng F,Henson R,Wehbe-Janek H,etal.MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer〔J〕.Gastroenterology,2007;133(2):647-58.
