金属硫蛋白3对快速老化痴呆模型小鼠海马组织学变化的影响
2014-09-12马飞煜黄林欢
马飞煜 林 婉 黄林欢 林 麒
(汕头市中心医院暨中山大学附属汕头医院神经内科,广东 汕头 515041)
海马结构在学习、记忆等高级神经活动中起重要作用。阿尔茨海默病(AD)主要累及于此,表现为进行性智力衰退和行为、人格变化。快速老化痴呆模型小鼠(SAMP8)是主要以学习、记忆能力下降为特征的比较理想的自然衰老痴呆模型〔1~4〕。快速老化小鼠(SAMR1)表现为正常衰老,一般作为SAMP的正常对照〔5〕。Uchida等〔6〕首次从人脑组织中分离出金属硫蛋白(MT)3,因其只在脑内特异表达,可能具有重要的神经生理和神经调节功能。临床报道老年痴呆患者脑内MT3含量明显减少〔7〕,引发了许多MT3与AD发病机制的研究。本实验观察MT3对SAMP8小鼠海马组织学变化的影响。
1 材料与方法
1.1动物分组 实验动物均7月龄,雄性,每组20只。SAMP8作为痴呆组,SAMR1作为正常组。将SAMP8随机分成痴呆组、空白对照组(0.2 ml/10 g生理盐水)、低浓度MT3(75 μg/ml)组、中浓度MT3(150 μg/ml)组、高浓度MT3(300 μg/ml)组。由天津中医学院第一附属医院实验动物中心提供。连续腹腔注射28 d,停药1 d后备用。
1.2光镜标本制备、HE染色 4%多聚甲醛灌注取脑,常规梯度酒精脱水,二甲苯透明后,浸蜡,石蜡包埋制成蜡块,每只鼠海马连续发片;切片常规用二甲苯脱蜡,经各级乙醇脱水:苏木精染色;盐酸乙醇分化;自来水浸泡;置伊红液;常规脱水,透明,封片。
1.3透射电镜标本制备 用2.5%戊二醛和4%多聚甲醛混合液灌注取脑,再置于4%戊二醛、锇酸中固定;梯度酒精脱水;环氧树脂包埋;制备半薄切片定位后,超薄切片,用醋酸双氧铀和柠檬酸铅双染,备电镜观察。
2 结 果
2.1各组小鼠海马CA1区HE染色结果 SAMP8组海马CA1区结构不清,锥体细胞数量减少,排列紊乱;很多细胞核体积变小、深染,呈核固缩表现;胶质细胞明显增生。SAMR1组海马CA1区结构清晰,锥体细胞数量未见减少,细胞排列较整齐、均匀,细胞形态正常,结构完整。低、中、高浓度MT3组海马CA1区锥体细胞较空白对照组结构较清晰,排列较整齐均匀,胶质细胞减少;中浓度MT3组有锥体细胞脱失;低、中浓度MT3组形态学不如高浓度MT3组规整;高浓度MT3组海马CA1区锥体细胞排列较整齐均匀,细胞形态结构较清晰(图1)。
2.2各组小鼠海马CA1区神经元透射电镜超微结构结果 SAMP8组大部分神经元体积变小,核不规则,胞质内有较多脂褐素沉积;出现胞核固缩,核膜断裂,线粒体空泡化,有脂褐素沉积;神经毡呈空泡化,神经丝溶解消失;核基轻度空化,胞质内可见线粒体,粗面内质网及脂褐素。SAMR1组神经元胞膜完整,染色质分布均匀,细胞器清晰可见,排列有序,细胞核呈圆形或椭圆形,核仁清楚,单个或两个;神经毡超微结构正常。低、中、高浓度MT3组均可见神经元轻度空泡化改变,胞质内都可见线粒体和粗面内质网稍肿胀,脂褐素沉积;神经毡内空泡化减少,神经丝较空白对照组增多;高浓度MT3组可见接近正常神经元,有少量脂褐素,神经毡、神经丝较空白对照组增多。海马CA1区超微结构受损逐渐减轻,高浓度MT3组最接近于SAMR1组,但仍未达到正常(图2)。
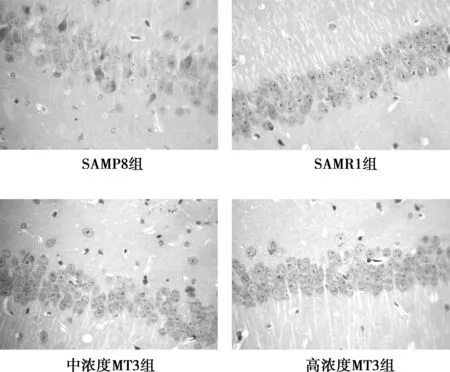
图1 各组海马CA1区锥体细胞排列比较(HE,×400)

图2 各组海马CA1区神经元透射电镜超微结构
3 讨 论
AD主要病理变化包括神经元缺失,老年斑形成,神经原纤维缠结及神经胶质细胞增生。海马结构在学习、记忆等高级神经活动中起重要作用。SAMP8是由日本京都大学Takeda教授开发,以学习记忆功能呈增龄性加速衰退为主要特征,成为研究老化和学习记忆障碍的理想动物模型〔8,9〕。本实验说明SAMP8学习记忆能力下降与海马结构神经元减少、变性和凋亡有关。SAMP8经MT3治疗能减轻海马神经元的损伤,对神经元起到保护作用。MT3只存在于中枢神经系统,对其生物学功能的认识,目前概括起来包括以下几个方面:①对铜、锌等金属的隔离与分散作用;②调控锌金属蛋白的生物合成及活性;③保护细胞免受自由基伤害;④特定情况下对神经元细胞生长的抑制作用。本实验结果证实SAMP8学习记忆能力下降有其海马结构的组织形态学基础,MT3能通过对海马神经元的保护作用而起到改善认知功能。目前MT3对AD的保护作用机制尚未清楚。
4 参考文献
1Okuma Y,Nomura Y.Senescence-accelerated mouse (SAM) as an animal model of senile dementia:pharmacological,neurochemical and molecular biological approach〔J〕.Jpn J Pharmacol,1998;78:399-404.
2Nomura Y,Okuma Y.Age-related defect s in lifespan and learning ability in SAMP8 mice〔J〕.Neurobiol Aging,1999;20:111-5.
3Han S,Rudd JA,Hu ZY,etal.Fang M.Analysis of neuronal nitric oxide synthase expression and increasing astrogliosis in the brain of senescence-accelerated-prone 8 mice〔J〕.Int J Neurosci,2010;120(9):602-8.
4Fernández-Gómez FJ,Muoz-Delgado E,Montenegro MF,etal. Cholinesterase activity in brain of senescence-accelerated-resistant mouse SAMR1 and its variation in brain of senescence-accelerated-prone mouse SAMP8〔J〕.J Neurosci Res,2010;88(1):155-66.
5Takeda T.Senescence-accelerated mouse (SAM):a biogerontological resource in aging research〔J〕.Neurobiol Aging,1999;20(2):105-10.
6Uchida Y,Takio K,Titani K.The growth inhibitory factor that is deficient in Alzhemler’s disease is a 68 amino acid metallothionein-like protein〔J〕.Neuron,1991;7(2):337-47.
7Yu WH,Lukiw WJ,Bergeron C,etal.Metallothionein is reduced in Alzheimer’s disease〔J〕.Brain Res,2001;894:37-45.
8Okuma Y,Nomura Y.Senescence-accelerated mouse(SAM) as an animal model of senile dementia:pharmacological,neurochemical and molecular biological approach〔J〕.Jpn J Pharmacol,1998;78:399-404.
9刘一凡,石学敏,韩景献,等.快速老化脑萎缩模型小鼠脑抗氧化酶活性增龄性变化的研究〔J〕.中国老年学杂志,2003;23:462-3.
