自噬在贝伐单抗诱导非小细胞肺癌凋亡中的作用
2014-09-12刘东雷郭海周
朱 砾 杨 洋 刘东雷 郭海周 赵 松
(郑州大学第一附属医院,河南 郑州 450052)
肺癌是我国最常见的恶性肿瘤之一,其中非小细胞肺癌发病率占肺癌总发病率的80%。肺癌起病隐袭、早期诊断率低,大多数患者在确诊时已达中晚期,失去了外科治疗的最佳时机。贝伐单抗是重组人血管内皮生长因子(VEGF)单克隆抗体,相关试验已证明贝伐单抗对于肝细胞移植瘤以及鼻咽癌移植瘤的新生血管生成及细胞生长具有抑制作用〔1,2〕。本试验将自噬特异性抑制剂3-甲基腺嘌呤(3-MA)引入,进一步探讨自噬在贝伐单抗非小细胞肺癌A549细胞的增殖抑制中的作用。
1 材料与方法
1.1材料与试剂 非小细胞肺癌细胞株A549由河南省高等学校临床医学重点学科开放实验室提供。贝伐单抗(阿瓦斯汀)购自瑞士罗氏制药公司。3-MA、四甲基偶氮唑盐(MTT)、单丹磺酰尸胺(MDC)及吖啶橙(AO)为美国Sigma公司产品。AnnexinV-FITC/PI细胞凋亡检测试剂盒由南京凯基生物科技发展有限公司生产。胎牛血清购自杭州四季青生物工程材料有限公司,RPMI1640、不含乙二胺四乙酸(EDTA)胰蛋白酶消化液购自Solarbio公司。微管相关蛋白(LC)-3及Beclin1多克隆抗体购自美国Santa Cruz公司。
1.2试验方法
1.2.1MTT法定性检测细胞存活与生长 用含10%胎小牛血清加1640培养基将A549细胞分散成单个细胞悬液,以每孔5 000~10 000个细胞接种到96孔板,体积100 μl/孔,按5%CO2,37℃孵育,至细胞贴壁,加入浓度梯度的药物,每个浓度设6个复孔,100 μl/孔,作用24~48 h。 每孔加入20 μl MTT溶液(5 mg/ml),继续培养4 h。每孔加150 μl DMSO,脱色摇床振荡10 min,选择490 nm波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.2.2流式细胞术检测细胞凋亡率 取对数生长期细胞,以5×105个/ml接种于6孔板中,待细胞贴壁后加入相应浓度药物,设立阴性对照组并作用24 h。收集悬浮细胞,用不含EDTA胰蛋白酶消化液消化收集贴壁细胞,冷磷酸盐缓冲液(PBS)洗涤2次,加入400 μl AnnexinV结合液悬浮细胞,使细胞浓度调整为1×106个/ml,在细胞悬液中加入5 μl AnnexinV-FITC染色液,混匀,4℃避光孵育15 min,再加10 μ PI,混匀,4℃避光孵育5 min,立即上流式细胞仪检测。每组实验重复4次。
1.2.3AO及MDC染色检测细胞自噬情况 将处于对数生长期的A549细胞,以5×105个/ml浓度接种于24孔板中,待细胞贴壁后,采用所测得最适实验浓度的贝伐单抗和3-MA处理细胞,同时设立阴性对照组,作用24 h后弃培养液,PBS洗涤2次,加浓度为50 μmol/L的MDC(或10 μg/ml的AO)在5%CO2,37℃下染色45 min,弃染液,PBS洗涤3次,用4%多聚甲醛在4℃下固定15 min,后用PBS洗涤3次,立即用倒置荧光显微镜观察细胞自噬的变化情况并摄片。
1.2.4Western 印迹检测细胞Beclin1和LC-3蛋白的表达 选择处于对数生长期的A549细胞若干培养瓶,设置实验组:单用贝伐单抗,单用3-MA及联用组,并设置空白对照组。分别加入实验浓度药物,培养24 h。同时收集瓶中和培养液中的细胞,经预冷PBS洗涤后,每瓶细胞加入裂解液,经离心后分装入EP管中。应用考马斯亮蓝,通过测定吸光度值进行蛋白质定量。配置好分离胶及浓缩胶,每孔上样15 μl,进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳。半干转膜法转膜,并用5%脱脂奶粉常温封闭1 h,加入Beclin1及LC-3抗体(浓度均为1∶500)4℃孵育过夜,Tris盐酸缓冲液(TBST)洗涤3次,10 min/次,辣根过氧化物酶标记二抗(1∶2 000)室温孵育1 h,TBST再次洗涤4次,10 min/次,进行ECL化学发光,暗室内X胶片曝光显影并摄片。β-actin为内参照。

2 结 果
2.1MTT结果 随着贝伐单抗及3-MA浓度的增加,对A549细胞的抑制率也增加、贝伐单抗作用48 h时,细胞IC50值约为20 μmol/L,因此选用20 μmol/L作为贝伐单抗实验剂量;3-MA作用48 h时,A549细胞IC10值约为10 mmol/L,故选用10 mmol/L作为3-MA实验剂量。
2.2细胞凋亡情况 流式细胞仪检测示,单用贝伐单抗组细胞凋亡率为(21.82±0.41)%,3-MA组细胞凋亡率为(3.54±0.11)%,二者与对照组(0.92±0.26)%相比,差异均具有统计学意义(均P<0.05)。联合用药组细胞凋亡率较单用贝伐单抗组和3-MA组均有增加,为(36.76±0.87)%(均P<0.05)。
2.3AO及MDC检测细胞自噬情况 用荧光染料AO染色,检测细胞质内酸性膜泡的变化,发现胞质及胞核周围出现红色斑点酸性囊泡。单用贝伐单抗组出现较多自噬空泡,说明贝伐单抗可诱导细胞出现自噬现象;而3-MA组几乎未见自噬空泡;对照组及联用组出现自噬空泡数多于3-MA组,而少于贝伐单抗组,说明3-MA在一定程度上可以抑制贝伐单抗诱导的细胞自噬。见图1。MDC多聚集在自噬空泡中,在细胞核周围可见蓝绿色或黄绿色点状结构。单用贝伐单抗组A549细胞可见细胞中出现大量自噬空泡,说明该组细胞明显发生自噬。而单用3-MA组细胞未见明显自噬空泡,贝伐单抗与3-MA联合组较单用贝伐单抗组细胞相比,自噬空泡有所减少。说明3-MA可以一定程度上抑制贝伐单抗诱导的细胞自噬。见图2。
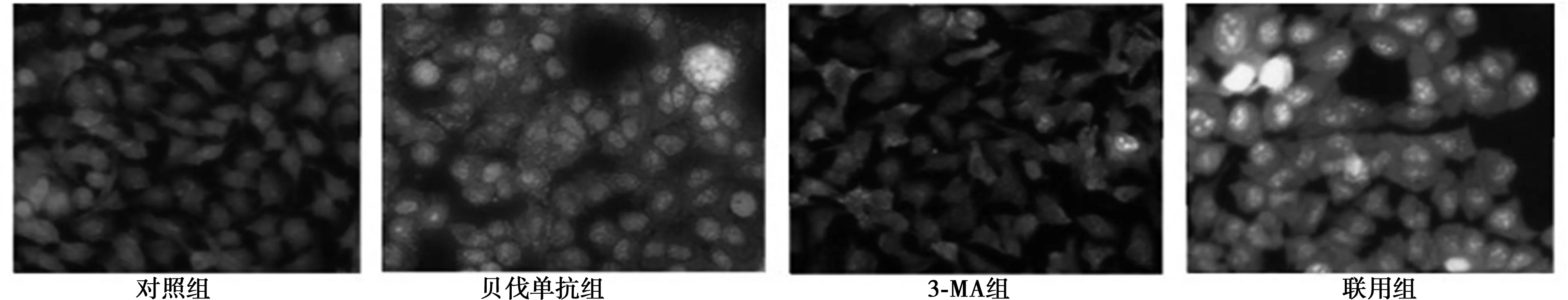
图1 AO检测细胞自噬情况(×400)
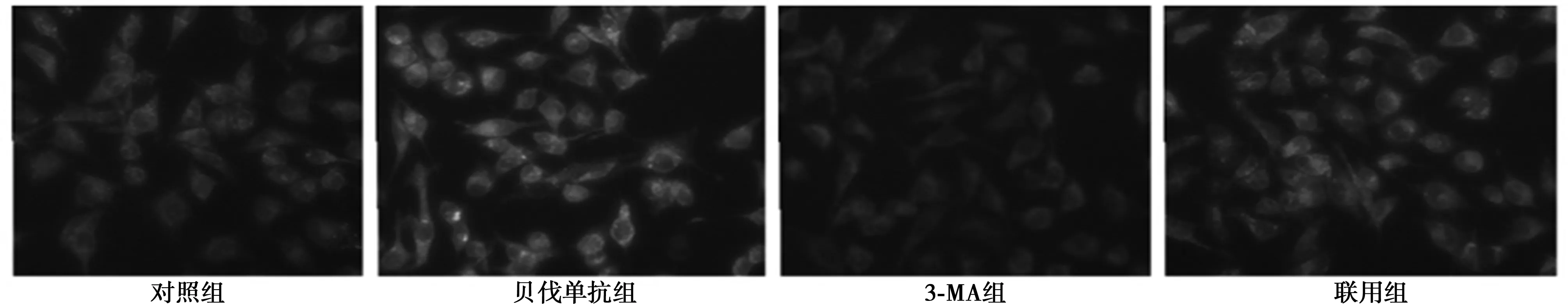
图2 MDC检测细胞自噬情况(×400)
2.4Western 印迹结果 贝伐单抗组Beclin1及LC-3表达较对照组均明显增加,而贝伐单抗与3-MA联合作用组中两种蛋白的表达较单用贝伐单抗组明显减少。MG132作用后,半胱氨酸蛋白酶(Caspase-9)的表达明显增加,而加入3-MA联合作用后,其表达较单用MG132明显增加。见图3。

图3 Western 印迹检测结果
3 讨 论
抗肿瘤血管治疗是目前抗肿瘤治疗的热点,在正常组织中,血管或脉管系统的生成是受到严格调控的,但是,研究表明在大多数人类肿瘤中VEGF表达均上调。血管的生成涉及到血管内皮细胞和其分泌的配体以及各种生长因子之间复杂的相互作用。其中,VEGF是介导血管生成最关键的因子之一。贝伐单抗是一种重组的人类单克隆IgG1抗体,通过抑制人类血管VEGF的生物学活性而起作用。
近年来,自噬作为Ⅱ型程序性死亡已经越来越受到人们的重视。在自噬发生的早期,自噬可作为一种保护机制,使肿瘤细胞避免受到低营养、电离辐射和化疗等所致的损伤而持续生存;而当外部环境较差,肿瘤细胞过度自我吞噬效应时,就会引起自噬性死亡(Ⅱ型程序性死亡),从而抑制肿瘤的发生、发展〔3〕。作为抗肿瘤血管生成药物,贝伐单抗可能存在刺激细胞过度自噬而抑制肿瘤细胞生长,甚至促进其死亡的作用。另据研究〔4〕表明,3-MA作为特异性抑制自噬后通过激活凋亡特异性蛋白Caspase-3诱导肺癌细胞启动程序性细胞死亡。
LC-3是哺乳动物细胞中酵母ATG8(Aut7/Ap98)基因的同源物,定位于前自噬泡和自噬泡膜表面,参与自噬体的形成。LC-3有Ⅰ型和Ⅱ型之分。自噬发生时,Ⅰ型LC-3经泛素样加工修饰过程,与自噬膜表面的磷脂酰乙醇胺(PE)结合,形成Ⅱ型LC-3。LC-3Ⅱ结合并始终位于胞内自噬体的膜上。其含量的多少与自噬泡数量的多少成正比〔5〕。因此LC-3的表达强度与自噬活性密切相关。
本试验AO及MDC后经光学显微镜下观察,均得出贝伐单抗有较弱的促进A549细胞的凋亡作用,其机制可能为使肿瘤细胞过度自噬引起自噬性死亡;且与自噬抑制剂3-MA联用时,较单用贝伐单抗有更强的促细胞凋亡的作用。最后通过蛋白免疫印迹杂交检测微管相关蛋白LC-3及自噬相关蛋白beclin-1的表达变化,再次验证贝伐单抗的促进A549细胞自噬及凋亡的作用。
4 参考文献
1GuoXL,Li D,Sun K,etal.Inhibition of autophagy enhances anticancer effects of bevacizumab in hepatocarcinoma〔J〕.J Mol Med,2013;9(4):473-83.
2孙婷婷, 徐江平.贝伐单抗对耐药鼻咽癌细胞凋亡的影响〔J〕.解放军医学杂志,2008;33(12):1438-40.
3Mathew R,Karantza-wadsworth V,White E.Role of autophagy in caner〔J〕.Nat Rev Cancer,2007;7(12):961-7.
4朱良纲, 杭均彪, 杜海磊,等.自噬在吉西他滨诱导肺癌细胞A549凋亡中的作用及其相关机制〔J〕.中国肿瘤临床,2012;39(10):652-5.
5Mizushima N.Methods for monitoring autophagy〔J〕.Int J Biochem Cell Biol,2004;36(12):2491-502.
