罗格列酮对帕金森病模型小鼠炎症反应和细胞凋亡的影响
2014-09-12魏子峰秦丽娟周洪霞张宇新
张 田 魏子峰 秦丽娟 周洪霞 张宇新
(河北联合大学基础医学院生理学教研室,河北 唐山 063000)
目前,对帕金森病(PD)的治疗仍然采用多巴胺(DA)替代疗法,已知的药物只能起到改善症状的作用,不能延缓疾病的进程和DA能神经元退变,而且长期服用会产生严重的副作用,因此急需找到有效的治疗药物。近年研究显示,炎症反应和细胞凋亡在PD病理过程中可能起了重要作用〔1,2〕。罗格列酮是一种常用的治疗糖尿病药物,文献报道,在神经系统变性疾病中对神经元有保护作用〔3〕。本实验以1-甲基-4-苯基-1,2,3,6四氢吡啶(MPTP)制备小鼠模型,探讨罗格列酮能否减少炎症因子环氧合酶(COX)-2、前列腺素E2(PGE2)和凋亡蛋白半胱氨酸蛋白酶(caspase)-3表达,从而对DA能神经元产生保护作用,以期为PD寻找新的可能治疗途径。
1 材料与方法
1.1实验动物及试剂 雄性健康C57BL/6N 小鼠45只,12~14 周龄,体质量 25~30 g,清洁级,购于北京维通利华公司,自由进食,饮水,室温(25±2)℃,单笼喂养。MPTP(Sigma,USA)、兔抗人COX-2多克隆抗体(福州迈新公司)、兔抗鼠caspase-3多克隆抗体(福州迈新公司)、兔抗鼠PGE2单克隆抗体(Cayman,USA)、预染蛋白Marker(天津灏洋生物公司)、大鼠抗酪酸羟化酶(TH)单克隆抗体(Chemicon,USA)、罗格列酮(英国葛兰素史克公司)、UltraSensitive SP超敏试剂盒(福州迈新公司)。
1.2动物分组和模型制备 实验动物随机分为3组,每组15只。模型组:腹腔注射MPTP(25 mg/kg,生理盐水溶解),1次/d,连续7 d;罗格列酮处理组:在MPTP注射前4 h灌胃给予罗格列酮预处理(4 mg/kg),1次/d,连续7 d;对照组:注射与模型组等量生理盐水。
1.3组织固定、取材和切片 MPTP第7 次注射后12 h ,每组随机取9只小鼠。腹腔麻醉后,经左心室插管用生理盐水(室温)灌注,再用4%的多聚甲醛磷酸盐缓冲液缓慢灌注固定,迅速切取中脑黑质部位脑块,置于4%多聚甲醛后固定48 h(4℃),固定好的脑组织经蒸馏水冲洗、梯度乙醇脱水、二甲苯透明、浸蜡、包埋,包埋后,石蜡切片机做连续冠状切片,片厚5 μm,4℃保存备用。每组15只小鼠中,随机取另外6只进行免疫印迹分析。小鼠麻醉后,迅速断头取脑,分离中脑黑质部分,置入细胞裂解液中,低温匀浆,4℃震荡30 min后,12 000 r/min,4℃离心15 min,取上清液,-80℃保存备用。
1.4免疫组织化学 免疫组织化学显色采用链霉素亲生物素-过氧化酶连接法(SP)法,步骤如下:切片经二甲苯脱蜡、梯度乙醇脱水后,用三乙醇胺缓冲盐水溶液(TBS)(pH 7.4±0.2)洗3次,每次5 min;组织切片进行水浴法抗原修复;降至室温;每张切片加入过氧化氢(25 μl)阻断内源性过氧化物酶;每张切片滴加10%正常山羊血清(25 μl)室温孵育15 min,同一组织相邻切片分别加入兔抗人COX-2多克隆抗体(1∶100),兔抗鼠caspase-3多克隆抗体(1∶300),兔抗鼠PGE2单克隆抗体(1∶300),大鼠抗TH单克隆抗体(1∶300),4℃过夜;加入二抗(生物素标记羊抗兔IgG,1∶150)室温孵育20 min;加入链霉菌抗生物素蛋白-过氧化酶溶液(25 μl)室温孵育20 min,二氨基联苯胺(DAB)显色,自来水冲洗,苏木精复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,光镜下观察。免疫组织化学显色数据,采用CMIAS真彩医学图像自动分析系统进行阳性细胞计数。各组每只动物3张脑片数值相加后取平均值。
1.5免疫印迹 蛋白定量后取4倍体积样品缓冲液,95°C变性10 min。蛋白上样量为每孔30 g,10% SDS-PAGE电泳,将蛋白电转移至硝酸纤维膜上,依分子量大小切取条带,加入封闭液室温下震荡2 h后,取相应条带分别加入兔抗人COX-2多克隆抗体(1∶100),兔抗鼠caspase-3多克隆抗体(1∶300),兔抗鼠PGE2单克隆抗体(1∶300),大鼠抗TH单克隆抗体(1∶400),4℃过夜。室温孵育1 h后;分别加入二抗(生物素标记羊抗兔IgG,1∶500)室温孵育1 h;加入链霉菌抗生物素蛋白-过氧化酶溶液室温下孵育0.5 h;DAB显色,扫描蛋白印迹条带,作定量分析。
1.6行为学检测 为了测定各组小鼠行为学功能改变,本实验采用爬杆实验。具体方法是,MPTP注射7 d后,将一根长55 cm直径0.8 cm的木杆上端缠以纱布以防止打滑,作为实验爬杆。测试时将被测小鼠头向上置于木杆顶端。分别记录小鼠转身时间(T-turn)和完全爬到杆底所需要的时间(T-LA)并作统计学分析。每只小鼠测3次取平均值。爬杆时间参数的延长反应小鼠运动功能损害的程度。
1.7统计学方法 采用SPSS13.0 统计软件进行单因素方差分析及q检验。
2 结 果
2.1免疫组织化学检测 对照组小鼠中脑黑质区偶见COX-2、PGE2和caspase-3阳性细胞, 模型组COX-2、PGE2和caspase-3阳性细胞数量显著增多;经罗格列酮处理后,COX-2、PGE2和caspase-3阳性细胞较模型组降低(P<0.05)。对照组小鼠黑质区可见大量TH阳性神经元,与对照组比较,模型组TH阳性神经元大量丢失,经罗格列酮处理后,TH阳性神经元丢失程度明显减轻(P<0.05)。见表1。
2.2免疫印迹检测 免疫印迹结果显示,对照组仅有微量COX-2、PGE2和caspase-3表达,模型组COX-2、PGE2和caspase-3表达水平升高(P<0.05);经罗格列酮处理后,COX-2、PGE2和caspase-3蛋白表达水平明显下降(P<0.05);模型组TH表达较对照组降低,罗格列酮治疗后出现明显升高(P<0.05)。见表2。
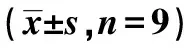
表1 各组小鼠中脑黑质COX-2,PGE2,caspase-3和TH阳性细胞数
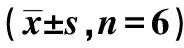
表2 各组小鼠中脑黑质COX-2,PGE2,caspase-3和TH蛋白表达水平
2.3行为学检测 MPTP注射7 d后,模型组小鼠出现典型PD样症状,表现为竖毛、翘尾、震颤和运动变缓等特征。爬杆试验中,与对照组小鼠比较,出现爬杆能力下降,爬杆所需用时间显著延长。罗格列酮处理后,小鼠运动功能得到一点程度改善,表现为爬杆时间明显缩短(P<0.05)。见表3。
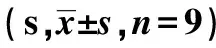
表3 罗格列酮对不同组小鼠爬杆时间的影响
3 讨 论
PD是一种常见于中老年人中枢神经系统退变性疾病,其病理改变主要为中脑黑质区DA能神经元变性坏死,DA合成减少,进而抑制乙酰胆碱的功能降低,两者失衡从而出现“震颤麻痹”。迄今为止,病因及发病机制不详。
研究表明,细胞凋亡是PD发病的重要机制之一〔4〕。caspase-3是细胞凋亡过程的最终执行者,在DA能神经元变性中可能起重要作用〔5〕。COX-2是炎症介质PGE2合成的限速酶,有研究显示,COX-2及其介导的炎症介质PGE2可能参与DA能神经元丢失〔6〕。本实验采用MPTP制备PD小鼠模型,于MPTP注射后第7天观察了小鼠黑质区COX-2、PGE2和凋亡因子caspase-3的表达及TH神经元丢失情况。免疫组化结果显示,模型组小鼠黑质区TH阳性神经元显著丢失,同时伴有COX-2、PGE2和caspase-3大量表达,而对照组未出现上述变化;免疫印迹检测,结果也显示了同样的趋势。这些现象表明,DA能神经元丢失可能与炎症反应及细胞凋亡存在密切联系。
目前,对PD的治疗仍然是控制症状,左旋多巴是治疗PD的首选药物,但它并不能阻止病程进展,长期应用会使疾病恶化。文献报道,罗格列酮能减少脊髓损伤后神经细胞凋亡,促进神经功能的恢复〔7〕,在亨廷顿疾病中,罗格列酮可防止线粒体功能障碍,对神经元起到保护作用〔8〕。最近研究发现,在MPTP所致PD慢性动物模型中,罗格列酮可以通过降低小胶质细胞中过氧化物酶体增殖物激活受体(PPAR)-γ表达水平从而抑制炎性因子肿瘤坏死因子(TNF)-α产生〔9〕。由于MPTP选择性破坏黑质DA能神经元导致黑质纹状体神经末梢DA递质大量减少,从而出现PD样症状。
综上,在本实验条件下,MPTP可诱导模型动物中脑黑质COX-2、PGE2和caspase-3的高表达,最终导致DA能神经元变性丢失;罗格列酮可抑制COX-2、PGE2和caspase-3表达,使DA能神经元变性丢失现象有所减轻,从而发挥一定的神经保护作用。
4 参考文献
1Orr CF,Rowe DB,Mizuno Y,etal.A possible role for humoral immunity in the pathogenesis of Parkinson′s disease〔J〕.Brain,2005;128(11):2665-74.
2Mori T,Hayashi T,Su TP,etal.Compromising sigma-1 receptors at the ER renders cytotoxicity to physiologically relevant concentrations of dopamine in a NF-κB/Bcl-2-dependent mechanism:potential relevance to Parkinson′s disease〔J〕.J Pharmacol Exp Ther,2012 ;341(3):663-71.
3Escribano L,Simón AM,Gimeno E,etal.Rosiglitazone rescues memory impairment in Alzheimer′s transgenic mice:mechanisms involving a reduced amyloid and tau pathology〔J〕.Neuropsychopharmacology,2010;35(7):1593-604.
4Rodríguez-Blanco J,Martín V,García-Santos G,etal.Cooperative action of JNK and AKT/mTOR in 1-methyl-4-phenylpyridinium-induced autophagy of neuronal PC12 cells〔J〕.J Neurosci Res,2012;90(9):1850-60.
5Lee JE,Kang JS,Ki YW,etal.Fluazinam targets mitochondrial complex I to induce reactive oxygen species-dependent cytotoxicity in SH-SY5Y cells〔J〕.Neurochem Int,2012; 60(8):773-81.
6Wang Q,Zheng H,Zhang ZF,etal.Ginsenoside Rg1 modulates COX-2 expression in the substantia nigra of mice with MPTP-induced Parkinson’s disease through the P38 signaling pathway〔J〕.J South Med Univ,2008; 28(9):1594-8.
7张 钦,吴继彬,黄 晨,等.罗格列酮对大鼠脊髓损伤后神经细胞凋亡的影响〔J〕.山东医药,2010;50(22):35-6.
8Quintanilla R A,Jin YN,Fuenzalida K,etal.Rosiglitazone treatment prevents mitochondrial dysfunction in mutant huntingtin-expressing cells - Possible role of peroxisome proliferator-activated receptor-gamma (PPAR gamma) in the pathogenesis of Huntington disease〔J〕.J Biol Chem,2008;283(37):25628-37.
9Carta AR,Frau L,Pisanu A,etal.Rosiglitazone decreases peroxisome proliferator receptor-gamma levels in microglia and inhibits TNF-α production:new evidences on neuroprotection in a progressive Parkinson′s disease model〔J〕.Neuroscience,2011;194(2):250-61.
