转录因子SNAI1与卵巢癌组织恶性表型之间的关系
2014-09-12帅智峰于秀文温秋婷王玉楼
帅智峰 刘 婷 于秀文 温秋婷 王玉楼
(齐齐哈尔医学院病理学系,黑龙江 齐齐哈尔 161006)
卵巢癌浸润转移是治疗失败和患者死亡的重要原因,迄今还没有满意的治疗方法。锌指蛋白SNAI1是胚胎发育中促进中胚层和神经嵴形成的非常重要的转录因子。SNAI1通过抑制E-钙黏蛋白(E-cadherin)的表达诱导上皮间质转化(EMT)的发生,导致癌细胞丧失上皮特性,富于侵袭和转移特性〔1〕。目前尚无关于SNAI1在卵巢肿瘤中表达的比较研究。本研究用免疫组织化学检测83例卵巢囊腺瘤、不同分化程度的卵巢癌组织中SNAI1 和E-cadherin的表达情况,探讨SNAI1在卵巢癌中表达的意义。
1 材料和方法
1.1标本来源 收集齐齐哈尔医学院病理诊断中心2008年9月1日至2011年3月1日存档的卵巢上皮性肿瘤组织标本,共83例。全部病例由病理专家复诊并依据最新《WHO肿瘤病理学和遗传学分类》进行病理组织学分类及分期。其中卵巢囊腺瘤33例,高分化卵巢癌35例,低分化卵巢癌15例。患者年龄23~ 68岁,中位年龄49岁,术前均未接受化疗和放疗。所有组织10% 福尔马林固定,常规石蜡包埋,3 μm厚切片, 免疫组织化学二步法进行检测。
1.2试剂 SP法检测试剂盒和E-cadherin 鼠抗人多克隆抗体购自北京中杉公司;SNAI1兔抗人多克隆抗体购自美国U S Biological公司;人卵巢癌细胞系HO8910购自中科院上海生物科学研究所细胞库;重组腺病毒表达载体pAdEasy-SNAⅡ由我校药物研究所协助构建。
1.3SP法检测SNAI1、E-cadherin的表达 免疫组织化学方法按试剂盒说明书操作。SNAI1抗体的工作浓度为1∶200,E-cadherin抗体的工作浓度时1∶50,0.01 mol/L柠檬酸盐缓冲液抗原修复,DAB显色,苏木精复染,中性树胶封固,PBS取代一抗作阴性对照。
1.4结果判断标准
1.4.1SNAI1 细胞核出现棕黄色颗粒为阳性。①强度分数标准:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。②随机选择10个高倍视野,每个视野计算100个肿瘤细胞,共计数1 000个肿瘤细胞,计算阳性细胞百分率:1%~<25%为1分,25%~<50%为2分,50%~<75%为3分,≥75%为4分。两项得分相乘,4~7分为“+”,8~11分为“”,满12分为“”,“+~”为阳性表达。
1.4.2E-cadherin 在细胞膜及少许细胞质出现棕黄色颗粒为阳性。按着色强度及范围分为4级:阳性细胞数0~10%为“-”,阳性细胞数>10%~ 50%为“+”,阳性细胞数>50%~ 90% 为“”,阳性细胞数>90%为“”。
1.5重组腺病毒表达载体pAdEasy-SNAI1 感染HO8910人卵巢癌细胞 HO8910细胞接种到6孔板培养至80%~90%融合,更换新鲜培养基进行重组腺病毒转染。实验组每孔加入10 μl pAdEasy-SNAI1病毒浓缩液,对照组加入10 μl空载腺病毒pAdEasy-GFP 浓缩液。转染72 h后,检测目的蛋白表达水平,确认转染效率。
1.6Western印迹法检测HO8910细胞SNAI1蛋白,上皮性标记物E-cadherin和间叶标记物Vimentin的表达 细胞裂解缓冲液裂解HO8910细胞提取总蛋白,取等量蛋白质进行凝胶电泳分离,分离后的蛋白质转移至PVDF膜,并以5%脱脂奶粉封闭2 h。加入1∶500 稀释兔抗人SNAI1蛋白多克隆抗体、小鼠抗人E-cadherin单克隆抗体及1∶300 稀释小鼠抗人Vimentin单克隆抗体、小鼠抗人β-actin 单克隆抗体。4℃过夜后,加辣根过氧化物酶标记的羊抗鼠、羊抗兔二抗(1∶2 000 稀释),37℃ 孵育2 h,PBS液洗膜后暗室内加Western Blue显影。
1.7划痕实验检测HO8910细胞的运动能力 将转染目的基因后的HO8910细胞接种到6 孔板中,待细胞单层铺满后,10 μl移液器枪头在6 孔板中划线,划痕面积约为10 mm×1 mm,无菌PBS洗去细胞碎屑,更换培养基继续培养,分时段观察,于0、12、24、48 h在倒置显微镜下照相。
1.8统计学方法 采用SPSS13.0软件进行Kruskal-Wallis Test和Spearman相关分析。
2 结 果
2.1SNAI1 表达情况 免疫组化结果显示,SNAI1表达主要定位在细胞核内(图1),呈弥漫分布。SNAI1在卵巢囊腺瘤、高分化卵巢癌及低分化卵巢癌组织的表达明显不同(χ2=50.496,P=0.000;χ2=15.051,P=0.014),以低分化卵巢癌中的表达最强。见表1。
2.2E-cadherin 表达情况 E-cadherin在胞膜上呈均质、连续线状表达,E-cadherin在卵巢囊腺瘤、高分化卵巢癌、低分化卵巢癌组织的表达明显不同(χ2=32.949,P=0.000;χ2=14.489,P=0.029),见表1,图2。

表1 SNAI1、E-cadherin在卵巢囊腺瘤、高分化卵巢癌和低分化卵巢癌中的表达(n=83)

卵巢囊腺癌 高分化卵巢癌 低分化卵巢癌
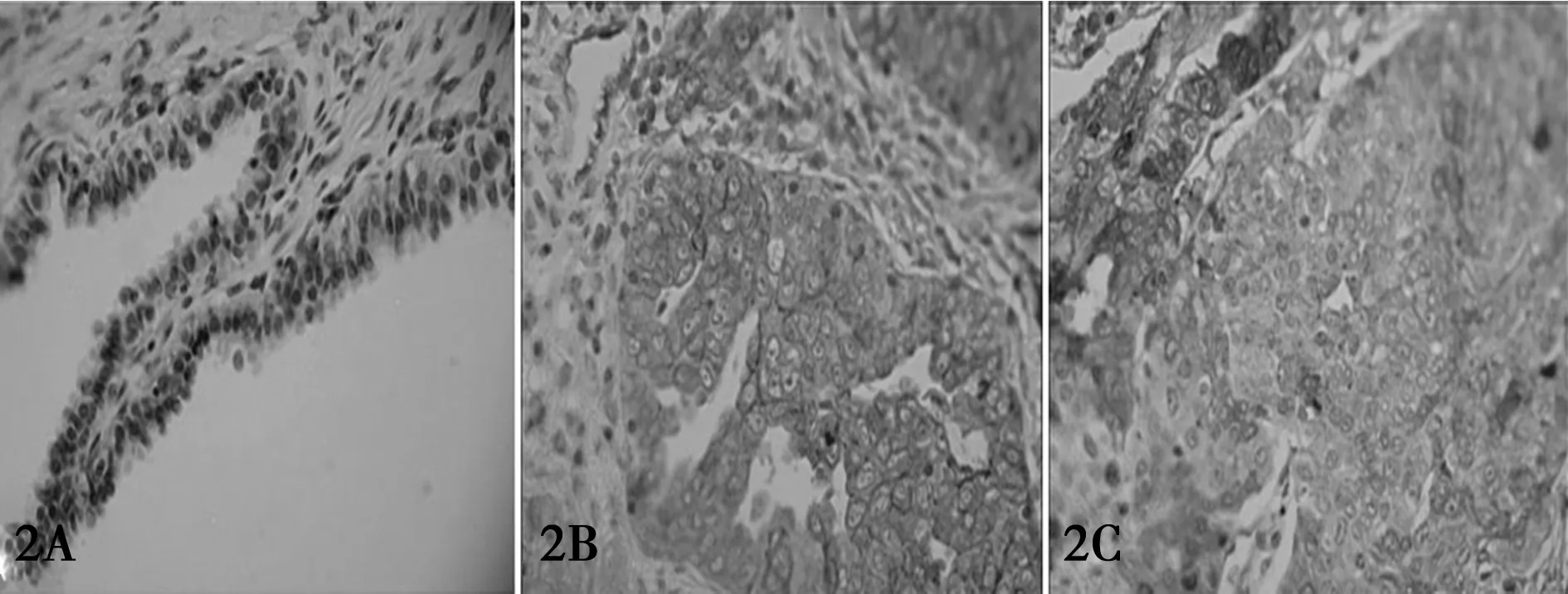
卵巢囊腺癌 高分化 卵巢组织
2.3SNAI1、E-cadherin相关性分析 在卵巢囊腺瘤、高分化卵巢癌及低分化卵巢癌组织的中的SNAI1与E-cadherin的表达呈显著负相关关系(r=-0.342,P=0.000)。
2.4过表达SNAI1对HO8910细胞上皮/间叶标记物表达的影响 Western印迹法检测蛋白水平:以兔抗人SNAI1蛋白多克隆抗体作为检测抗体,检测SNAI1蛋白在HO8910细胞中的表达,实验组SNAI1蛋白表达水平显著增强,明显高于对照组(P<0.01),实验组E-cadherin较对照组表达水平显著降低,Vimentin表达水平增高见图3,表2。

表2 SNAI1、E-cadherin、Vimentin在HO8910细胞中的表达情况
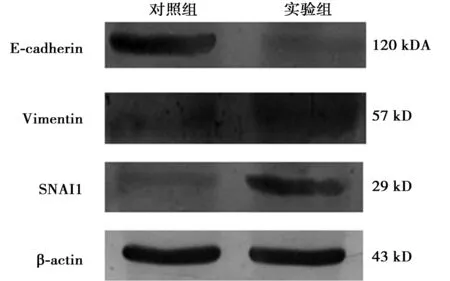
图3 Western印迹法检测SNAI1、E-cadherin、Vimentin在HO8910细胞中的表达
2.5过表达SNAI1对HO8910细胞运动能力的影响 细胞划痕后每12 h倒置显微镜下进行1次观察照相,各时间点转染pAdEasy-SNAI1的HO8910细胞划痕愈合速度均快于对照组,实验组细胞运动能力更强,运动速度更快。见图4。
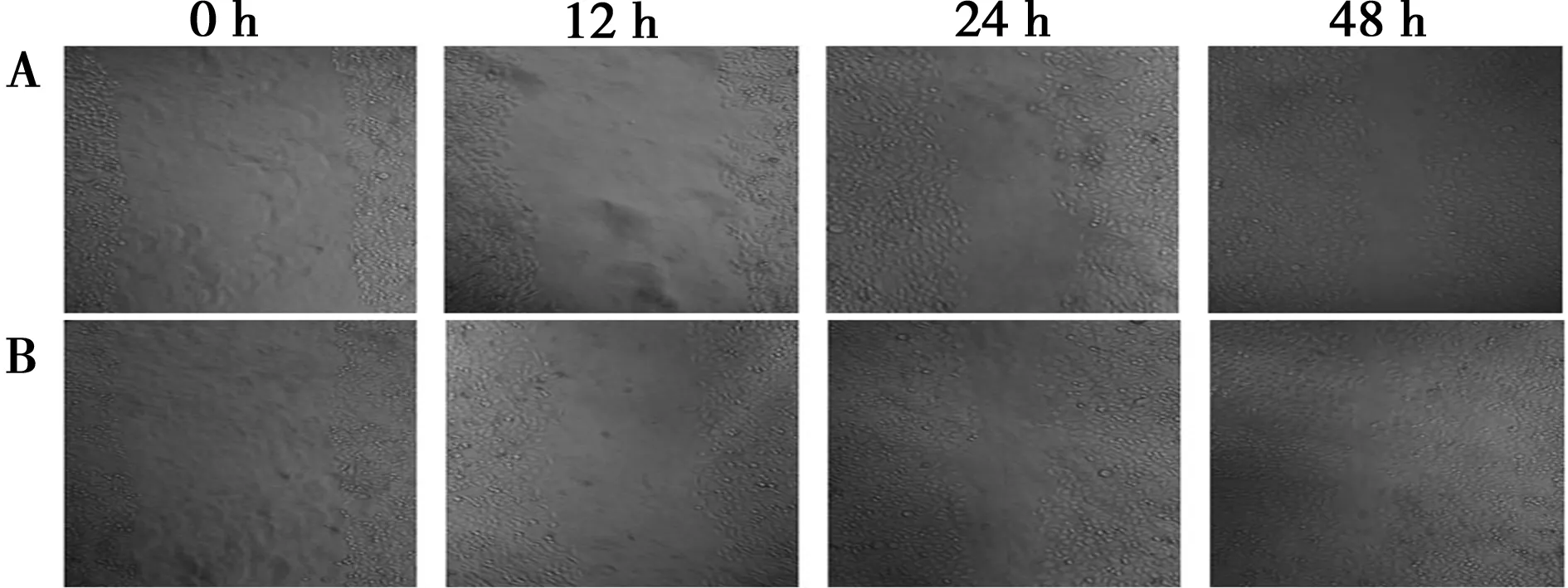
A对照组;B实验组
3 讨 论
SNAI1是锌指转录因子家族成员之一,属于转录抑制因子超家族,它受到多种信号通路的调控,是参与EMT调控的重要转录因子。SNAI1诱导的EMT过程在胚胎发育、创伤愈合、细胞分化、细胞迁移、肿瘤转移等生理、病理过程中起重要作用〔2〕。目前,普遍认为SNAI1通过诱导EMT过程促进肿瘤细胞侵袭和转移,在肿瘤转移的初期阶段发挥重要作用。
SNAI1是snail超家族中最早被发现的,该家族由一个高度保守的羧基末端及一个高度可变的氨基末端构成,其家族成员在结构上的差异主要表现在中间P-S富集区域。同时snail的二级结构包括两个β-折叠、一个α-螺旋和一个DNA连接凹槽,DNA连接凹槽可特异性的与含6个核心碱基(CAGGTG/CACCTG)的结合位点结合,该结合位点被称为E-box〔3〕。Larue等〔4〕描述,在中胚层与神经嵴的前体中,SNAI1通过下调E-cadherin而触发上皮细胞向间充质细胞的转变,E-cadherin是负责细胞上皮表型如细胞极性、细胞和基质的黏附能力的主要成分。SNAI1通过与E-cadherin启动子区域的E-box结合,直接抑制E-cadherin表达,诱导EMT发生。
Blanco等〔5〕报道乳腺癌组织中SNAI1表达与肿瘤病理分级和淋巴结转移相关。类似的报道还见于对胰腺癌和结直肠癌和肝癌的研究中〔6~8〕。本研究免疫组化结果提示通过检测卵巢癌的SNAI1水平,可以作为卵巢癌恶性程度和估计预后的指标。
SNAI1通过直接抑制E-cadherin的表达促进EMT的发生。发生EMT的细胞主要表现为细胞极性的丧失、细胞变梭、伸出丝状伪足并获得侵袭运动能力;在分子生物学方面则表现为上皮标志物缺失或减弱,如E-cadherin,而获得间质标志物,如Vimentin的表达增加〔9,10〕。E-cadherin 是细胞黏附分子钙黏蛋白家族中的重要成员,广泛分布于上皮细胞中,E-cadherin是负责细胞上皮表型如细胞极性、细胞和基质的黏附能力的主要成分。目前认为E-cadherin 表达丢失是EMT 最显著特征〔11〕。
本研究证实转录因子SNAI1在促进卵巢癌侵袭转移的病理生理过程中发挥了重要的作用,SNAI1有可能成为卵巢癌治疗的有效靶点。
4 参考文献
1Olmeda D,Moreno-Bueno G,Flores JM,etal.SNAI1 is required for tumor growth and lymph node metastasis of human breast carcinoma MDA-MB-231 cells 〔J〕.Cancer Res,2007;67(24):11721-31.
2Micalizzi DS,Ford HL.Epithelial-mesenchymal transition in development and cancer〔J〕.Future Oncol,2009;5(8):1129-43.
3Ikenouchi J,Matsuda M,Furuse M,etal.Regulation of tight junctions during the epithelium-mesenchyme transition:direct repression of the gene expression of claudins/occludin by Snail〔J〕.J Cell Sci,2003;116(Pt 10):1959-67.
4Larue L,Bellcosa A.Epithelial-mesenchymal transition in development and cancer:role of phosphatidylinositol 3’kinase/AKT pathways〔J〕.Oncogene,2005;24(50):7443-54.
5Blanco MJ,Moreno-Bueno G,Sarrio D,etal.Correlation of Snail expression with histological grade and lymph node status in breast carcinomas〔J〕.Oncogene,2002;21(20):3241-6.
6Yin T,Wang CY,Liu T,etal.Expression of Snail and E-cadherin in pancreatic carcinoma and clinical significance thereof〔J〕.Zhonghua Yi Xue Za Zhi,2006;86(40):2821-5.
7Miyoshi A,Kitajima Y,Kido S,etal.Snail accelerates cancer invasion by upregulating MMP expression and is associated with poor prognosis of hepatocellular carcinoma〔J〕.Br J Cancer,2005;92(2):252-8.
8Liu YN,Lee WW,Wang CY,etal.Regulatory mechanisms controlling human E-cadherin gene expression〔J〕.Oncogene,2005;24(56):8277-90.
9Ahmed S,Nawshad A.Complexity in interpretation of embryonic epithelial-mesenchymal transition in response to transforming growth factor-beta signaling〔J〕.Cells Tissues Organs,2007;185(1-3):131-45.
10Zeisberg M,Neilson EG.Biomarkers for epithelial-mesenchymal transitions〔J〕.J Clin Invest,2009;119(6):1429-37.
11Kang Y,Massague J.Epithelial-mesenchymal transitions:twist in development and metastasis〔J〕.Cell,2004;118(3):277-9.
