子宫内膜样腺癌患者血清及组织人附睾蛋白表达及其临床意义
2014-09-12张丹凤孙盛梅窦鹏挥肖晓超宋继荣胡玉红
张丹凤 孙盛梅 窦鹏挥 肖晓超 宋继荣 胡玉红
(佳木斯大学附属第一医院妇产科,黑龙江 佳木斯 154002)
子宫内膜癌分子发生机制尚不清楚。Galgano等〔1〕应用mRNA杂交及免疫组织化学检测发现人附睾蛋白(HE)4在子宫内膜癌中的阳性率为90%,Huhtinen等〔2〕检测发现HE4在子宫内膜癌中的表达率明显高于健康对照组,迄今为止,子宫内膜癌没有有效的监测指标。HE4在子宫内膜癌组织中的研究在国内尚未见报道,本研究旨在通过对正常女性及子宫内膜样癌患者HE4血清及蛋白的测定,分析其与临床病理及预后的相关性。
1 材料与方法
1.1研究对象 2009年9月至2010年3月我院妇科经病理检查确诊的60例子宫内膜癌患者为子宫内膜癌组,年龄34~84岁,平均年龄(54.19±11.46)岁,按照2003年国际妇产科联盟(FIGO)临床分期标准:Ⅰ期42例,Ⅱ期12例,Ⅲ期6例。绝经前49例,绝经后11例。组织分级G1:39例,G2~G3:21例。选择我院同期正常子宫内膜组织18例(子宫肌瘤、子宫脱垂患者),其中增生期10例,分泌期8例,为免疫组化对照组;健康体检女性18人为血清对照组。子宫内膜非典型增生30例(轻度12例,中度 10例,重度8例),年龄31~63岁,平均(48.68±11.38)岁。子宫内膜癌组术前均未应用任何激素治疗,未行化疗或放疗。3组采血时均非月经期,并已排除关节炎、肝炎、近期感染、放化疗及雌激素服用史。3组年龄无统计学差异(χ2=5.53,P=0.061)。所有子宫内膜癌患者血液标本取自术前2~3 d及术后1个月,子宫内膜增生组取治疗前空腹肘静脉全血3 ml,置于未加抗凝剂的真空采血管中,标本采集后剔除溶血标本,保存在4℃冰箱,3 d内3 000 r/min离心,10~15 min后取上清,分装在聚丙烯EP管内,冻存在-80℃冰箱待测。
1.2血清HE4检测 血清HE4 ELISA试剂盒为瑞典康乃格产品,用酶联免疫吸附试验(ELISA双抗体夹心法)检测。
1.3参考值和阳性判断值 血HE4试剂盒提供的参考值为0~150 pmol/L,>150 pmol/L判断为阳性。
1.4方法 HE4试剂盒(武汉万德力生化试剂技术有限公司),DAB 显色试剂盒为美国 DA-KO 公司产品,购自上海基因公司。采用 EnVision两步法进行免疫组化染色。所有标本均经 10%甲醛溶液固定,常规脱水,石蜡包埋,4 μm 厚连续切片,常规脱蜡至水,高压热修复抗原,DAB 显色。以PBS 代替一抗作空白对照,用已知阳性片作为阳性对照。具体步骤参照试剂盒说明书进行,HE4蛋白表达于腺腔面细胞膜棕黄色颗粒极性表达,视为正常表达,去极性、胞核、胞质中出现棕黄色颗粒视为阳性;对综合染色强度和阳性肿瘤细胞的百分比进行分级。
1.5统计学处理 应用 SPSS13.0软件进行χ2检验。血清HE4水平呈非正态分布,故以中位数及范围表示总体水平,组间比较用秩和检验。相关性用Spearman等级分析。
2 结 果
2.1HE4在3组中及子宫内膜癌不同分期的表达水平 子宫内膜癌组血清HE4 的阳性率显著高于子宫内膜不典型增生组和正常子宫内膜组(P<0.001) ,而子宫内膜不典型增生组和正常子宫内膜组阳性率差异无统计学意义(P= 0.35)。见表1,图1。血清HE4在子宫内膜癌G1期组〔85.25(77~590.2)pmol/L〕与G2+G3组〔156.85(55~604.8)pmol/L〕差别显著(P<0.000 1)。随着临床分期增加HE4水平增加。
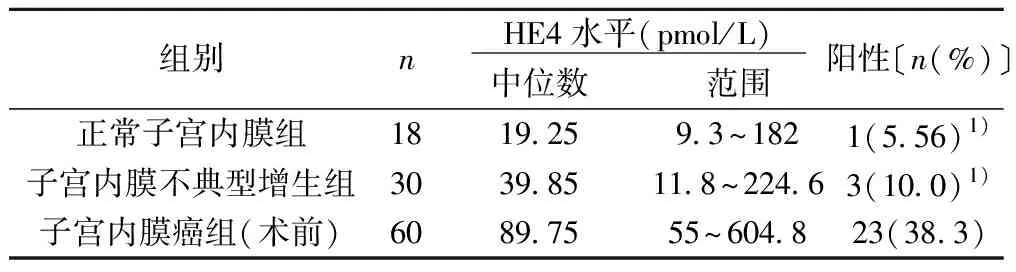
表1 3组HE4血清表达水平
2.2不同子宫内膜病变组织中HE4蛋白表达 HE4蛋白染色位于细胞质,在相邻的间质细胞无阳性染色。子宫内膜癌组显示中度或强阳性染色,正常子宫内膜组大部分显示弱阳性染色,HE4 蛋白阳性信号弥漫出现在瘤细胞胞质中,失去极性,且强度增加,呈异质表达(图1)。子宫内膜癌组HE4 蛋白表达〔44例(73.3%)〕高于正常子宫内膜组〔3例(16.7%)〕 (P=0.016)。正常子宫内膜组与不典型增生内膜组〔11例(36.7%)〕差异无显著性。子宫内膜样腺癌组血清HE4阳性率显著高于该组组织 HE4 阳性表达率(P<0.05),见表2。
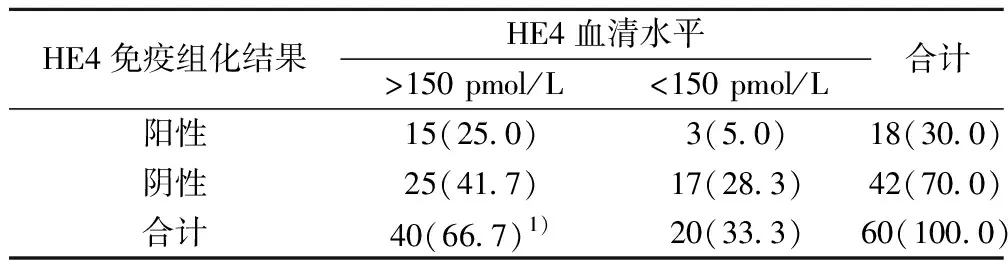
表2 子宫内膜样腺癌患者血清与组织中HE4 表达〔n(%)〕
2.3子宫内膜癌患者术前血清中HE4的表达水平与不同临床病理特征的关系 子宫内膜癌组术前血清HE4浓度与FIGO分期、组织分期的提高和肌层浸润加深、细胞冲洗液是否阳性呈正相关(P<0.05);与HE4组织表达、淋巴结转移、CA125浓度、绝经否无相关关系(P>0.05)。见表3。
2.4HE4在子宫内膜癌组术前、术后血清中表达水平的变化 子宫内膜癌组术后血清中HE4水平〔20.12(4.67~106.38)pmol/L〕明显低于术前(Z=-4.98,P=0.001 6)。

表3 子宫内膜癌患者术前血清HE4表达水平与不同临床病理特征的关系
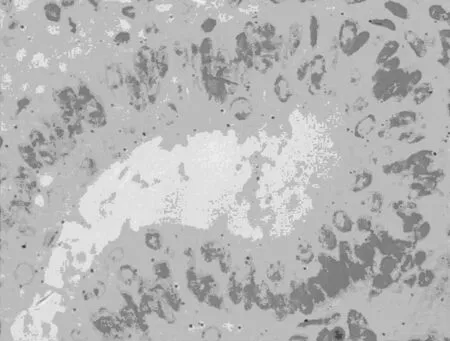
正常子宫内膜组
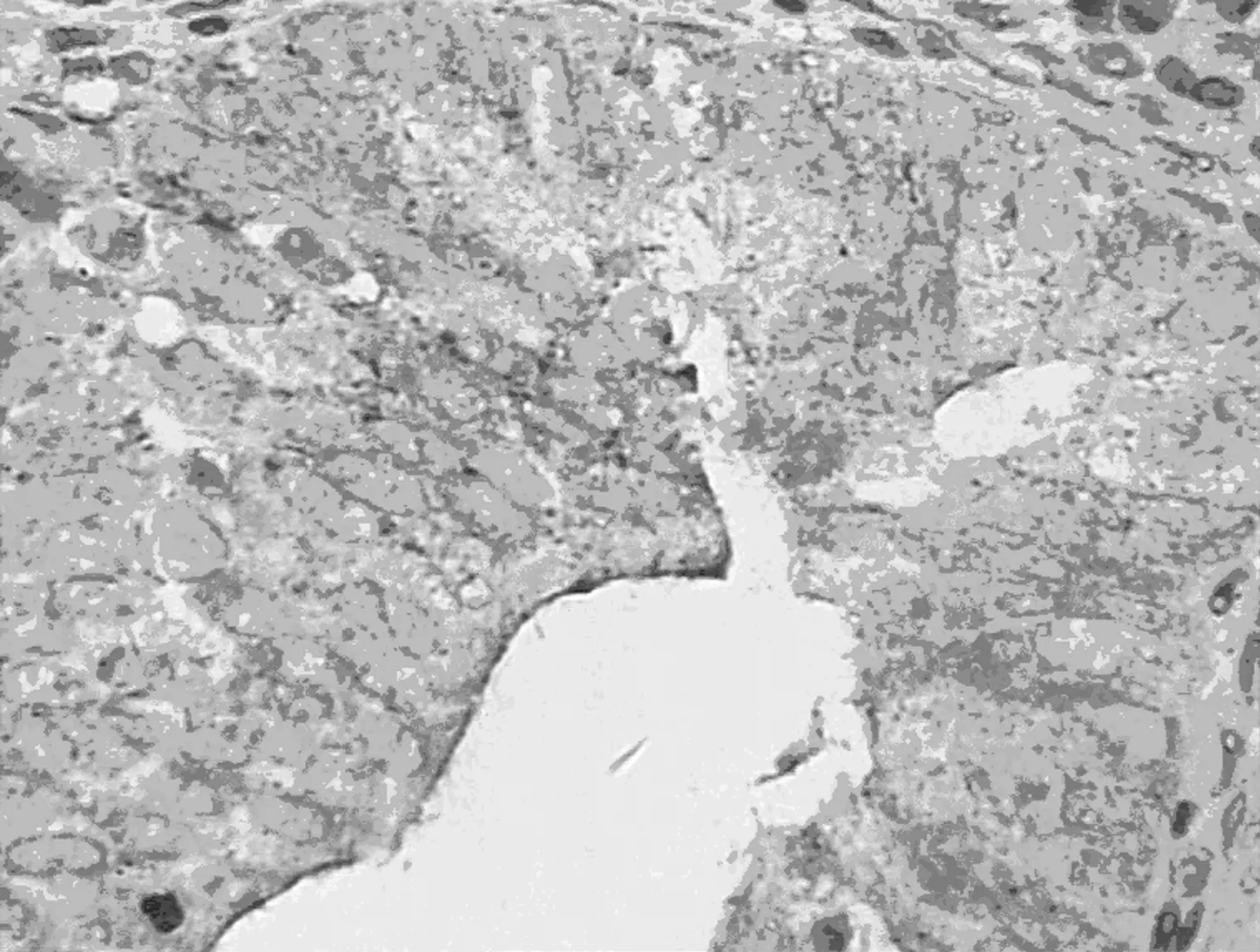
子宫内膜不典型增生组

子宫内膜癌组G1期
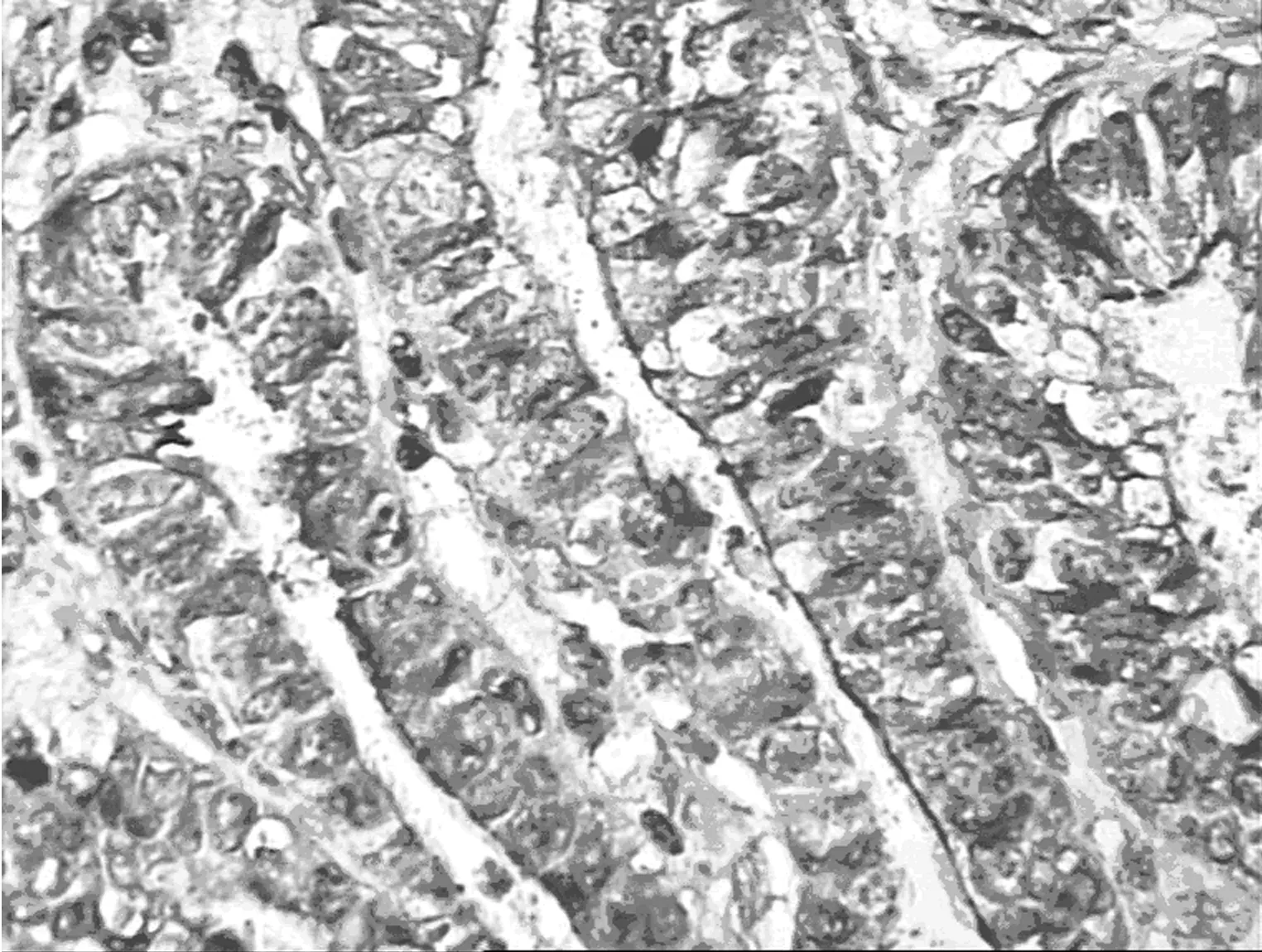
子宫内膜癌组G2期
3 讨 论
子宫内膜癌是女性生殖道最常见的三大恶性肿瘤之一,是原发于子宫内膜腺上皮的恶性病变,其中多数来源于内膜腺体的腺癌。在我国占女性恶性肿瘤的7%,占女性生殖道恶性肿瘤的20%~30%,欧美等发达国家占生殖道恶性肿瘤的首位,多发病于老年妇女,但近些年有低龄化的趋势,并且5年生存率也逐年降低,早期发现和早期治疗能极大地提高5年生存率,改善预后,因此子宫内膜癌的早期诊断对有高危因素的人群意义更重大,尤其是严重肥胖、糖尿病、乳腺癌术后长期口服他莫西芬的患者。HE4是Kirchhoff等〔3〕1991年从人附睾上皮内发现的。Galgano等〔1〕研究发现HE4主要分布于生殖系统上皮如附睾、曲细精管、输精管上皮、输卵管上皮和子宫内膜,子宫内膜癌组织中90%HE4表达都是强阳性的,并且与组织病理类型无关,这一发现提示HE4可能是子宫内膜癌的标记物,Brennan等〔4〕研究也证实这一点。
本研究HE4从组织蛋白水平及血清水平分别检测结果与国外的研究基本一致〔5,6〕。Huhtinen等〔2〕检测发现子宫内膜癌患者血清HE4中位数(99.2 pmol/L)明显高于健康对照(P<0.001)。Moore等〔7〕检测了171例子宫内膜癌患者的术前血清HE4水平,发现健康对照组血清HE4中位数是35.4(18.0~127.8)pmol/L,子宫内膜癌患者血清HE4中位数是71.5(1.1~4 062.7)pmol/L,差异有统计学意义。本实验研究发现HE4在子宫内膜癌组织中高表达,与正常组及子宫内膜不典型增生组有显著差异,与Drapkin等〔8〕研究结果一致。但与血清相应样本表达不完全一致,血清HE4表达阳性率明显高于组织。可能与样本量小或肿瘤组织中的不同成分干扰影响有关,但血清学样本HE4在子宫内膜癌早期即明显升高,说明血清HE4水平可以用于子宫内膜癌的早期辅助诊断。FIGO分期是影响子宫内膜癌患者预后的明确因素,本研究说明HE4可能促进细胞向恶性转化,是一个逐渐积累渐进的过程,提示HE4可能与子宫内膜癌的发生发展有关,检测子宫内膜癌中HE4的表达,有助于对具有进一步恶变倾向的子宫内膜病变进行早期诊断,早期治疗。血清HE4水平高低可在一定程度上用于术前评估及反映患者的预后,说明HE4可以作为评估预后的一个指标,这与Angioli 等〔9〕研究结果一致,应进一步确定其检测阳性区间范围指导临床。同时血清HE4水平检测可以用于子宫内膜癌疗效评价。术后随访中如果发现HE4升高应该考虑子宫内膜癌复发,HE4是否能作为一个早期发现复发的客观指标还需要进一步验证。
4 参考文献
1Galgano MT,Hampton GM, Frierson HF Jr.Comprehensive analysis ofHE4 expression in normal and malignant human tissues〔J〕.Mod Pathol,2006;19(6):847-53.
2Huhtinen K, Suvitie P,Hiissa J,etal.Serum HE4 concentration differentiates malignant ovarian tumours from ovarian endometriotic cysts〔J〕.Br J Cancer,2009;100(8):1315-9.
3Kirchhoff C,Habben I,Ivell R,etal. A major human epididymis-specific cDNA encodes a protein with sequence homology to extracellular proteinase inhibitors〔J〕.Biol Reprod,1991;45(2):350-7.
4Brennan DJ, Hackethal A, Metcalf AM.Serum HE4 as a prognostic marker in endometrial cancer--a population based study〔J〕.Gynecol Oncol,2014;132(1):159-65.
5Kalogera E,Scholler N,Powless C,etal.Correlation of serum HE4 with tumor size and myometrial invasion in endometrial Cancer〔J〕.Gynecol Oncol,2012;124(2):270-5.
6Bignotti EI, Ragnoli M, Zanotti L,etal.Diagnostic and prognostic impact of serum HE4 detection in endometrial carcinoma patients〔J〕.Br J Cancer,2011;104(9):1418-25.
7Moore RG,Brown AK,Miller MC,etal. Utility of a novel serum tumor biomarker HE4 in patients with endometrioid adenocarcinoma of the uterus〔J〕.Gynecol Oncol,2008;110(2):196-201.
8Drapkin R, von Horsten HH,Lin Y,etal. Human epididymis protein 4 (HE4) is a secreted glycoprotein that is overexpressed by serous and endometrioid ovarian carcinomas〔J〕.Cancer Res,2005;65(6):2162-9.
9Angioli R, Miranda A, Aloisi A,etal.A critical review on HE4 performance in endometrial cancer:where are we now〔J〕.Tumour Biol,2014;35(2):881-7.
