乙型肝炎病毒相关肝硬化的临床诊断、评估和抗病毒治疗的综合管理*
2014-09-11科技部十二五国家科技重大专项联合课题组专家
科技部“十二五”国家科技重大专项联合课题组专家
一、背景
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染是肝硬化的重要原因。研究显示,有效抑制HBV复制可改善肝纤维化[1-2],延缓或阻止代偿期肝硬化向失代偿期进展,阻止失代偿期肝硬化患者病情进一步恶化,减少门静脉高压及其相关并发症的发生[3-6],延长患者生存期[3-4]。因此,有效的抗病毒治疗对改善疾病临床结局具有重要意义[7],也是目前HBV相关肝硬化整体治疗策略中的一个重要组成部分。近年来,我国、亚太、欧洲、美国肝病学会更新的慢性乙型肝炎诊治共识或指南均明确指出应给予HBV相关肝硬化患者积极、有效的抗病毒治疗。然而,目前各国共识或指南中提出的抗病毒治疗意见比较简单,难以完全满足临床实践的需求。为此,课题组专家在系统总结国内外研究进展的基础上,按照循证医学原则制订本共识,旨在帮助临床医师对HBV相关肝硬化进行规范化的临床诊断、评估和抗病毒治疗,使更多患者获益。
二、流行病学
HBV相关肝硬化是慢性HBV感染的重要临床结局。据世界卫生组织(WHO)估算,2002年全球死于肝硬化的患者中约有30%为HBV相关肝硬化[8]。总体而言,慢性HBV感染进展为肝硬化的5年累积发生率为8%~20%。一项纳入684例慢性乙型病毒性肝炎(chronic hepatitis B, CHB)患者的前 瞻性研究显示,肝硬化年发病率约为2.1%, HBeAg持续阳性者发病率更高,达到3.5%[9]。
持续高病毒载量是发生肝硬化的主要危险因素,与肝硬化累积发生率呈正相关,可独立预测肝硬化发生。慢性HBV感染者进展为肝硬化的其他危险因素包括:免疫状态(反复或持续的免疫清除)、男性、年龄>40岁、嗜酒、合并丙型肝炎病毒(hepatitis C virus, HCV)、丁型肝炎病毒(hepatitis D virus, HDV)或人类免疫缺陷病毒(human immuno-deficiency virus, HIV)感染等[10-14]。西方研究提示HBV基因型D型较A型更易导致疾病进展[15],亚洲研究则认为C型风险更高[16-17]。关于HBV基因型与疾病进展的确切关系,尚需进一步研究证实。
三、自然史
病毒复制在HBV相关肝硬化患者中较为普遍。有研究发现,至少30%~70%的HBV相关代偿期肝硬化患者体内有活跃的病毒复制。两项欧洲研究显示,35%~55%的代偿期肝硬化患者HBeAg阳性,48%的患者HBV DNA阳性,治疗后出现HBeAg血清学转换或HBV DNA低于检测下限者预后较好[12,18]。HBsAg滴度与预后的相关性尚不明确。代偿期肝硬化进一步进展可导致失代偿期肝硬化和原发性肝细胞癌(hepatocellular carcinoma, HCC)的发生。
失代偿期肝硬化通常是代偿期肝硬化隐匿进展的结果,一些诱因可导致病情进展[19]。约14%的代偿期肝硬化患者因乙型肝炎急性发作而导致失代偿发生[20],表现为肝硬化急性失代偿。因此,失代偿期肝硬化患者可表现为慢性肝衰竭或慢加急性肝衰竭。每年约有2%~5%的代偿期肝硬化患者进展为失代偿期;20%的代偿期肝硬化患者在确诊后5年内进展为失代偿期,10年后高达60%进展为失代偿期[21-22]。病毒复制与否与进展为失代偿期密切相关。肝硬化有HBV复制证据者的肝脏失代偿年发病率为4%,显著高于无HBV复制者(1%)[19]。此外,合并其他嗜肝病毒感染亦为促进失代偿发生的重要原因。
HBV相关肝硬化患者的中位生存期为10~12年。一旦进展为失代偿,患者常出现门静脉高压导致的食管胃底静脉曲张破裂出血、腹水、脾功能亢进、肝性脑病、肝肾综合征等并发症,死亡风险明显增加[23]。代偿期和失代偿期肝硬化患者的5年生存率分别为84%和14%[24]。一项源自亚洲的回顾-前瞻性队列研究[23]显示,102例失代偿期肝硬化患者中,22例在平均13个月的随访期内死亡,死亡原因包括肝肾综合征(32%)、静脉曲张破裂出血(23%)、HCC(28%)、肝衰竭(9%)和肝性脑病(9%)。仅少量研究探讨了HBeAg状态对生存率的影响,但两者间并未建立明确关联。尚无研究专门评估基线HBV DNA载量对患者生存期的预测作用。因此,病毒血症对肝硬化失代偿期预后的影响尚需进一步研究。
HCC是HBV相关肝硬化的重要临床结局,无论是代偿期还是失代偿期肝硬化都有进展为HCC的风险。肝硬化本身即为发生HCC最重要的危险因素。HCC的其他危险因素包括:老年、男性、肝病严重程度、ALT水平、随访期间病毒复制活跃、病毒基因型、病毒突变、HCV或HDV重叠感染、饮酒、黄曲霉素暴露等。台湾省一项队列研究[25]显示,在调整年龄、性别、吸烟、饮酒、HBeAg状态、ALT水平等因素后,基线HBV DNA>104拷贝/mL是HCC发生最强的独立预测因子。但早年小样本研究认为,HBV DNA载量或HBeAg状态与HCC的发生无关[26-28]。因此,HBV相关肝硬化患者基线病毒载量和持续病毒复制在HCC发生中的作用仍需进一步研究阐明。
四、临床诊断和评估
HBV相关肝硬化是CHB发展的结果,其诊断过程包括临床诊断和评估。完整的诊断包括病因学、代偿/失代偿状态和并发症情况。
(一) 临床诊断
建立HBV相关肝硬化临床诊断的必要条件包括:①组织学或临床提示存在肝硬化的证据;②病因学明确的HBV感染证据。其他常见肝硬化病因如HCV感染、酒精、药物等需通过病史或相应检查加以明确或排除。
1. 存在肝硬化的证据
肝硬化临床诊断过程中需综合考虑临床表现、实验室检查、影像学、组织病理学等诸多依据。肝组织活检可提供肝纤维化分期的重要信息,肝组织学中弥漫性肝纤维化伴假小叶形成是肝硬化组织病理学诊断的金标准[29]。
代偿期肝硬化与慢性肝炎的临床表现、实验室检查特征难以鉴别,需行肝组织活检才能确诊。在缺乏组织学证据的情况下,应综合肝脏生化学(如白蛋白降低、胆红素升高)、血液学[如白细胞、血小板计数、凝血酶原活动度(prothrombin time activity, PTA)降低]、影像学(如肝脏边缘不规则、肝实质颗粒样、门静脉内径增宽、脾脏增大等)、内镜表现(如食管胃底静脉曲张、门静脉高压性胃病等)以及非创诊断技术等,作出代偿期肝硬化的临床诊断。
由于肝组织活检存在一定风险,且单个肝组织活检标本不一定能全面反映肝脏整体纤维化程度[30],近年来发展出多项非创诊断技术用于肝纤维化的评估,包括测定肝脏硬度的影像学技术、血清学标记物、各类评分系统等[30-32]。肝脏硬度测定对判断有无肝纤维化和肝硬化有一定临床价值,可避免部分患者的肝组织活检,中国人群中如检测值高于14.1 kPa[32],可作为肝硬化诊断时的参考,但实践中应注意排除血清转氨酶、胆红素等其他因素对检测值的影响[33-39]。
失代偿期肝硬化患者常伴有腹水、食管胃底静脉曲张、肝性脑病等并发症,常规影像学技术如MRI、CT、超声等可发现典型的肝硬化和门静脉高压征象[40],结合实验室检查以及临床症状和体征,易作出临床诊断。
2. 存在HBV感染的证据
慢性HBV感染是HBV相关肝硬化病因学诊断的重要依据。HBsAg阳性史超过6个月且目前HBsAg和(或)HBV DNA仍为阳性者,可诊断为慢性HBV感染,包括CHB、慢性HBV携带者/慢性非活动性HBsAg携带者、隐匿性CHB[41]。
(二) 临床评估
HBV相关肝硬化的临床和病毒学特点在首次诊断时各不相同。在CHB随访期间得以诊断的肝硬化,被认为接近于肝硬化发病或相对早期阶段;而以其他方式得以诊断的肝硬化,确切发病时间很难确定。因此,在建立诊断的同时应进行最初评估,在治疗随访阶段应定期进行后续评估。全面的评估至少应包括:病毒复制状况、肝脏功能及其代偿能力、并发症、HCC筛查等。
1. 病毒复制状况评估
病毒学指标HBV DNA是临床评估和监测病毒复制状况的重要指标,可反映病毒复制水平,用于慢性HBV感染的诊断、抗病毒治疗适应证的选择和疗效的判断[41]。不同检测方法和试剂的敏感性和检测范围不尽相同,如国产试剂的检测下限一般为500~1 000拷贝/mL,而进口试剂PCR法可检测到51~65拷贝/mL。HBV DNA的定量检测值可以IU/mL或拷贝/mL表示,1 IU相当于3~6拷贝。检测值越高,提示有更多的病毒在体内复制;但阴性或低于检测下限并不一定意味着无病毒复制。初始治疗后应每1~3个月检测一次,以后每3~6个月一次定期检测HBV DNA,以评估病毒复制状况和抗 病毒治疗效果。血清学指标HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc和抗-HBc IgM可适时检测,但不必过于频繁。
为准确评估病毒复制状况,如条件许可,应尽可能在质控严格、检测方法成熟的条件下,采用国际公认的高敏感性和较大检测范围的检测方法,避免假阳性或假阴性结果。
2. 肝脏功能及其代偿能力评估
诊断HBV相关肝硬化时,可同时根据下述方面对患者的肝脏功能及其代偿能力作出准确评估,以了解患者目前的肝病进展属于代偿期还是失代偿期,并对其预后和可能的死亡风险作出评估。
(1) 肝脏生化学指标
肝脏生化学指标中的ALT、AST等血清酶学指标升高并不能反映肝脏特定功能受损或障碍,仅能作为提示肝损伤的标志,反映肝细胞损伤程度。
肝脏生化学指标中的胆红素、凝血酶原时间(prothrombin time, PT)和PTA、白蛋白、胆碱酯酶明显异常,通常反映肝脏部分功能受损或障碍,如排泄功能和合成功能。疾病进展、出现慢加急性(亚急性)肝衰竭和慢性肝衰竭时,上述生化学指标可出现显著异常并进行性加重。出现血清总胆红素≥171 μmol/L或每日上升≥17.1 μmol/L、胆酶分离现象、PTA进行性降至40%以下等为肝衰竭征象,提示死亡风险增加、预后不良。
(2) 吲哚氰绿(indocyanine green, ICG)试验
ICG试验可反映肝脏储备功能,通常以注射后15 min血ICG潴留率(ICGR15)或ICG最大清除率作为衡量肝脏储备功能的指标,对外科手术的选择、手术时机的确定有重要参考价值。有学者认为ICGR15是评估HCC患者术前肝脏储备功能的最佳指标[42-43]。
(3) Child-Pugh分级
Child-Pugh分级是常用的评估肝脏储备功能的工具,可反映病情严重程度(见表1)。Child-Pugh评分最初用于评估酒精性肝硬化伴静脉曲张破裂出血患者的门体分流术后死亡风险,可预测术后1年生存率和术后并发症风险,但无法很好地预测远期死亡风险。根据评分,可将肝硬化分为A(5~6分)、B(7~9分)、C(≥10分)三级。通常代偿期肝硬化属于Child-Pugh A级,失代偿期肝硬化属于Child-Pugh B、C级[44]。诊断时的Child-Pugh分级与1年生存率密切相关,有研究提示Child-Pugh A、B、C级肝硬化患者的1年生存率分别为100%、80%和45%[44-45]。

表1 Child-Pugh分级
(4) 终末期肝病模型(model for end-stage liver disease, MELD)
MELD模型可有效预测终末期肝病的死亡风险[44-45],其计算公式为:R=3.8×ln[胆红素(mg/dL)]+11.2×ln(INR)+9.6×ln[肌酐(mg/dL)]+6.4×(病因:胆汁性或酒精性0,其他1)(INR: international normalized ratio,国际标准化比值;胆红素:1 mg/dL=17.10 μmol/L;肌酐:1 mg/dL=88.40 μmol/L)。R值越高,病情越严重,患者生存率越低。MELD模型最初用于评估经颈静脉肝内门体分流术患者的近期死亡风险,2002年后在美国用于评估各种病因肝硬化患者的3个月死亡风险。由于可准确评估终末期肝病的病情严重程度和近期死亡风险,在等待肝移植的候选者中,MELD评分决定着器官分配的顺序。近年发展起来的MELD-Na模型亦对终末期肝病的病情严重程度评估和死亡风险预测有重要价值。
3. 并发症评估
肝硬化门静脉高压是导致食管胃底静脉曲张破裂出血、腹水、肝性脑病、肝肾综合征等严重并发症的重要原因。代偿期肝硬化患者一般无并发症,一旦出现上述并发症,则提示已进入失代偿期[41]。Arvaniti等[46]将肝硬化分为5期(见图1):1期和2期属于代偿期,3~5期属于失代偿期;1、2、3、4、5期1年死亡率分别为<1%、3%~4%、20%、50%和>60%。并发症的出现与肝硬化患者的预后和死亡风险密切相关。因此,临床实践中应密切监测并发症状况,一旦出现并发症,应按相应诊治共识或指南进行干预,以降低死亡风险。

图1 肝硬化的临床病程、预后和5期分类法
4. HCC筛查
HBV感染和肝硬化均为HCC发生的高危因素,因此HBV相关肝硬化患者即使检测不出HBV DNA,亦应筛查HCC。可采用血清甲胎蛋白(α-fetoprotein, AFP)和肝脏超声进行常规筛查。对年龄≥35岁的男性、有HBV和(或)HCV感染、嗜酒、有HCC家族史的高危人群,每6个月进行一次筛查。对AFP>400 μg/L而超声未发现肝脏占位者,在排除妊娠、活动性肝病、生殖腺胚胎源性肿瘤等其他可能引起AFP增高的因素后,应行CT和(或)MRI等检查。如AFP升高未达诊断水平,除排除上述可能引起AFP增高的因素外,还应密切监测AFP的动态变化,并将超声筛查时间间隔缩短至1~2个月,必要时行CT和(或)MRI检查;如高度怀疑HCC,可考虑行数字减影血管造影(DSA)肝动脉碘油造影[47],但应注意DSA检查也可能出现假阳性或假阴性结果。
五、抗病毒治疗
(一) 治疗目标
总体治疗目标是通过长期、最大限度地抑制HBV而阻止疾病进展,延缓或减少失代偿期肝硬化、HCC或死亡等终点事件的发生,提高患者生活质量,延长生存期[22]。代偿期肝硬化抗病毒治疗的首要目标是阻止或延缓肝功能失代偿和HCC的发生;失代偿期肝硬化抗病毒治疗的首要目标是维护或改善残存的肝脏功能,延缓或减少肝硬化并发症和HCC的发生以及对肝移植的需求[48]。
(二) 治疗指征
肝硬化患者因具有进展至终末期肝病或HCC的风险,建议早期开始抗病毒治疗,尤其是失代偿期肝硬化[24]。
1. 代偿期肝硬化
决定是否开始治疗的惟一因素是HBV DNA载量,与ALT水平无关。中国“慢性乙型肝炎防治指南(2010年版)”(下文简称“中国指南”)对HBeAg状况进行了区分,HBeAg阳性者和阴性者的治疗指征分别为HBV DNA ≥104拷贝/mL和≥103拷贝/mL,事实上对HBeAg阴性者降低了抗病毒治疗的阈值。2012年欧洲肝脏研究学会(EASL)指南建议“只要HBV DNA可测,即使ALT正常,亦需考虑治疗”[49]。从指南的发展来看,提倡尽早、积极的抗病毒治疗。
2. 失代偿期肝硬化
失代偿期肝硬化患者只要可检测到HBV DNA,就应尽早开始抗病毒治疗。中国指南建议对此类患者行抗病毒治疗应在知情同意的基础上。HBV DNA检测不出时,建议采用国际公认的高敏感性方法复查以确认是否存在HBV复制。失代偿期患者如在肝脏功能严重受损时才开始抗病毒治疗,可能已无法显著降低死亡风险,应考虑肝移植[50-52]。
(三) 抗病毒治疗药物的选择
目前的抗病毒药物包括干扰素α(interferon-α, IFNα)和核苷(酸)类似物两类。HBV相关肝硬化患者抗病毒治疗药物的选择,应综合考虑可能的获益、安全性风险、耐药风险、经济状况等。
1. IFNα
早年研究提示IFNα治疗可改善代偿期肝硬化患者的组织学,肝功能失代偿发生率<1%[53-54]。而对Child-Pugh B级或C级失代偿期肝硬化患者,IFNα治疗未见获益,且有引起肝功能恶化、增加细菌感染的风险[53]。因此,失代偿期肝硬化是IFNα治疗的禁忌,应寻求其他替代治疗[48,55-56]。目前尚缺乏聚乙二醇干扰素(pegylated interferon, PEG-IFN)治疗肝硬化人群的相关研究。
对IFNα是否应用于代偿期肝硬化的抗病毒治疗,目前尚存争议。2010年意大利指南建议肝硬化患者慎用PEG-IFN,PEG-IFN仅限用于代偿良好、既往无任何失代偿史、无门静脉高压、无禁忌证、HBV DNA<2×106IU/mL、ALT升高的年轻肝硬化患者,且治疗过程中需对应答情况和安全性进行密切监测[57]。另有学者认为,代偿期肝硬化患者使用IFNα治疗应十分慎重,如有必要,宜从小剂量开始,并根据患者情况逐渐增加至预定治疗剂量[56,58]。但临床实践中仍会面临不少难题,如起始小剂量应为多少,小剂量是否能获得预期的获益等。
总之,考虑到IFNα的不良反应、耐受性以及可能引发的肝功能失代偿等问题,代偿期肝硬化患者使用IFNα应非常慎重,必须全面评估可能的风险/获益,才能作出治疗决策。IFNα禁用于失代偿期肝硬化患者。
2. 核苷(酸)类似物
核苷(酸)类似物包括拉米夫定(lamivudine, LAM)、阿德福韦酯(adefovir, ADV)、恩替卡韦(entecavir, ETV)、替比夫定(telbivudine, LdT)和替诺福韦酯(tenofovir, TDF)。前4种已在我国上市多年,TDF亦于最近获得国家食品药品监督管理总局(CFDA)批准上市。
著名的4006研究是一项里程碑式的随机双盲安慰剂对照临床试验,首次证实有效的抗病毒治疗(口服LAM 3年)能延缓进展期肝纤维化和代偿期肝硬化患者的疾病进展,并可减少HCC的发生[59]。但高耐药率使其远期获益受到影响,故不适合长期单药治疗。
对3项临床研究中1 633例患者(245例为进展期肝纤维化/肝硬化)的分析显示,服药48周后,ETV在HBeAg阳性、HBeAg阴性和LAM耐药患者中 获得的肝纤维化组织学改善率分别为57%、59%和43%,均显著高于对照LAM组[60]。一项回顾性队列研究[61]显示,与未接受抗病毒治疗者相比,接受ETV治疗者的肝硬化并发症、HCC、肝脏相关死亡等终点事件显著减少。
在失代偿期肝硬化患者中开展的随机对照临床研究[62]显示,TDF不仅可有效抑制HBV复制,而且可改善Child-Pugh和MELD评分。
事实上,关于LAM、ADV、ETV、LdT和TDF的大量研究均表明,核苷(酸)类似物用于治疗肝硬化患者,不仅可获得病毒学、血清学、生化学应答和组织学改善,而且可延缓疾病进展,改善肝脏功能和晚期肝病严重程度,提高患者生存率,延长等待肝移植 患者的术前存活时间或减少其对肝移植的需求[62-84]。
关于两种核苷(酸)类似物初始联合治疗是否能获益更多,研究结论不一[85-88]。目前尚无足够证据显示初始联合治疗较高效、低耐药的单药治疗更有效。考虑到在严重失代偿期患者中,初始联合治疗可能增加肝脏对多种药物的代谢负担,增加安全性隐患和多药耐药的潜在风险,初始联合治疗应十分慎重。
关于失代偿期肝硬化患者应用核苷(酸)类似物能否降低HCC的发生风险尚存争议,延长抗病毒治疗时间能否有效减少HCC的发生,有待大队列长期研究阐明[89-90]。
总之,目前证据表明核苷(酸)类似物适用于HBeAg阳性或阴性的代偿期或失代偿期肝硬化患者。长期抗病毒治疗可阻止疾病进展,改善HBV相关肝硬化患者的临床结局[3,22]。源自美国的数据显示,自2000年起,由于核苷(酸)类似物的应用,HBV相关肝衰竭患者需进行肝移植的数量明显减少。
亚太、欧洲和美国肝病学会的共识或指南均推荐高效、低耐药的ETV和TDF作为治疗HBV相关肝硬化的首选或优先考虑药物[9,49,91]。中国指南亦指出,对HBV相关肝硬化患者,只要条件允许,应尽可能选择高效、低耐药药物治疗[41]。考虑到肝硬化患者长期治疗的需要,本共识建议在条件许可的情况下,首选或优先选用高效、低耐药的药物如ETV、TDF单药长期治疗。
(四) 安全性监测
抗病毒治疗过程中需高度关注抗病毒药物的安全性。定期监测抗病毒药物治疗的不良反应,评估获益/风险,对保障患者在整体治疗中的利益最大化具有重要意义。
线粒体毒性是口服核苷(酸)类似物的共性安全性隐患,各核苷(酸)类似物的毒性靶器官不尽相同[92]。LAM的总体安全性较好,但耐药发生率相对较高,曾有出现横纹肌溶解的报道。ADV的肾脏毒性需引起关注,代偿期肝硬化患者连续应用ADV 4~5年后,肾脏毒性的发生率为3%,等待肝移植和移植后患者的发生率更高[73,93],每3个月一次检测血清肌酐和血磷水平是必要的,需要时可缩短监测频率[91]。ETV总体耐受性良好且耐药发生率较低[77],动物研究中曾有肺部良性肿瘤的报道,但未在人体研究和应用中证实;有报道ETV治疗基线MELD评分≥22的HBV相关肝硬化患者出现乳酸酸中毒,其风险与疾病严重程度(高MELD评分)相关[94],因此高MELD评分肝硬化患者抗病毒治疗过程中发生乳酸酸中毒的风险可能增高,应予密切监测。LdT可引起肌病(包括横纹肌溶解)以及中枢和外周神经系统的安全性问题且耐药发生率相对较高,临床应用有一定顾虑。TDF最常见的不良反应主要是胃肠道反应,还有引起低磷血症和骨代谢异常的报道[95-96];此外,TDF在HIV感染患者中已有肾毒性的报道,因此应定期监测肾功能。
总之,核苷(酸)类似物的线粒体毒性可引起全身系统性病变,包括肌病、肾毒性、神经病变、胰腺炎、脂肪肝、巨红细胞症、高乳酸血症、乳酸酸中毒等,因此应定期密切监测肌酸磷酸激酶(creatine phosphokinase, CPK)、肾功能、血磷、淀粉酶等指标,如出现肌病、肾毒性、骨质疏松、神经病变、胰腺炎等严重不良反应,建议及时更换其他核苷(酸)类似物治疗。其他宿主因素,如年龄、性别、遗传背景、合并症、营养状况、个体差异等亦可能影响线粒体毒性的临床表现形式和危害程度。IFN的不良反应和处理原则见中国指南[41]。
(五) 耐药监测和管理
耐药是制约核苷(酸)类似物长期抗病毒治疗的重要问题。一旦发生耐药,不但会使已取得的治疗获益丧失,还可导致肝脏病变急剧恶化,疾病加速进展为肝衰竭,增加肝移植、HCC的发生风险,使死亡风险增加。因此,对已进展至晚期肝病阶段的肝硬化患者而言,尽可能减少耐药的发生尤为重要。
关于核苷(酸)类似物在肝硬化人群中的耐药情况仅有少量研究报道(主要为LAM),对各核苷(酸)类似物耐药风险的认识更多来源于CHB人群。强效和高耐药基因屏障的药物如ETV、TDF是目前耐药发生率更低的药物。
仔细了解患者的既往治疗史、初始选用强效和高耐药基因屏障的药物如ETV、TDF单药长期治疗、加强患者对疾病的认识和依从性教育、避免低耐药基因屏障药物的单药序贯治疗、严格掌握治疗适应证、加强医务人员抗病毒治疗耐药预防和管理的教育等均为耐药预防和管理的重要措施。治疗过程中应密切监测HBV DNA,一旦出现耐药信号,如病毒学突破、病毒学反弹、生化学突破等,应尽快行耐药基因位点检测。耐药监测和治疗中,根据完全病毒学应答、部分病毒学应答和原发无应答情况,选择采取继续单药治疗、继续观察、加药或换药策略。对已确认的耐药,应及早进行挽救治疗。挽救治疗可按表2执行[97]。关于耐药监测和管理的具体实施以及其他信息可参考“核苷和核苷酸类药物 治疗慢性乙型肝炎的耐药及其管理”[肝脏, 2013, 18 (1): 1-10.]一文。
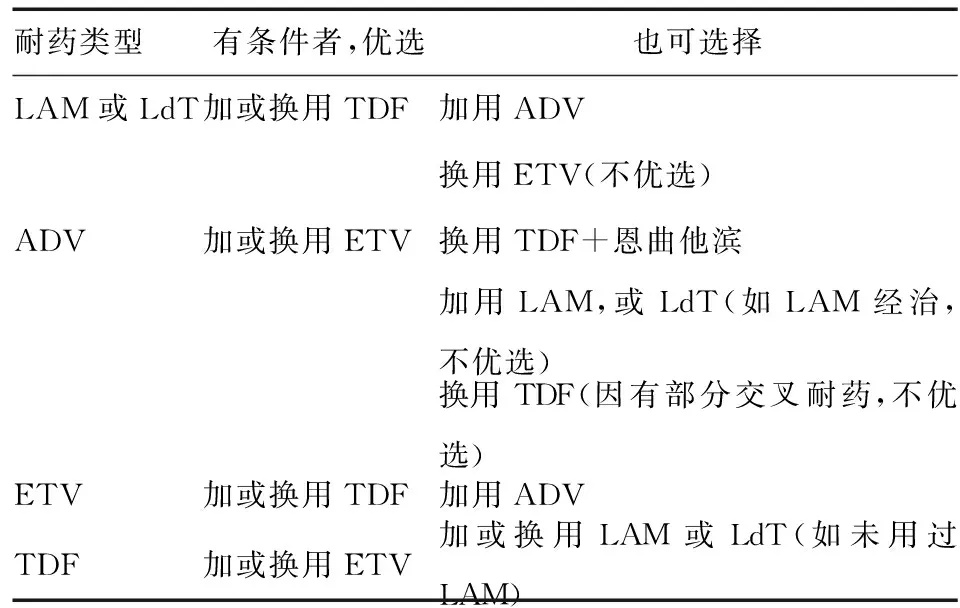
表2 抗病毒耐药的挽救治疗
(六) 肝肾功能不全患者的剂量调整
在肝功能不全患者中,目前无证据显示需对核苷(酸)类似物进行相应的剂量调整。肝功能受损不影响LAM、LdT的药物代谢过程;中度和重度肝损伤对ADV、ETV的药代动力学无影响。
肾功能不全可在肝硬化失代偿的终末期发生。因此,对伴肾功能不全的患者,建议首先进行剂量或给药时间间隔的调整(见表3)。其次,应定期监测血清肌酐、血磷和尿液样本。肾功能轻度受损可每2~3个月检测一次,中度或严重受损则需每月检测一次,尤其应密切监测肾功能不全已进行剂量调整的患者。第三,应尽可能避免使用其他肾毒性药物。
由于ADV和TDF有引起肾毒性的风险,对长期使用ADV或TDF的患者,应每3个月一次定期检测血清肌酐和血磷水平,如肌酐水平超过基线值0.5 mg/dL(44.2 μmol/L)以上,或血磷水平低于2.0 mg/dL(645.8 μmol/L),提示出现ADV或TDF相关肾毒性。如肾功能受损,优先考虑换用其他核苷(酸)类似物,否则需根据肾小球滤过率(glome-rular filtration rate, GFR)或估测的GFR[estimated GFR, (e)GFR]对剂量或给药时间间隔进行调整。
(七) 并发症的处理
肝硬化失代偿时常合并腹水、自发性细菌性腹膜炎、肝肾综合征、静脉曲张破裂出血、肝性脑病等并发症,对这些患者,应在抗病毒治疗的基础上,参照相应共识或指南,针对出现的并发症进行规范化治疗。
六、患者随访、监测和管理
通过最初和后续评估,在全面了解患者病情的基础上制订合理的随访和监测策略,不仅对判断患者的预后、评估可能的死亡风险具有重要价值,而且对采取正确的治疗决策有重要指导意义。随访中应重点监测病毒复制状况、耐药风险、抗病毒治疗的安全性、肝脏功能受损及其代偿能力、并发症、HCC风险、疾病进展和死亡风险等,监测指标详见第四、第五部分以及HBV相关肝硬化临床诊断、评估和抗病毒治疗流程图(见图2)。有肝移植指征者应及时转诊肝移植中心。
七、未来研究方向
尽管HBV相关肝硬化的抗病毒治疗已建立一定证据,但仍有很多问题有待解决。未来的研究方向包括:①寻找疾病进展的生物学标记;②基线HBV DNA对肝硬化失代偿期预后的影响;③基线HBV DNA和持续病毒复制在HCC发生中的作用;④非创诊断技术预测疾病进展的价值;⑤IFN在代偿期肝硬化中的适用人群和最佳剂量;⑥核苷(酸)类似物在肝硬化人群中的耐药情况和应对策略;⑦核苷(酸)类似物与治疗肝硬化并发症药物之间的相互作用;⑧药物经济学。

表3 肾功能不全HBV感染患者的核苷(酸)类似物推荐剂量或给药时间间隔
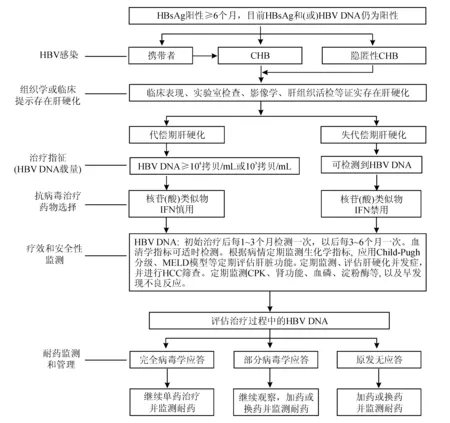
图2 HBV相关肝硬化临床诊断、评估和抗病毒治疗流程图
推荐意见
意见1持续高病毒载量可独立预测肝硬化发生(1b;A)。HBeAg持续阳性者肝硬化发生风险更高(2a;B)。治疗后出现HBeAg血清学转换或HBV DNA低于检测下限者预后较好 (2b;B)。HBV基因型与疾病进展的关系尚存争议(2b;B)。
意见2代偿期肝硬化可通过隐匿进展或肝炎急性发作导致失代偿发生(2b;A)。其中HBV高载量(或持续复制)者、合并其他嗜肝病毒感染者的失代偿风险更高(2a;B)。
意见3肝硬化是HCC发生最重要的危险因素(2a;A)。代偿期肝硬化可不经失代偿期而直接进展为HCC(2b;B)。基线病毒载量和持续病毒复制在HCC发生中的作用需进一步阐明(2b;B)。
意见4HBV相关肝硬化临床诊断的必要条件包括组织学或临床确认的肝硬化证据、HBV感染的病因学证据,完整诊断包括病因学、代偿/失代偿状态和并发症情况。最初和后续完整临床评估至少应包括病毒复制状况、肝脏功能及其代偿能力、并发症和HCC筛查(5;B)。
意见5肝硬化的诊断需综合依据临床表现、实验室检查、影像学、组织病理学等,其中肝脏硬度测定可作为肝硬化非创诊断时的参考(2b;B)。需明确诊断时,肝组织活检是代偿期肝硬化临床诊断的金标准(2b;A)。
意见6初始抗病毒治疗后应每1~3个月检测一次HBV DNA,以后每3~6个月一次定期检测(2b;A)。如条件许可,应尽可能采用国际公认的高敏感性和较大检测范围的检测方法检测HBV DNA(2b;B)。血清学指标可适时检测,但不必过于频繁(5;B)。
意见7根据病情监测生化学指标,ICG、Child-Pugh分级和(或)MELD模型有助于准确评估肝脏功能及其代偿能力,判断死亡风险(2b;A)。
意见8可按5期分类法评估肝硬化并发症状况,确定疾病进展,判断死亡风险;1、2期为代偿期肝硬化,3~5期为失代偿期肝硬化(1a;A)。
意见9HBV相关肝硬化患者即使检测不出HBV DNA,亦应筛查HCC(2b;A)。对高危人群,每6个月一次以AFP和肝脏超声筛查HCC(2b;A)。对AFP> 400 μg/L而超声未发现肝脏占位者,应行CT和(或)MRI检查(2b;B)。AFP升高未达诊断水平者,应监测AFP动态变化,每1~2个月一次行超声筛查,必要时行CT和(或)MRI检查;如高度怀疑HCC,可考虑行DSA肝动脉碘油造影(2b;B)。
意见10代偿期肝硬化抗病毒治疗的首要目标是阻止或延缓肝功能失代偿和HCC的发生;失代偿期肝硬化抗病毒治疗的首要目标是维护或改善残存的肝脏功能,延缓或减少并发症和HCC的发生以及对肝移植的需求(1a;A)。
意见11尽早并长期抗病毒治疗可带来明显临床获益(2b;B)。HBV DNA载量是决定代偿期肝硬化患者是否开始抗病毒治疗的惟一因素(2b;B)。失代偿期肝硬化患者只要可检测到HBV DNA,建议在知情同意的基础上,尽早开始核苷(酸)类似物治疗(2b;B);HBV DNA检测不出时,建议采用国际公认的高敏感性方法复查以确认是否存在HBV复制(5;B)。
意见12对代偿期肝硬化患者选择IFNα治疗存在争议,应十分慎重,需全面评估风险/获益(3b;B)。失代偿期肝硬化患者禁用IFNα(3b;A)。核苷(酸)类似物对代偿期和失代偿期肝硬化患者均适用(2b;B)。
意见13核苷(酸)类似物的选择应综合考虑可能的获益、安全性风险、耐药风险、经济状况等。如条件许可,建议首选或优先选用高效、低耐药的药物如ETV、TDF单药长期治疗(1b;A)。
意见14定期密切监测CPK、肾功能、血磷、淀粉酶等指标,一旦出现严重肌病、肾损害、骨质疏松、神经病变、胰腺炎等核苷(酸)类似物线粒体毒性相关不良反应,建议及时更换其他核苷(酸)类似物(3b;B)。对高MELD评分患者,应密切监测乳酸酸中毒的风险(2b;B)。IFN治疗的安全性监测和不良反应处理原则参见中国“慢性乙型肝炎防治指南(2010年版)”(2b;B)。
意见15耐药发生可导致治疗获益丧失、疾病恶化或进展加速(2b;B)。LAM或LdT耐药,优先考虑加用或换用TDF;ADV耐药,优先考虑加用或换用ETV;ETV耐药,优先考虑加用或换用TDF;TDF耐药,优先考虑加用或换用ETV(2b;B)。
意见16对肝功能不全患者,目前无证据显示需对核苷(酸)类似物进行剂量调整(3b;B)。
意见17对伴肾功能不全者,应对剂量或给药时间间隔进行调整(3b;B)。轻度肾功能受损者,每2~3个月一次检测血清肌酐和血磷;中重度肾功能受损者,每月检测一次(5;B)。长期使用ADV或TDF者,每3个月一次检测血清肌酐和血磷,如肌酐水平超过基线值0.5 mg/dL以上,或血磷水平低于2.0 mg/dL,提示出现ADV或TDF相关肾毒性,如肾功能受损,优先考虑换用其他核苷(酸)类似物,否则需根据(e)GFR对剂量或给药时间间隔进行调整(3a;B)。
意见18抗病毒治疗是HBV相关肝硬化整体治疗的重要组成部分,对肝硬化失代偿期相关并发症,应在抗病毒治疗的基础上,参照相应共识或指南进行规范化治疗;有肝移植指征者应及时转诊肝移植中心(5;B)。
附录一

循征医学证据分级水平和依据

循证医学证据分级水平说明
附录二:术语及其定义
1. 病毒学应答(virological response):指血清HBV DNA检测不到(PCR法)或低于检测下限(完全病毒学应答),或较基线下降≥2 lg IU/mL(部分病毒学应答)[41]。
2. 完全病毒学应答(complete virological re-sponse):在抗病毒治疗时,应用高敏感性的实时PCR进行检测,HBV DNA检测不到或低于检测下限[97]。
3. 部分病毒学应答(partial virological response):在依从性良好的情况下,治疗至6个月(24周)时,仍能检测到HBV DNA,但下降>1 lg IU/mL。判定部分病毒学应答的时间因核苷(酸)类似物类别而异,对于低耐药基因屏障的LAM和LdT,判定时间为6个月(24周),对于高耐药基因屏障的ETV和TDF,判定时间为12个月(48周)[49,97]。
4. 原发无应答(primary non-response):在依从性良好的情况下,以核苷(酸)类似物治疗3个月(12周),HBV DNA下降<1 lg IU/mL[97]。
5. 血清学应答(serological response):指血清HBeAg转阴或HBeAg血清学转换,或HBsAg转阴或HBsAg血清学转换[41]。
6. 生化学应答(biochemical response):指血清ALT和AST恢复正常[41,49]。
7. 耐药(drug resistance):在抗病毒治疗过程中,检测到与HBV耐药相关的基因突变,称为基因型耐药(genotypic resistance)。体外实验显示抗病毒药物敏感性降低并与基因耐药相关,称为表型耐药(phenotypic resistance)。针对一种抗病毒药物出现的耐药突变对另一种或几种抗病毒药物也出现耐药,称为交叉耐药(cross resistance)[41]。
8. 病毒学突破(virological breakthrough):在未更改治疗方案的情况下,获得部分或完全病毒学应答的患者,其HBV DNA载量较治疗中的最低点上升1 lg IU/mL,并由间隔1个月以上的第二次检测证实[97]。
9. 生化学突破(biochemical breakthrough):在未更改治疗方案的情况下,基线ALT ≥2 ULN(正常上限)且治疗中ALT已降至正常的患者,ALT重新升至高于ULN[97]。
10. 病毒学反弹(virological rebound):在未更改治疗方案的情况下,获得部分或完全病毒学应答的患者,HBV DNA载量超过治疗前水平[97]。
课题组专家名单(排名不分先后,以姓名汉语拼音字母为序):
陈成伟、丁惠国、窦晓光、段钟平、范建高、傅青春、韩涛、韩英、侯金林、贾继东、江家骥、刘玉兰、陆伦根、陆伟、毛青、茅益民、南月敏、聂玉强、牛俊奇、彭劼、任红、尚佳、唐红、王吉耀、魏来、翁心华、谢冬英、谢青、谢渭芬、谢雯、阎明、尤红、曾民德、钟碧慧、庄辉
1 许蓓,徐国光,郭清,等. 拉米夫定对慢性乙型肝炎伴重度肝纤维化患者的长期应用疗效——NUCB 4006十年随访研究[J]. 中华传染病杂志, 2010, 28 (11): 656-661.
2 Chang TT, Liaw YF, Wu SS, et al. Long-term entecavir therapy results in the reversal of fibrosis/cirrhosis and continued histological improvement in patients with chronic hepatitis B[J]. Hepatology, 2010, 52 (3): 886-893.
3 Fink SA, Jacobson IM. Managing patients with hepatitis-B-related or hepatitis-C-related decompensated cirrhosis[J]. Nat Rev Gastroenterol Hepatol, 2011, 8 (5): 285-295.
4 Zhang QQ, An X, Liu YH, et al. Long-term nucleo-s(t)ide analogues therapy for adults with chronic hepatitis B reduces the risk of long-term complications: a meta-analysis[J]. Virol J, 2011, 8 (72): 1-11.
5 Manolakopoulos S, Triantos C, Theodoropoulos J, et al. Antiviral therapy reduces portal pressure in patients with cirrhosis due to HBeAg-negative chronic hepatitis B and significant portal hypertension[J]. J Hepatol, 2009, 51 (3): 468-474.
6 Li CZ, Cheng LF, Li QS, et al. Antiviral therapy delays esophageal variceal bleeding in hepatitis B virus-related cirrhosis[J]. World J Gastroenterol, 2013, 19 (40): 6849-6856.
7 Lok AS. Hepatitis: Long-term therapy of chronic hepatitis B reverses cirrhosis[J]. Nat Rev Gastroenterol Hepatol, 2013, 10 (4): 199-200.
8 Perz JF, Armstrong GL, Farrington LA, et al. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide[J]. J Hepatol, 2006, 45 (4): 529-538.
9 Liaw YF, Leung N, Kao JH, et al; Chronic Hepatitis B Guideline Working Party of the Asian-Pacific Association for the Study of the Liver. Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2008 update[J]. Hepatol Int, 2008, 2 (3): 263-283.
10 Iloeje UH, Yang HI, Su J, et al; Risk Evaluation of Viral Load Elevation and Associated Liver Disease/Cancer-In HBV (the REVEAL-HBV) Study Group. Predicting cirrhosis risk based on the level of circulating hepatitis B viral load[J]. Gastroenterology, 2006, 130 (3): 678-686.
11 Huo T, Wu JC, Hwang SJ, et al. Factors predictive of liver cirrhosis in patients with chronic hepatitis B: a multivariate analysis in a longitudinal study[J]. Eur J Gastroenterol Hepatol, 2000, 12 (6): 687-693.
12 Realdi G, Fattovich G, Hadziyannis S, et al. Survival and prognostic factors in 366 patients with compensated cirrhosis type B: a multicenter study. The Investigators of the European Concerted Action on Viral Hepatitis (EUROHEP)[J]. J Hepatol, 1994, 21 (4): 656-666.
13 Colin JF, Cazals-Hatem D, Loriot MA, et al. Influence of human immunodeficiency virus infection on chronic hepatitis B in homosexual men[J]. Hepatology, 1999, 29 (4): 1306-1310.
14 Hsu YS, Chien RN, Yeh CT, et al. Long-term outcome after spontaneous HBeAg seroconversion in patients with chronic hepatitis B[J]. Hepatology, 2002, 35 (6): 1522-1527.
15 Sánchez-Tapias JM, Costa J, Mas A, et al. Influence of hepatitis B virus genotype on the long-term outcome of chronic hepatitis B in western patients[J]. Gastroenterology, 2002, 123 (6): 1848-1856.
16 Sumi H, Yokosuka O, Seki N, et al. Influence of hepatitis B virus genotypes on the progression of chronic type B liver disease[J]. Hepatology, 2003, 37 (1): 19-26.
17 Chu CJ, Hussain M, Lok AS. Hepatitis B virus genotype B is associated with earlier HBeAg seroconversion compared with hepatitis B virus genotype C[J]. Gastroenterology, 2002, 122 (7): 1756-1762.
18 de Jongh FE, Janssen HL, de Man RA, et al. Survival and prognostic indicators in hepatitis B surface antigen-positive cirrhosis of the liver[J]. Gastroenterology, 1992, 103 (5): 1630-1635.
19 Chu CM, Liaw YF. Hepatitis B virus-related cirrhosis: natural history and treatment[J]. Semin Liver Dis, 2006, 26 (2): 142-152.
20 Liaw YF, Chen JJ, Chen TJ. Acute exacerbation in patients with liver cirrhosis: a clinicopathological study[J]. Liver, 1990, 10 (3): 177-184.
21 Lefton HB, Rosa A, Cohen M. Diagnosis and epidemiology of cirrhosis[J]. Med Clin North Am, 2009, 93 (4): 787-799, vii.
22 Vallet-Pichard A, Mallet V, Costentin CE, et al. Treatment of HBV-related cirrhosis[J]. Expert Rev Anti Infect Ther, 2009, 7 (5): 527-535.
23 Das K, Das K, Datta S, et al. Course of disease and survival after onset of decompensation in hepatitis B virus-related cirrhosis[J]. Liver Int, 2010, 30 (7): 1033-1042.
24 Zoulim F, Radenne S, Ducerf C. Management of patients with decompensated hepatitis B virus associated cirrhosis[J]. Liver Transpl, 2008, 14 Suppl 2: S1-S7.
25 Chen CJ, Yang HI, Su J, et al; REVEAL-HBV Study Group. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level[J]. JAMA, 2006, 295 (1): 65-73.
26 Chen YC, Chu CM, Yeh CT, et al. Natural course following the onset of cirrhosis in patients with chronic hepatitis B: a long-term follow-up study[J]. Hepatol Int, 2007, 1 (1): 267-273.
27 Fattovich G, Giustina G, Schalm SW, et al. Occurrence of hepatocellular carcinoma and decompensation in western European patients with cirrhosis type B. The EUROHEP Study Group on Hepatitis B Virus and Cirrhosis[J]. Hepatology, 1995, 21 (1): 77-82.
28 Fattovich G, Pantalena M, Zagni I, et al. Effect of hepatitis B and C virus infections on the natural history of compensated cirrhosis: a cohort study of 297 patients[J]. Am J Gastroenterol, 2002, 97 (11): 2886-2895.
29 Colli A, Fraquelli M, Andreoletti M, et al. Severe liver fibrosis or cirrhosis: accuracy of US for detection -- analysis of 300 cases[J]. Radiology, 2003, 227 (1): 89-94.
30 Bedossa P, Dargère D, Paradis V. Sampling variability of liver fibrosis in chronic hepatitis C[J]. Hepatology, 2003, 38 (6): 1449-1457.
31 Zeng MD, Lu LG, Mao YM, et al. Prediction of significant fibrosis in HBeAg-positive patients with chronic hepatitis B by a noninvasive model[J]. Hepatology, 2005, 42 (6): 1437-1445.
32 肝脏硬度评估小组. 瞬时弹性成像技术诊断肝纤维化专家意见[J]. 中华肝脏病杂志, 2013, 21 (6): 420-424.
33 Poynard T, Munteanu M, Imbert-Bismut F, et al. Prospective analysis of discordant results between biochemical markers and biopsy in patients with chronic hepatitis C[J]. Clin Chem, 2004, 50 (8): 1344-1355.
34 Poynard T, McHutchison J, Manns M, et al. Biochemical surrogate markers of liver fibrosis and activity in a randomized trial of peginterferon alfa-2b and ribavirin[J]. Hepatology, 2003, 38 (2): 481-492.
35 Poynard T, Ngo Y, Munteanu M, et al. Noninvasive markers of hepatic fibrosis in chronic hepatitis B[J]. Curr Hepat Rep, 2011, 10 (2): 87-97.
36 Bartres C, Lens S. Elastography of the liver (Fibroscan?) in hepatology (Article in Spanish)[J]. Rev Esp Enferm Dig, 2013, 105 (4): 235.
37 Janssens F, de Suray N, Piessevaux H, et al. Can transient elastography replace liver histology for determination of advanced fibrosis in alcoholic patients: a real-life study[J]. J Clin Gastroenterol, 2010, 44 (8): 575-582.
38 Castera L. Transient elastography and other noninvasive tests to assess hepatic fibrosis in patients with viral hepatitis[J]. J Viral Hepat, 2009, 16 (5): 300-314.
39 Bonnard P, Sombié R, Lescure FX, et al. Comparison of elastography, serum marker scores, and histology for the assessment of liver fibrosis in hepatitis B virus (HBV)-infected patients in Burkina Faso[J]. Am J Trop Med Hyg, 2010, 82 (3): 454-458.
40 郑荣琴,黄冬梅,张波,等. 超声、CT及MRI诊断肝硬化的比较[J]. 世界华人消化杂志, 2005, 13 (8): 993-996.
41 中华医学会肝病学分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010年版)[J]. 胃肠病学, 2011, 16 (6): 351-366.
42 Lau H, Man K, Fan ST, et al. Evaluation of preoperative hepatic function in patients with hepatocellular carcinoma undergoing hepatectomy[J]. Br J Surg, 1997, 84 (9): 1255-1259.
43 Chen X, Zhang HB, Li ZQ, et al. Indocyanine green clearance in evaluating the recovery of liver reserve function after superselective transarterial chemoembolization[J]. Hepatobiliary Pancreat Dis Int, 2013, 12 (6): 656-660.
44 Durand F, Valla D. Assessment of the prognosis of cirrhosis: Child-Pugh versus MELD[J]. J Hepatol, 2005, 42 Suppl (1): S100-S107.
45 Schuppan D, Afdhal NH. Liver cirrhosis[J]. Lancet, 2008, 371 (9615): 838-851.
46 Arvaniti V, D’Amico G, Fede G, et al. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis[J]. Gastroenterology, 2010, 139 (4): 1246-1256, 1256.e1-e5.
47 中国抗癌协会肝癌专业委员会,中国抗癌协会临床肿瘤学协作专业委员会,中华医学会肝病学分会肝癌学组. 原发性肝癌规范化诊治的专家共识[J]. 肿瘤, 2009, 29 (4): 295-304.
48 Fung SK, Lok AS. Management of patients with hepatitis B virus-induced cirrhosis[J]. J Hepatol, 2005, 42 Suppl (1): S54-S64.
49 European Association For The Study Of The Liver. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection[J]. J Hepatol, 2012, 57 (1): 167-185.
50 Fontana RJ, Hann HW, Perrillo RP, et al. Determinants of early mortality in patients with decompensated chronic hepatitis B treated with antiviral therapy[J]. Gastroenterology, 2002, 123 (3): 719-727.
51 Chien RN, Lin CH, Liaw YF. The effect of lamivudine therapy in hepatic decompensation during acute exacerbation of chronic hepatitis B[J]. J Hepatol, 2003, 38 (3): 322-327.
52 Tsubota A, Arase Y, Suzuki Y, et al. Lamivudine monotherapy for spontaneous severe acute exacerbation of chronic hepatitis B[J]. J Gastroenterol Hepatol, 2005, 20 (3): 426-432.
53 Perrillo R, Tamburro C, Regenstein F, et al. Low-dose, titratable interferon alfa in decompensated liver disease caused by chronic infection with hepatitis B virus[J]. Gastroenterology, 1995, 109 (3): 908-916.
54 Hoofnagle JH, Di Bisceglie AM, Waggoner JG, et al. Interferon alfa for patients with clinically apparent cirrhosis due to chronic hepatitis B[J]. Gastroenterology, 1993, 104 (4): 1116-1121.
55 Honkoop P, Niesters HG, de Man RA, et al. Lamivudine resistance in immunocompetent chronic hepatitis B. Incidence and patterns[J]. J Hepatol, 1997, 26 (6): 1393-1395.
56 Lai CJ, Terrault NA. Antiviral therapy in patients with chronic hepatitis B and cirrhosis[J]. Gastroenterol Clin North Am, 2004, 33 (3): 629-654, x-xi.
57 Alberti A, Caporaso N. HBV therapy: guidelines and open issues[J]. Dig Liver Dis, 2011, 43 Suppl 1: S57-S63.
58 van Zonneveld M, Honkoop P, Hansen BE, et al. Long-term follow-up of alpha-interferon treatment of patients with chronic hepatitis B[J]. Hepatology, 2004, 39 (3): 804-810.
59 Liaw YF, Sung JJ, Chow WC, et al; Cirrhosis Asian Lamivudine Multicentre Study Group. Lamivudine for patients with chronic hepatitis B and advanced liver disease[J]. N Engl J Med, 2004, 351 (15): 1521-1531.
60 Schiff E, Simsek H, Lee WM, et al. Efficacy and safety of entecavir in patients with chronic hepatitis B and advanced hepatic fibrosis or cirrhosis[J]. Am J Gastroenterol, 2008, 103 (11): 2776-2783.
61 Wong GL, Chan HL, Mak CW, et al. Entecavir treatment reduces hepatic events and deaths in chronic hepatitis B patients with liver cirrhosis[J]. Hepatology, 2013, 58 (5): 1537-1547.
62 Liaw YF, Sheen IS, Lee CM, et al. Tenofovir disoproxil fumarate (TDF), emtricitabine/TDF, and entecavir in patients with decompensated chronic hepatitis B liver disease[J]. Hepatology, 2011, 53 (1): 62-72.
63 Villeneuve JP, Condreay LD, Willems B, et al. Lamivudine treatment for decompensated cirrhosis resulting from chronic hepatitis B[J]. Hepatology, 2000, 31 (1): 207-210.
64 Fontana RJ, Keeffe EB, Carey W, et al; National Institutes of Health Hepatitis B Virus Orthotopic Liver Transplantation Study Group. Effect of lamivudine treatment on survival of 309 North American patients awaiting liver transplantation for chronic hepatitis B[J]. Liver Transpl, 2002, 8 (5): 433-439.
65 Hann HW, Fontana RJ, Wright T, et al; United States Lamivudine Compassionate Use Study Group. A United States compassionate use study of lamivudine treatment in nontransplantation candidates with decompensated hepatitis B virus-related cirrhosis[J]. Liver Transpl, 2003, 9 (1): 49-56.
66 Yao FY, Bass NM. Lamivudine treatment in patients with severely decompensated cirrhosis due to replicating hepatitis B infection[J]. J Hepatol, 2000, 33 (2): 301-307.
67 Kapoor D, Guptan RC, Wakil SM, et al. Beneficial effects of lamivudine in hepatitis B virus-related decompensated cirrhosis[J]. J Hepatol, 2000, 33 (2): 308-312.
68 Manolakopoulos S, Karatapanis S, Elefsiniotis J, et al. Clinical course of lamivudine monotherapy in patients with decompensated cirrhosis due to HBeAg negative chronic HBV infection[J]. Am J Gastroenterol, 2004, 99 (1): 57-63.
69 Bae SH, Yoon SK, Choi JY, et al. Timing of lamivudine administration according to Child class in patients with decompensated cirrhosis[J]. J Gastroenterol Hepatol, 2005, 20 (10): 1527-1532.
70 Perrillo RP, Wright T, Rakela J, et al; Lamivudine North American Transplant Group. A multicenter United States-Canadian trial to assess lamivudine monotherapy before and after liver transplantation for chronic hepatitis B[J]. Hepatology, 2001, 33 (2): 424-432.
71 Zoulim F, Locarnini S. Hepatitis B virus resistance to nucleos(t)ide analogues[J]. Gastroenterology, 2009, 137 (5): 1593-1608.
72 Schiff ER, Lai CL, Hadziyannis S, et al; Adefovir Dipovoxil Study 435 International Investigators Group. Adefovir dipivoxil therapy for lamivudine-resistant hepatitis B in pre- and post-liver transplantation patients[J]. Hepatology, 2003, 38 (6): 1419-1427.
73 Schiff E, Lai CL, Hadziyannis S, et al; Adefovir Dipivoxil Study 45 International Investigators Group. Adefovir dipivoxil for wait-listed and post-liver transplantation patients with lamivudine-resistant hepatitis B: final long-term results[J]. Liver Transpl, 2007, 13 (3): 349-360.
74 Lampertico P. Partial virological response to nucleos(t)ide analogues in naïve patients with chronic hepatitis B: From guidelines to field practice[J]. J Hepatol, 2009, 50 (4): 644-647.
75 Shim JH, Lee HC, Kim KM, et al. Efficacy of entecavir in treatment-naïve patients with hepatitis B virus-related decompensated cirrhosis[J]. J Hepatol, 2010, 52 (2): 176-182.
76 Schiff ER, Lee SS, Chao YC, et al. Long-term treatment with entecavir induces reversal of advanced fibrosis or cirrhosis in patients with chronic hepatitis B[J]. Clin Gastroenterol Hepatol, 2011, 9 (3): 274-276.
77 Pozzi M, Pizzala DP, Maldini FF, et al. Portal pressure reduction after entecavir treatment in compensated HBV cirrhosis[J]. Hepatogastroenterology, 2009, 56 (89): 231-235.
78 Sherman M, Yurdaydin C, Sollano J, et al; AI463026 BEHoLD Study Group. Entecavir for treatment of lamivudine-refractory, HBeAg-positive chronic hepatitis B[J]. Gastroenterology, 2006, 130 (7): 2039-2049.
79 Wang LC, Chen EQ, Cao J, et al. De novo combination of lamivudine and adefovir versus entecavir monotherapy for the treatment of naïve HBeAg-negative chronic hepatitis B patients[J]. Hepatol Int, 2011, 5 (2): 671-676.
80 Piratvisuth T, Lau GK, Marcellin P, et al. On-treatment decline in serum HBsAg levels predicts sustained immune control and HBsAg clearance 6 months post-treatment in HBeAg-positive hepatitis B virus-infected patients treated with peginterferon alfa-2a [40KD] (PEGASYS)[A]. Conference of the Asian Pacific Association for the Study of the Liver 2010 (20th APASL), Beijing, March 2010.
81 Gane EJ, Chan HL, Choudhuri G, et al. Treatment of decompensated HBV-cirrhosis: results from 2-years randomized trial with telbivudine or lamivudine[J]. J Hepatol, 2010, 52 Suppl 1: S4.
82 Marcellin P, Gane E, Buti M, et al. Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B: a 5-year open-label follow-up study[J]. Lancet, 2013, 381 (9865): 468-475.
83 Buti M, Hadziyannis S, Mathurin P, et al. Tenofovir disoproxil fumarate (TDF) is highly active for treatment of chronic hepatitis B (CHB) in patients with cirrhosis[A]. 43rd Annual Meeting of the European Association For The Study Of The Liver (EASL), Milan, April 23-27, 2008.
84 Wang J. Clinical utility of entecavir for chronic hepatitis B in Chinese patients[J]. Drug Des Devel Ther, 2013, 8: 13-24.
85 贾红宇,卢微,郑临,等. 拉米夫定单药及其初始联合阿德福韦酯治疗失代偿期乙型肝炎肝硬化的疗效比较[J]. 中华肝脏病杂志, 2011, 19 (2): 84-87.
86 Carey I, Huyen-Ly Nguyen NV, Joe D, et al. De-novo antiviral therapy with nucleos(t)ide analogues in ‘real-life’ patients with chronic hepatitis B infection: comparison of virological responses between lamivudine + adefovirvsentecavirvstenofovir therapy[J]. Gut, 2011, 60 Suppl 2: A22-A23.
87 Girgis CM, Wong T, Ngu MC, et al. Hypophosphataemic osteomalacia in patients on adefovir dipivoxil[J]. J Clin Gastroenterol, 2011, 45 (5): 468-473.
88 Gish R, Jia JD, Locarnini S, et al. Selection of chronic hepatitis B therapy with high barrier to resistance[J]. Lancet Infect Dis, 2012, 12 (4): 341-353.
89 Eun JR, Lee HJ, Kim TN, et al. Risk assessment for the development of hepatocellular carcinoma: according to on-treatment viral response during long-term lamivudine therapy in hepatitis B virus-related liver disease[J]. J Hepatol, 2010, 53 (1): 118-125.
90 Papatheodoridis GV, Manolakopoulos S, Touloumi G, et al; HEPNET. Greece Cohort Study Group. Virological suppression does not prevent the development of hepatocellular carcinoma in HBeAg-negative chronic hepatitis B patients with cirrhosis receiving oral anti-viral(s) starting with lamivudine monotherapy: results of the nationwide HEPNET. Greece cohort study[J]. Gut, 2011, 60 (8): 1109-1116.
91 Lok AS, McMahon BJ. Chronic hepatitis B: update 2009[J]. Hepatology, 2009, 50 (3): 661-662.
92 茅益民. 关注口服抗HBV药物治疗的长期安全性[J]. 肝脏, 2009, 14 (增刊): 68-70.
93 Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, et al; Adefovir Dipivoxil 438 Study Group. Long-term therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B for up to 5 years[J]. Gastroenterology, 2006, 131 (6): 1743-1751.
94 Lange CM, Bojunga J, Hofmann WP, et al. Severe lactic acidosis during treatment of chronic hepatitis B with entecavir in patients with impaired liver function[J]. Hepatology, 2009, 50 (6): 2001-2006.
95 王桂爽,蔡皓东. 阿德福韦酯和替诺福韦相关性肾小管病[J]. 药物不良反应杂志, 2010, 12 (1): 31-36.
96 Peyrière H, Reynes J, Rouanet I, et al. Renal tubular dysfunction associated with tenofovir therapy: report of 7 cases[J]. J Acquir Immune Defic Syndr, 2004, 35 (3): 269-273.
97 庄辉,翁心华;参加乙型肝炎耐药讨论会专家. 核苷和核苷酸类药物治疗慢性乙型肝炎的耐药及其管理[J]. 肝脏, 2013, 18 (1): 1-10.
