卡托普利抑制胃癌细胞生长的体外研究*
2014-09-11程烽涛
蔡 敏 李 力 王 斌 程烽涛
上海市杨浦区中心医院消化内科(200090)
胃癌是我国常见的恶性肿瘤之一,尽管内镜技术、肿瘤基因组学、蛋白质组学等领域的进展使胃癌早期诊断取得了长足进步,但较多患者就诊时已处于中晚期,失去手术根治的机会。目前,胃癌化疗药物的研发进展有限。新药物研发周期长,耗资大且风险高。探索既有药物的新适应证已成为临床药物研发的一条捷径和重要策略。
肾素血管紧张素系统(renin-angiotensin system, RAS)是人体多种疾病发生的调节系统和靶分子作用部位。近年来RAS与肿瘤的关系备受关注。卡托普利是一种广泛应用的血管紧张素转换酶抑制剂(ACEI),可抑制RAS。诸多研究[1-3]显示,卡托普利对肺癌、乳腺癌、脑胶质瘤等肿瘤细胞增殖、侵袭、转移过程具有抑制作用。本研究通过探讨卡托普利对胃癌细胞增殖、凋亡和侵袭力的影响,以期为胃癌的治疗提供新途径。
材料与方法
一、细胞株、主要试剂
人胃癌细胞株AGS(中国科学院上海生命科学院细胞资源中心馈赠);卡托普利(美国Sigma公司);CCK-8 试剂盒、Annexin V-FITC/PI试剂盒、TUNEL试剂盒(碧云天生物技术研究所);DAPI试剂盒(美国Sigma公司);Transwell小室(美国Corning公司)。
二、方法
1. 细胞培养和干预:人胃癌细胞株AGS传代培养于含10%胎牛血清的RPMI1640培养基中,培养条件为37 ℃、5%CO2,待细胞状态稳定后,更换不含血清的RPMI1640培养基,分别加入不同浓度(0、1、2.5、5、10、15 mmol/L)卡托普利,培养24、48 h待测。
2. 细胞增殖检测:取卡托普利0、1、2.5、5、10、15 mmol/L组细胞,分别以2 000/个孔接种于96孔培养板,培养24、48 h后,每孔加入10 μL CCK-8溶液,继续培养2 h,置于酶标仪测定450 nm波长处各孔吸光度(A)值。细胞增殖率(%)=实验组A值/对照组A值×100%。
3. 细胞凋亡检测
①DAPI 染色:采用DAPI试剂盒,参考说明书对卡托普利0、5 mmol/L组的细胞进行染色,荧光显微镜下观察。
②Annexin V-FITC/PI双染法:将卡托普利0、5 mmol/L 组细胞用胰酶消化,加入PBS制成细胞悬液,加入Annexin V-FITC和PI染色液,上流式细胞仪检测细胞凋亡率。
③TUNEL法:取卡托普利0、5 mmol/L组细胞,按照TUNEL试剂盒说明书检测细胞凋亡情况。于普通光学显微镜下随机选取3个视野(×400)计数凋亡细胞数量。凋亡细胞核浓缩,呈蓝色荧光。计算细胞凋亡指数(AI)作为细胞凋亡率,AI(%)=(阳性细胞数/总细胞数)×100%。
4. 细胞侵袭力检测:取卡托普利0、1、2.5、5、10、15 mmol/L组细胞,将细胞按5×104/孔接种于Transwell小室的上室,培养24 h后用棉签擦去滤膜上层细胞,PBS清洗3遍,将下室置于4%多聚甲醛溶液中固定20 min,PBS清洗3遍,苏木精染色30 min,洗净背景色,于倒置荧光显微镜下随机选取4个视野(×100,×200),计数细胞,计算细胞侵袭率。
三、统计学分析
结 果
一、AGS细胞增殖率
CCK-8法检测结果显示,卡托普利1、2.5、5、10、15 mmol/L组的细胞增殖率均较卡托普利0 mmol/L 组显著降低,呈浓度依赖性(P<0.05)。相同浓度卡托普利处理48 h组的细胞增殖率较24 h 组显著降低(P<0.05)(见图1)。
二、AGS细胞凋亡情况
DAPI染色结果显示,卡托普利5 mmol/L组可见细胞呈凋亡形态学改变,表现为核浓缩或碎裂,核染色质呈新月形、圆形小体或不规则形状,染色加深,呈现不均一的蓝白色荧光。卡托普利0 mmol/L组细胞的细胞核完整,轻度表达均匀蓝色荧光(见图2)。
Annexin V-FITC/PI双染法检测结果显示,与卡托普利0 mmol/L组相比,卡托普利5 mmol/L组细胞凋亡率显著增加(P=0.012 1)(见图3)。TUNEL法检测结果显示,与卡托普利0 mmol/L组相比,卡托普利5 mmol/L组细胞凋亡率显著增加(P=0.002 7)(见图4)。
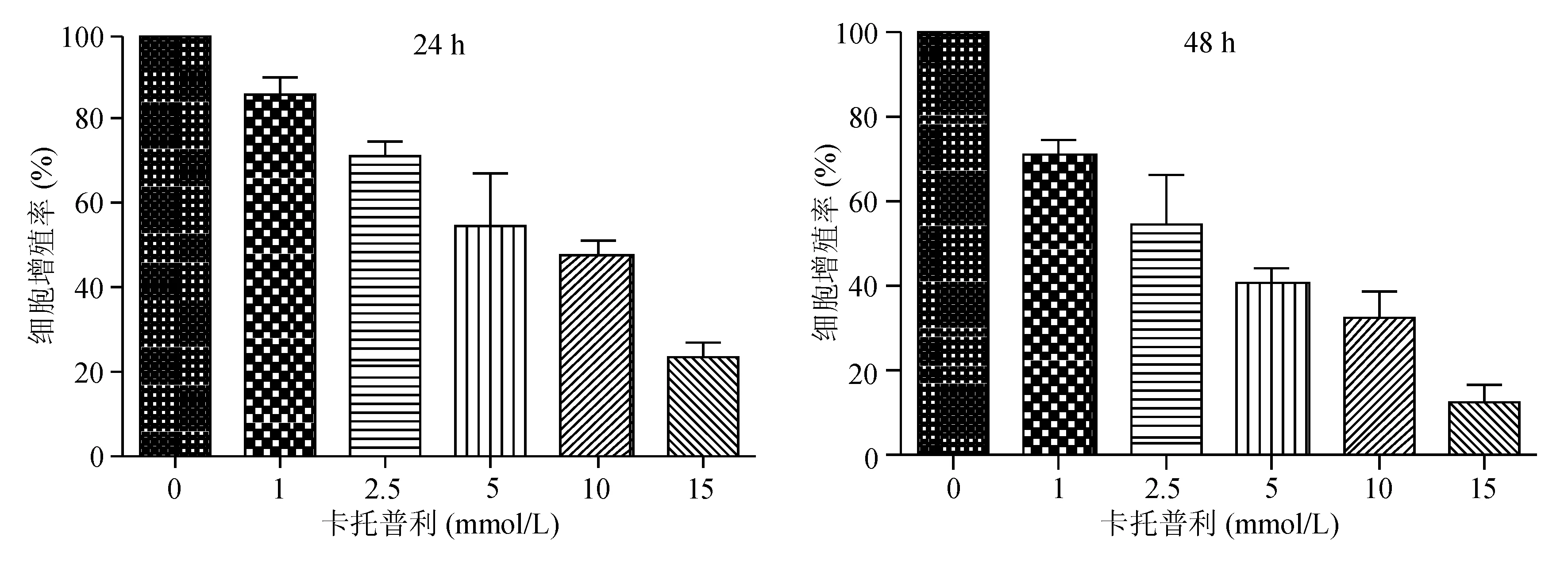
图1 CCK-8法检测卡托普利抑制AGS细胞增殖
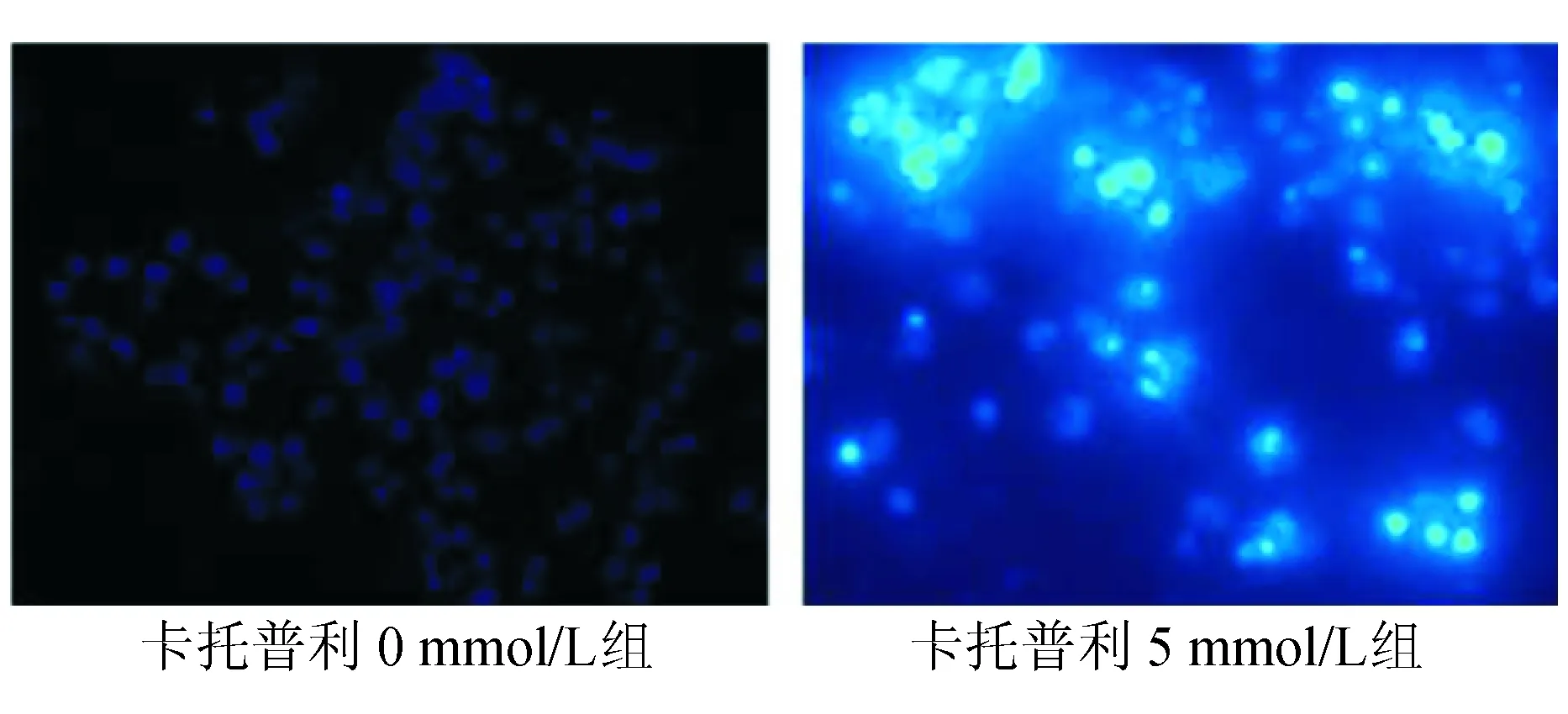
图2 DAPI染色结果(×400)
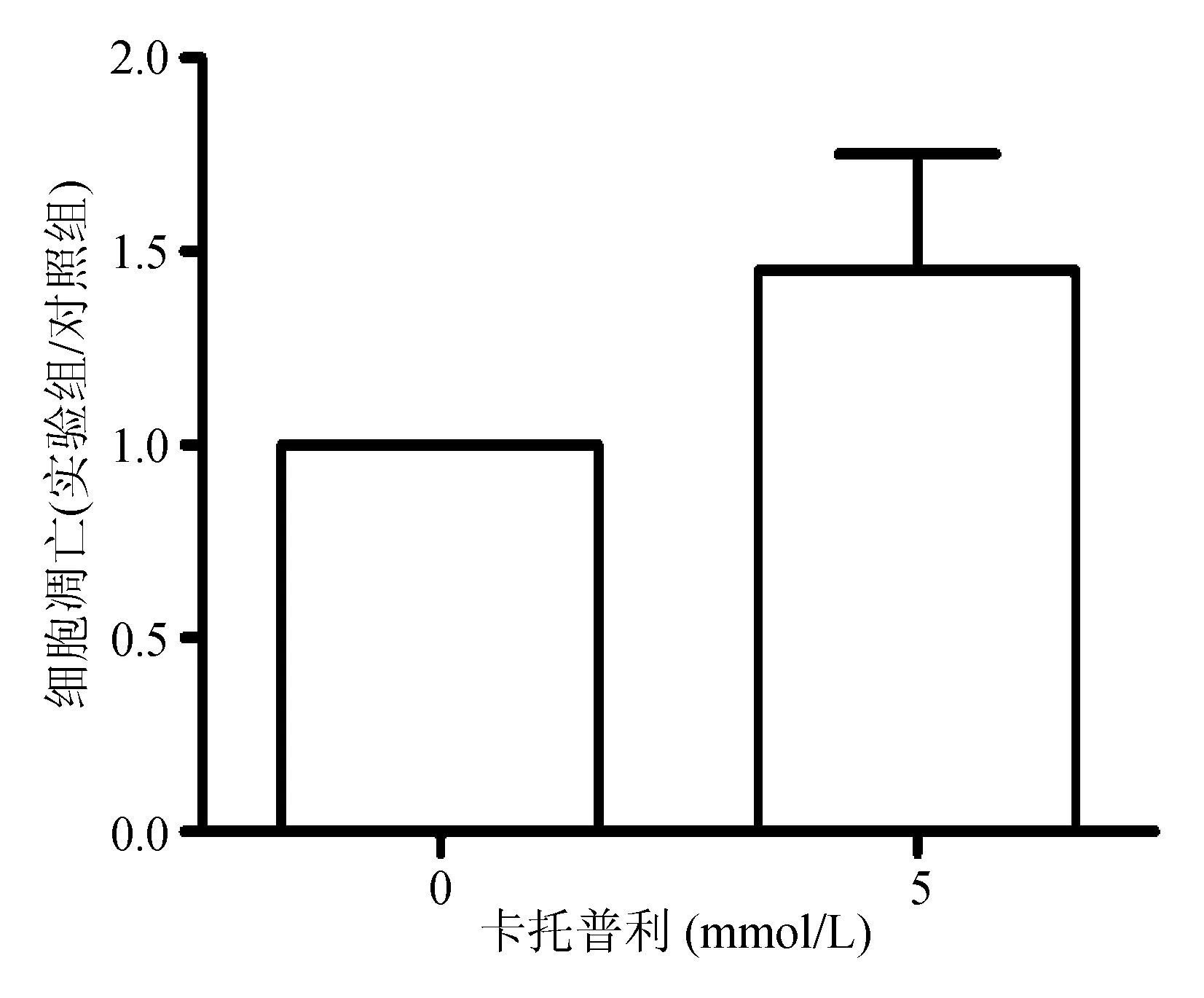
图3 Annexin V-FITC/PI双染法检测卡托普利促进AGS细胞凋亡
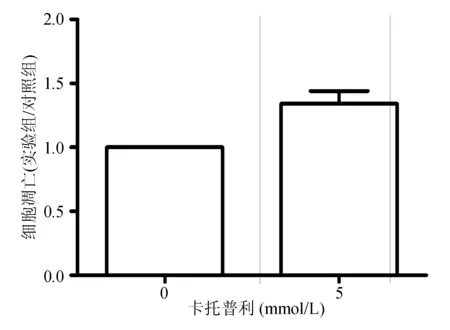
图4 TUNEL法检测卡托普利促进AGS细胞凋亡
三、AGS细胞侵袭力
Transwell法检测结果显示,卡托普利1、2.5、5、10、15 mmol/L组下室中的AGS细胞数量均较卡托普利0 mmol/L组显著减少,细胞侵袭率降低,呈浓度依赖性(P<0.05)(见图5)。
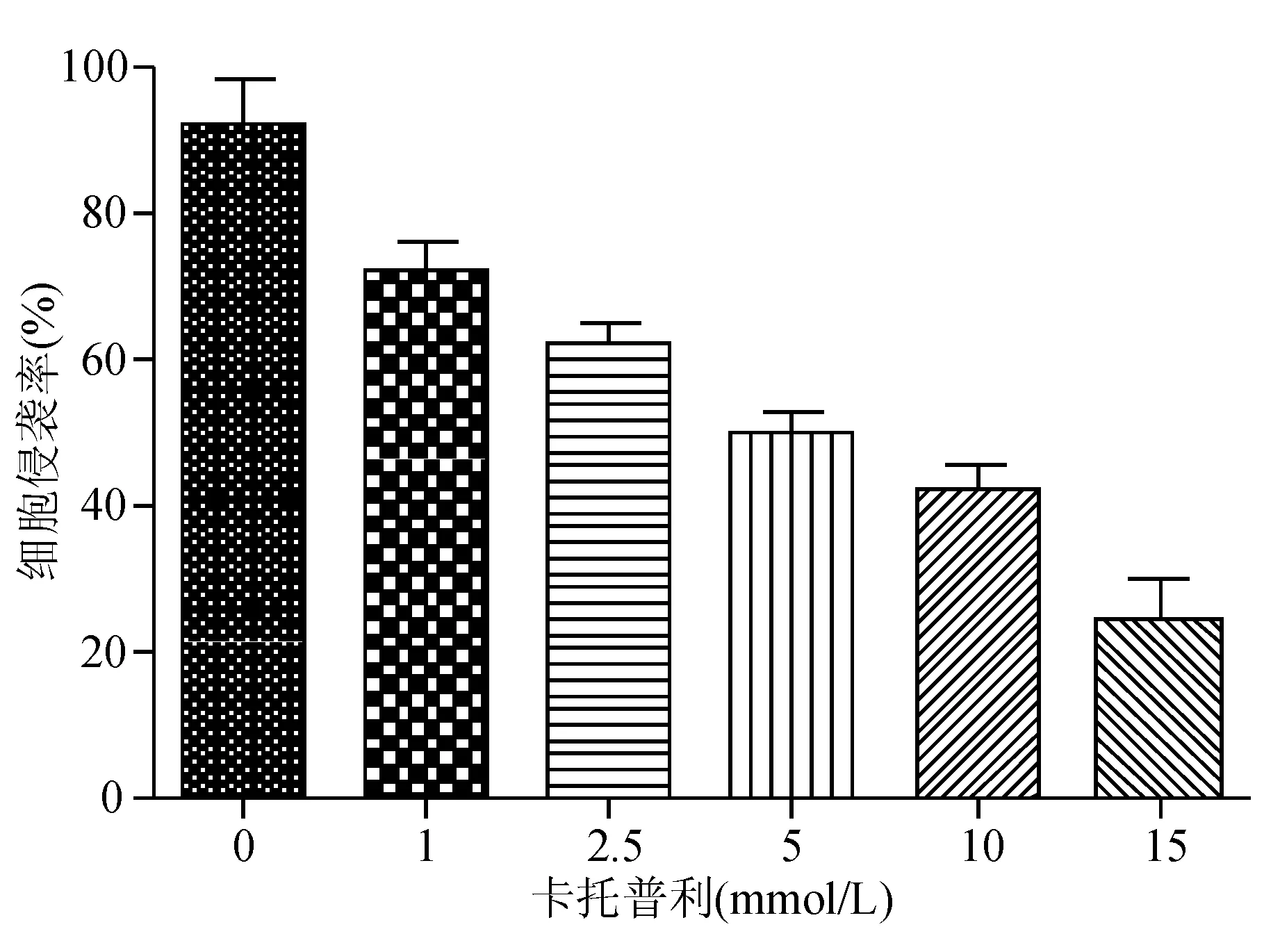
图5 Transwell法检测卡托普利抑制AGS细胞侵袭力
讨 论
RAS是机体进化过程中高度保守的内分泌网络,被认为是人体中作用最广泛的调节系统,广泛存在于心、脑、肝、肾、血管、脂肪、骨髓、胚胎等组织中,发挥自分泌、旁分泌作用。RAS不仅在动脉硬化、心力衰竭、血管生成、再灌注损伤、脑卒中等心脑血管病中发挥重要的病理生理作用,还在糖尿病、代谢综合征、肥胖症、帕金森病、老年痴呆、多发性硬化、肝硬化等疾病的发病机制中具有重要意义[4]。Sawyers[5]和Cully等[6]的研究指出,RAS与细胞增殖、凋亡等过程相关,RAS可促进心肌细胞、神经细胞、嗜铬细胞、成纤维细胞、血管内皮细胞、肺泡上皮细胞增殖,抑制凋亡。近来,RAS与肿瘤相关性的研究引起较大关注[7]。研究[8]指出,胃癌和肝癌等多种肿瘤组织低表达或不表达RAS,此为RAS抗肿瘤的研究提供了新思路。进一步研究[9-10]显示,ACEI作为RAS的抑制剂,可能对部分肿瘤具有抑制作用,但其作用机制尚未完全明确。
本研究发现,卡托普利可抑制胃癌细胞增殖,促进细胞凋亡,并减弱细胞的侵袭力,对胃癌的发生、发展过程具有抑制效应,且呈浓度和(或)时间依赖性。为进一步阐明卡托普利对胃癌的治疗价值以及尽早将其向临床应用转化,需阐明卡托普利抑制胃癌细胞增殖、促进胃癌细胞凋亡的作用机制。已有研究[11-13]表明,血管紧张素受体(AT)和过氧化物酶体增生物激活受体(PPAR)可能是卡托普利抑制肿瘤细胞的作用靶点。在肺癌中,卡托普利主要通过诱导肿瘤细胞凋亡抑制肿瘤发展[1],而在乳腺癌中,卡托普利主要通过调节乳腺癌细胞雌激素受体表达抑制肿瘤细胞增殖[2]。卡托普利在胃癌中的具体作用机制有待进一步研究。
尽管卡托普利已在体外被证实具有抗肿瘤的作用,但在大样本人群的研究中却存在争议。苏格兰一项纳入5 207例患者的回顾性研究[14]显示,长期应用ACEI可对肿瘤的发生具有抑制作用。然而,另一项瑞典的研究[15]则得出了否定的结论。由此可见,关于ACEI的抗肿瘤作用仍需进一步深入研究。
基于RAS的药物研究进展显著,现已有多种ACEI和血管紧张素受体阻断剂。作为临床常用药,其在高血压、肾脏疾病、糖尿病等的应用已得到公认,其良好的疗效和安全性已被长期临床实践证实,有助于深入研究RAS的生物学功能和开创新的治疗领域如肿瘤。本研究发现,卡托普利具有抗胃癌作用,其可抑制胃癌细胞增殖和侵袭,并诱导凋亡,此为探索新的胃癌治疗策略提供了理论依据。
1 Attoub S, Gaben AM, Al-Salam S, et al. Captopril as a potential inhibitor of lung tumor growth and metastasis[J]. Ann N Y Acad Sci, 2008, 1138: 65-72.
2 Small W Jr, Molteni A, Kim YT, et al. Captopril modulates hormone receptor concentration and inhibits proliferation of human mammary ductal carcinoma cells in culture[J]. Breast Cancer Res Treat, 1997, 44 (3): 217-224.
3 Nakagawa T, Kubota T, Kabuto M, et al. Captopril inhibits glioma cell invasioninvitro: involvement of matrix metalloproteinases[J]. Anticancer Res, 1995, 15 (5B): 1985-1989.
4 Fournier D, Luft FC, Bader M, et al. Emergence and evolution of the renin-angiotensin-aldosterone system[J]. J Mol Med (Berl), 2012, 90 (5): 495-508.
5 Sawyers CL. Finding and drugging the vulnerabilities of RAS-dependent cancers[J]. Cell, 2009, 137 (5): 796-798.
6 Cully M, Downward J. SnapShot: Ras Signaling[J]. Cell, 2008, 133 (7): 1292-1292.e1.
7 Regulska K, Stanisz B, Regulski M. The renin-angiotensin system as a target of novel anticancer therapy[J]. Curr Pharm Des, 2013, 19 (40): 7103-7125.
8 Ager EI, Neo J, Christophi C. The renin-angiotensin system and malignancy[J]. Carcinogenesis, 2008, 29 (9): 1675-1684.
9 Escobar C, Barrios V. An evaluation of the latest evidence relating to renin-angiotensin system inhibitors[J]. Expert Opin Drug Metab Toxicol, 2013, 9 (7): 847-858.
10 Wen SW, Ager EI, Neo J, et al. The renin angiotensin system regulates Kupffer cells in colorectal liver metastases[J]. Cancer Biol Ther, 2013, 14 (8): 720-727.
11 Rivat C, Rodrigues S, Bruyneel E, et al. Implication of STAT3 signaling in human colonic cancer cells during intestinal trefoil factor 3 (TFF3) -- and vascular endothelial growth factor-mediated cellular invasion and tumor growth[J]. Cancer Res, 2005, 65 (1): 195-202.
12 Fujita M, Hayashi I, Yamashina S, et al. Angiotensin type 1a receptor signaling-dependent induction of vascular endothelial growth factor in stroma is relevant to tumor-associated angiogenesis and tumor growth[J]. Carcinogenesis, 2005, 26 (2): 271-279.
13 Schupp N, Schinzel R, Heidland A, et al. Genotoxicity of advanced glycation end products: involvement of oxidative stress and of angiotensin Ⅱ type 1 receptors[J]. Ann N Y Acad Sci, 2005, 1043: 685-695.
14 Lever AF, Hole DJ, Gillis CR, et al. Do inhibitors of angiotensin-Ⅰ-converting enzyme protect against risk of cancer[J]? Lancet, 1998, 352 (9123): 179-184.
15 Lindholm LH, Anderson H, Ekbom T, et al. Relation between drug treatment and cancer in hypertensives in the Swedish Trial in Old Patients with Hypertension 2: a 5-year, prospective, randomised, controlled trial[J]. Lancet, 2001, 358 (9281): 539-544.
