结直肠癌细胞中RAD18与FANCD2蛋白相互作用的实验研究*
2014-09-11乐贻军钟雄平陈业金
乐贻军 王 红 钟雄平 刘 超 陈业金
广州医科大学附属广州市第一人民医院消化科(510180)
范可尼贫血(FA)是一种常染色体或X染色体连锁的隐性遗传性疾病,在各人种中均有发现,FA患者的主要特征是骨髓造血功能障碍、先天性畸形以及对肿瘤易感性升高[1-2]。迄今已发现与FA疾病相关基因15个,一旦这些基因出现突变就会出现FA或类似FA的综合征[2]。由这些基因编码的蛋白共同组成了所谓的FA通路,目前大量研究显示该通路主要对DNA的交联损伤起修复作用,对维持细胞染色体稳定具有重要作用[2-3]。FANCD2蛋白泛素化被认是FA DNA损伤修复通路中重要的激活步骤[2],近年来其在肿瘤中作用的研究越来越多。我们的前期研究已经证明在结直肠癌SW480细胞中通过siRNA干扰RAD18,可抑制FANCD2蛋白泛素化并增强其对丝裂霉素的敏感性[4],表明RAD18在SW480细胞中具有调节FANCD2泛素化的功能。但RAD18对FANCD2蛋白的调节作用是直接还是间接以及作用位点如何都有待进一步研究。本实验采用免疫共沉淀技术以及GST pull-down技术对两者间的相互作用关系进行初步验证。
材料与方法
一、主要材料
结直肠癌SW480细胞由南方医科大学消化病研究所提供并由本实验室保存,pGEX-4T-RAD18重组表达载体和pGEX-4T-1质粒均由广州纽克利公司负责构建并经测序鉴定正确,BL21感受态细胞购自广州微科生物技术有限公司。RAD-18抗体、FANCD2抗体由Santa Cruz公司提供,兔IgG抗体、琼脂糖珠子、HRP二抗由Bioworld公司提供。GST融合蛋白纯化珠由生工生物工程(上海)股份有限公司提供。
二、方法
1. 细胞培养:SW480细胞置于含10%胎牛血清、100 U/mL青霉素和100 μg/L链霉素的RPMI-DMEM高糖培养基中,按时传代培养。
2. 蛋白提取:细胞传代后培养于直径10 cm培养皿中,当细胞融合度达80%左右,以预冷的PBS洗涤2~3次,吸干PBS后再将其刮下,并以适量PBS冲洗。吸取冲洗液置离心管于2 000 r/min离心3 min,弃上清。培养皿加入1 mL含苯甲基磺酰氟(PMSF)的细胞裂解液,冰上震荡裂解15 min。收集裂解产物于1.5 mL离心管,14 000 r/min 4 ℃离心15 min,取上清。BCA法行蛋白定量后,将蛋白分为两份,分别用于蛋白质印迹检测和免疫共沉淀以及反向免疫共沉淀。
3. 免疫共沉淀:将裂解液分成三等份,1份加入10 μL兔IgG抗体作为阴性对照,1份不加抗体作为空白对照,1份加入10 μL FANCD2抗体,摇床4 ℃孵育过夜,每份加入100 μL的琼脂糖珠子,摇床4 ℃孵育6 h,2 000 r/min 离心2 min,去上清,以1.5 mL预冷的PBS反复离心洗5次,去上清,以5×上样缓冲液20 μL于100 ℃变性10 min,2 000 r/min离心3 min,收集上清,于-20 ℃保存,用于10% SDS-PAGE电泳。
4. 反向免疫共沉淀:将用于反向免疫共沉淀的裂解液分成三等份,其中1份加入10 μL兔 IgG抗体作为阴性对照,1份不加抗体作为空白对照,1份加入10 μL FANCD2抗体行反向免疫共沉淀。
5. 蛋白质印迹法:将细胞裂解液以及免疫共沉淀方法收集的沉淀产物电泳,一抗RAD18抗体1∶500稀释,FANCD2抗体1∶1 000稀释,HRP标记的二抗1∶5 000稀释,ECL化学发光,用Vilber凝胶图像成像仪采集图像。
6. 重组体质粒转化:①将BL21感受态细胞在冰浴上融化,取50 μL加入无菌EP管中,加入1 μL目的基因,混匀,冰浴中放置30 min。②将EP管于42 ℃水浴中热激活45 s,然后快速转移至冰浴中25 min,期间勿摇动EP管。③向EP管中加入500 μL的LB培养液,混匀后置于37 ℃,200 r/min恒温摇床培养1 h,使细菌复苏。④吸取EP管中的培养液将其均匀铺在含有氨苄西林的LB固体培养基的培养皿中,并置于37 ℃细菌培养箱中培养过夜直至培养皿上出现肉眼可见的菌落。⑤挑取单克隆菌落置含4 mL LB培养液的离心管中,培养菌液置波长600 nm 处测吸光度(A)值为0.4~0.6。⑥EP管中加入1 mL甘油,分装,部分细菌样品置-80 ℃冰箱保存,部分送上海英骏生物技术公司测序。
7. 融合蛋白的诱导表达:①分别将测序正确的重组菌(pGEX-4T-RAD18)和对照菌(pGEX-4T-1)解冻,按1∶100接种至10 mL含氨苄西林的LB培养基的离心管中,260 r/min, 37 ℃摇床培养过夜。②培养菌液置波长600 nm处测A值为0.4~0.6,加入1 mol/L异丙基-β-D-硫代吡喃半乳糖苷(IPTG)储液至终浓度分别为0.1、0.2、0.4、0.8 mmol/L,分别置于37 ℃恒温培养箱中,摇床 260 r/min,培养12 h。③将离心管置于离心机中4 000 r/min 4 ℃离心10 min,收集细菌。④以PBS漂洗细菌沉淀,4 000 r/min 4 ℃离心10 min,分装至1.5 mL离心管,置于-80 ℃保存。⑤取离心管中细菌沉淀,加入60 μL的PBS和20 μL蛋白上样缓冲液,100 ℃金属浴10 min,进行蛋白质印迹法检测融合蛋白的表达情况。
8. 融合蛋白提取和纯化:①按照预实验挑选最佳条件培养的重组菌(200 mL),4 000 r/min离心15 min,去上清,分别加入1 mL预冷PBS重悬细菌沉淀,并移入1.5 mL离心管,4 000 r/min离心10 min,反复此步骤2~3次。②将最后离心的上清去除,吸取200 μL细菌裂解液、20 μL PMSF和40 μL溶菌酶液将沉淀重悬,放入37 ℃水浴箱中孵育30 min。③将试管放入摇床中200 r/min 10 min,加入2 μL脱氧核糖核酸酶/核糖核酸酶(D/RNase酶),继续放入摇床中37 ℃摇10 min。④将离心管放入4 ℃冷冻离心机中,12 000 r/min离心10 min,取上清。⑤分别在融合蛋白GST-RAD18和阴性对照GST中加入50 μL GST融合蛋白纯化珠,将1.5 mL离心管置4 ℃冰箱转子中孵育过夜。⑥将离心管放入4 ℃冷冻离心机,4 000 r/min离心5 min,弃上清。⑦以无菌预冷的1 mL PBS重悬GST纯化珠,将离心管放入4 ℃冷冻离心机中,4 000 r/min离心5 min,弃上清,反复3次。⑧向最后剩下的GST纯化珠加入适量的蛋白上样缓冲液,煮沸10 min,进行Bradford染色,检验蛋白纯化情况。
9. GST pull-down 实验:①将提取的细胞总蛋白加入纯化过的GST融合蛋白纯化珠中,置4 ℃冰箱转子中孵育6 h;②将孵育的纯化融合蛋白从转子上取出,3 000 r/min 4 ℃离心2 min,弃上清液,加入1.5 mL预冷的细胞裂解缓冲液,漂洗离心,弃上清。上述过程重复3次;③加入蛋白上样缓冲液,100 ℃金属浴加热10 min,迅速置于冰上,室温 2 000 r/min离心3 min,用于蛋白质印迹检测。
结 果
一、免疫共沉淀和反向免疫共沉淀
在以FANCD2抗体免疫共沉淀下来的蛋白复合物中可检测到微弱的RAD18蛋白(图1)。在以RAD18抗体免疫共沉淀下来的蛋白复合物中可检测到FANCD2蛋白(图2)。
二、融合蛋白的表达
IPTG浓度为0.1、0.2、0.4、0.8 mmol/L诱导的菌液中均可见RAD18的表达。应用Quantity One软件对条带进行灰度分析,在IPTG浓度为0.4 mmol/L时RAD18的表达最高(图3)。

泳道1:加入FANCD2抗体的免疫沉淀;泳道2:SW480细胞裂解原液;泳道3:兔 IgG抗体阴性对照;泳道4:琼脂糖珠子空白对照
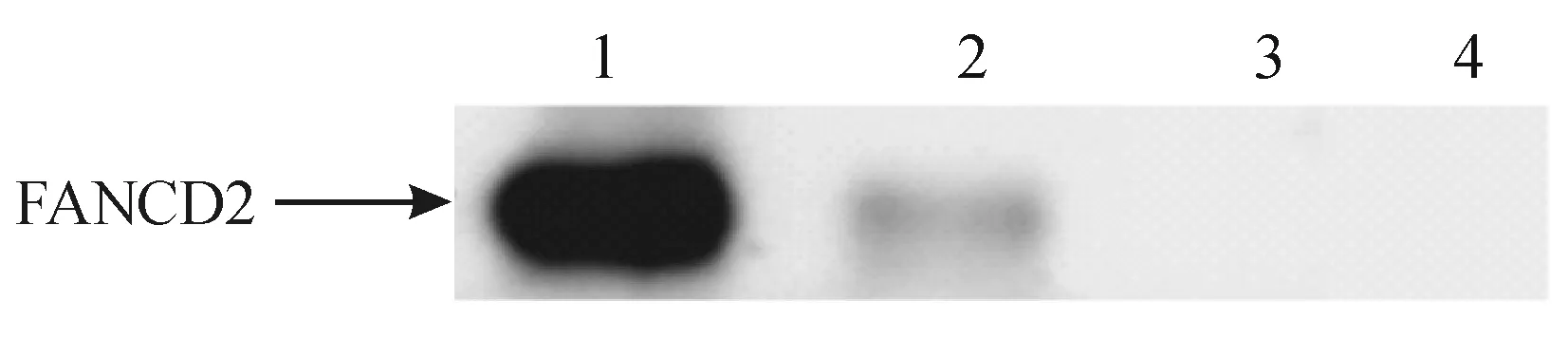
泳道1:SW480细胞裂解原液;泳道2:加入RAD18抗体的免疫沉淀;泳道3:兔 IgG抗体阴性对照;泳道4:琼脂糖珠子空白对照
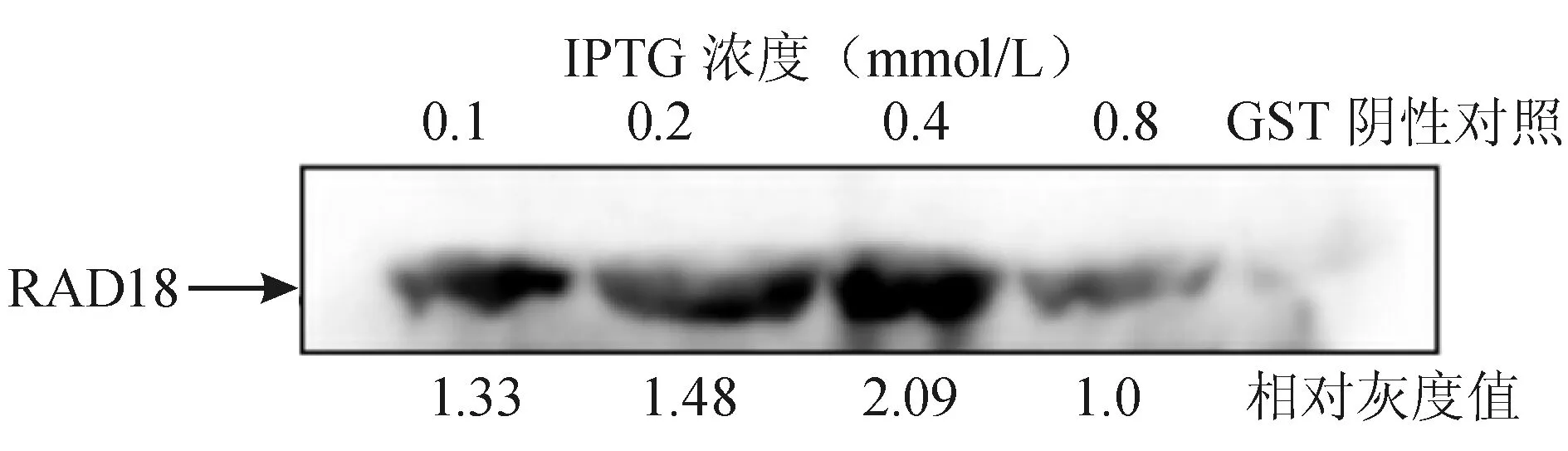
图3 融合蛋白表达电泳图
三、融合蛋白提取和纯化
在70~100 kDa(1 Da=0.992 1 u)之间,泳道3(箭头处)可见深染的蛋白条带,证明纯化有效(图4)。

泳道1:SW480细胞裂解液;泳道2:蛋白Marker;泳道3:纯化后的细菌裂解液;泳道4:诱导后的细菌裂解液
四、GST pull-down 实验
用细菌表达的GST-RAD18蛋白作诱饵蛋白时,可捕获结直肠癌SW480细胞中的FANCD2蛋白(图5)。

泳道1:GST pull-down组;泳道2:SW480细胞裂解液;泳道3:GST阴性对照
讨 论
目前,有研究显示在人类骨肉瘤细胞、宫颈癌细胞和肺癌细胞中均发现RAD18能通过E3泛素连接酶活性调节FANCD2单泛素化和FANCD2核灶区的形成[2,5]。我们的前期研究已表明RAD18在SW480细胞中具有调节FANCD2泛素化的功能[4]。但RAD18对FANCD2泛素化具体的调节机制目前尚不清楚。
本研究中,我们通过使用目的蛋白抗体结合目的蛋白并加琼脂糖珠子沉淀抗原抗体复合物,经过反复洗涤,最终获得的复合物中主要含有抗体、目的蛋白、琼脂糖珠子以及其他一些非特异性结合蛋白。在复合物中加入上样缓冲液进行煮沸变性后,通过离心可除去琼脂糖珠子,上清液中便只有抗体和目的蛋白复合物以及少量非特异性吸附蛋白。由于上样缓冲液中的二硫苏糖醇(DTT)会导致抗体重链与轻链之间的二硫键被破坏,从而使抗体分子变成重链分子(分子量为 50 kDa)和轻链分子(分子量为 25 kDa)[6],实验中通过加入兔IgG阴性对照以及不加抗体的空白对照可排除这些干扰,反向实验进一步验证了结果的可靠性。GST pull-down实验是一种体外验证蛋白之间相互作用的方法,有一定的假阳性。Wissmueller等[7]报道GST标签会使KLF3蛋白部分不能正确折叠,并使KLF3和GATA-1出现假阳性结果,所以GST pull-down的结果如果不能用其他方法证实,其可信度还有待商榷。但结合免疫共沉淀实验我们可以确信两种蛋白之间确实存在相互作用。
目前,对于RAD18的结构研究比较清楚,包含有5个不同的结构域:RING位点、UBZ位点、 SAP位点、 RAD6结合位点以及DNA聚合酶结合位点。
RAD18蛋白可以通过1个保守的环指状亚基与RAD6相互作用。RAD6A和RAD6B与RAD18组成复合体共同泛素化PCNA164位点上的赖氨酸,并且环指状亚基的突变会引起DNA损伤修复的缺陷以及对诱变剂的高敏感性[8]。可以推测RAD18有可能通过类似泛素PCNA的方式使FANCD2泛素化,从而可以通过构建局部结构域缺失的重组RAD18蛋白,进一步研究RAD18与FANCD2蛋白之间的作用位点。
1 Dorsman JC, Levitus M, Rockx D, et al. Identification of the Fanconi anemia complementation group I gene, FANCI [J] .Cell Oncol, 2007, 29 (3): 211-218.
2 Williams SA, Longerich S, Sung P, et al. The E3 ubiquitin ligase RAD18 regulates ubiquitylation and chromatin loading of FANCD2 and FANCI[J]. Blood, 2011, 117 (19): 5078-5087.
3 Sato K, Toda K, Ishiai M, et al. DNA robustly stimulates FANCD2 monoubiquitylation in the complex with FANCI[J]. Nucleic Acids Res, 2012, 40 (10): 4553-4561.
4 钟雄平, 陈业金, 孔红祥, 等. siRNA沉默RAD18抑制结肠癌SW480细胞FANCD2蛋白泛素化并增强其对丝裂霉素C的敏感性[J]. 实用医学杂志, 2013, 29 (11): 1731-1733.
5 Park HK, Wang H, Zhang J, et al. Convergence of Rad6/Rad18 and Fanconi anemia tumor suppressor pathways upon dna damage[J]. PLoS One, 2010, 5 (3): e13313.
6 杨亮, 杨细飞, 张毅, 等. 利用免疫共沉淀技术验证SET与eEF1A1在人肝细胞内的相互作用[J]. 农业科学与技术, 2010, 11 (8): 87-90.
7 Wissmueller S, Font J, Liew CW, et al.Protein-protein interactions: analysis of a false positive GST pulldown result[J]. Proteins, 2011, 79 (8): 2365-2371.
8 Masuda Y, Suzuki M, Kawai H, et al. Asymmetric nature of two subunits of RAD18, a RING-type ubiquitin ligase E3, in the human RAD6A-RAD18 ternary complex[J]. Nucleic Acids Res, 2012, 40 (3): 1065-1076.
